姜黄素对人肝癌细胞SMCC-7721增殖及干细胞标志物表达的影响及机制※
2016-03-08潘战宇闫祝辰刘东颖姜战胜
王 斌 潘战宇 闫祝辰 刘东颖 兰 岚 王 琮 姜战胜
(天津医科大学肿瘤医院中西医结合科,天津 300060)
论 著
姜黄素对人肝癌细胞SMCC-7721增殖及干细胞标志物表达的影响及机制※
王 斌 潘战宇 闫祝辰 刘东颖 兰 岚 王 琮 姜战胜
(天津医科大学肿瘤医院中西医结合科,天津 300060)
目的 观察姜黄素对人肝癌细胞SMCC-7721增殖及干细胞标志物表达的影响,并探讨其相关机制。方法 实验分为对照组、姜黄素组、AG490组、姜黄素+AG490组,其分别作用于人肝癌细胞SMCC-7721后,通过噻唑蓝(MTT)法分别检测其对人肝癌细胞SMCC-7721生长的抑制作用;通过Western blot法、RT-PCR法分别检测各组人肝癌细胞SMCC-7721中转录激活因子3(STAT3)、p-STAT3、CD24、CD133、CD44和CD90蛋白的表达及mRNA的变化。结果 姜黄素可明显抑制人肝癌细胞SMCC-7721的增殖,同时下调STAT3、p-STAT3、CD24、CD133、CD44和CD90蛋白表达;其作用强度较AG490稍弱,但两药合用显示出一定的协同效果。结论 姜黄素抑制人肝癌细胞SMCC-7721的增殖,降低人肝癌细胞SMCC-7721中CD24、CD133、CD44和CD90表达,其机制可能与调控STAT3磷酸化相关。
姜黄素;肝肿瘤;基因表达;细胞凋亡;中药疗法
姜黄素是从姜科、天南星科中一些植物根茎中提取的一种化学成分,近年来已成为肿瘤预防和治疗的一个研究热点[1-2],在肿瘤干预及治疗领域有较多报道。然而,目前关于姜黄素抗肝癌治疗作用的机制方面尚无明确定论,近年来,姜黄素对信号转导与转录激活因子3(Signal Transducer and Activator of Transcription 3,STAT3)活性的调控作用越来越受人们重视,姜黄素抑制肝癌细胞的机制是否也是通过抑制两面神激酶(Janus Kinase)JAK-STAT信号通路STAT3磷酸化(p-STAT3)途径完成的,目前尚缺乏证据及相关研究。本研究通过姜黄素作用于人肝癌细胞SMCC-7721,从基因水平及蛋白水平探讨姜黄素抑制肝癌细胞增殖的机制,并进一步观察姜黄素通过调控STAT3磷酸化是否可干预肝癌干细胞标志物的表达,为姜黄素治疗肝癌进一步提供理论依据。
1 材料与方法
1.1 材料 姜黄素(中国药品生物制品检定所,批号110715-200815),JAK2激酶抑制剂AG490(美国Calbiochem公司),胎牛血清和RPMI-1640培养基(31800022,美国,GIBCO公司),Trizol RNA提取试剂(15596018,美国,invitrigen公司),逆转录试剂盒(Fermentas,K1622),SYBGREE实时定量PCR试剂盒(DRR096A,Takara公司),Bradford蛋白测定试剂盒(WB2001,上海经科化学科技有限公司),STAT3、p-STAT3、CD24、CD133、CD44、CD90抗体(Abcam公司);超净工作台(BSC-1000IIB2,中国,苏州安泰空气有限公司),CO2培养箱(BB15,美国,Heraeus公司),TS100荧光倒置显微镜(TS100,日本,Nikon公司),低温高速离心机(ALLEGRA X-12,美国,Beckman公司),电泳仪、转移电泳槽(DYCP-31C,中国,北京市六一仪器厂),凝胶成像仪(1600R,中国,上海天能公司),流式细胞仪(C6,美国,BD公司),荧光定量PCR仪(ABI7500,美国ABI公司)。
1.2 细胞培养 人肝癌细胞株SMMC-7721培养于RPMI-1640培养液中,内含10%的胎牛血清、100 U/mL青霉素及100 U/mL链霉素,置37.0 ℃、饱和湿度、5%CO2恒温密闭式孵箱内培养传代,平均3~4 d传代1次。人肝癌细胞株SMMC-7721为天津医科大学肿瘤医院实验室保存。
1.3 药物稀释及实验分组 姜黄素用二甲基亚砜(DMSO)助溶,用RPMI-1640培养液稀释成60 μmol/L,-20 ℃保存备用。AG490溶液配置:1.47 mg AG490溶于100 mL 1640培养液中,使其终浓度为50 μmol/L,-20 ℃避光保存备用,避免反复冻融。本研究共分为4组:①对照组(只加培养基);②AG490组(50 μmol/L);③姜黄素组(60 μmol/L);④姜黄素+AG4910组(60 μmol/L姜黄素+50 μmol/L AG490)。
1.4 噻唑蓝(MTT)法检测姜黄素对人肝癌细胞株SMCC-7721增殖的影响 接种对数生长期SMCC-7721细胞至96孔培养板,每孔100 μL,培养24 h后,弃原培养液,加入各组药物,每个浓度设5个平行复孔,培养48 h后倾去培养液,每孔加入MTT溶液(5 mg/mL)20 μL,继续孵育4 h,倾去MTT溶液,每孔加入DMSO 200 μL,振荡10 min,用酶标仪检测波长490 nm处的吸光度(OD)值,绘制细胞抑制曲线,计算SMCC-7721细胞各组增殖抑制率。
1.5 RT-PCR法检测相关基因mRNA变化 各组药物作用SMCC-7721细胞24 h,经胰蛋白酶消化后制成单细胞悬液,以Trizol试剂盒提取实验组与对照组细胞总RNA,从中取1 μL溶于99 μL焦碳酸二乙酯(DEPC)水中,通过紫外分光光度计测定260 nm和280 nm光密度值,计算RNA的纯度。按照试剂盒说明书进行反转录、PCR反应。
引物根据文献[3-7]获得,由上海生工合成,序列如下:

STAT3上游引物:5'-GGAGGAGGCATTCGGAAAG-3',下游引物:5'-TCGTTGGTGTCACACAGAT-3';CD24上游引物:5'-CCAGGGGCAATGATGAATGAGA-3',下游引物:5'-GGGAGGCTGAGGCAGGAGAAT-3';CD133上游引物:5'-CACTCTATACCAAAGCGCAA-3',下游引物:5'-CACGATGCCACTTTCTCAC-3';CD44上游引物:5'-ACCCCATCCCAGACGAAGACAGTC-3',下游引物:5'-GGGATGAAGGTCCTGCTTTCCTTCG-3';CD90上游引物:5'-CGCCATGAGAATACCGCAG-3',下游引物:5'-CCCTCGTCCTTGCTAGTGA-3';GAPDH上游引物:5'-ACCACCATGGAGAAGGCTGG-3',下游引物:5'-CTCAGTGTAGCCCAGGATGC-3'。
1.6 Western blot法检测相关蛋白表达变化 各组药物作用SMCC-7721细胞24 h,与对照组细胞用0.9%氯化钠注射液清洗3次,加入适量预冷的细胞裂解液冰浴裂解30 min,移至EP管,12 000 r/min 4 ℃离心20 min,吸取上清液,Bradford法测定蛋白浓度。按常规方法灌制10%的SDS聚丙烯酰胺凝胶,实验样本每道点样20 μL,80伏电压下电泳2 h后,电转印至PVDF膜上。5%脱脂奶粉的磷酸盐缓冲液(PBST)室温封闭2 h后,加入含2%脱脂奶粉的PBST稀释的一抗,4 ℃孵育过夜。TBST洗膜6次后,加入辣根过氧化物酶(HRP)标记的二抗(1∶5000),室温孵育45 min,TBST洗膜6次后与电化学发光法(ECL)化学发光试剂显色2 min,曝光X胶片。
2 结 果
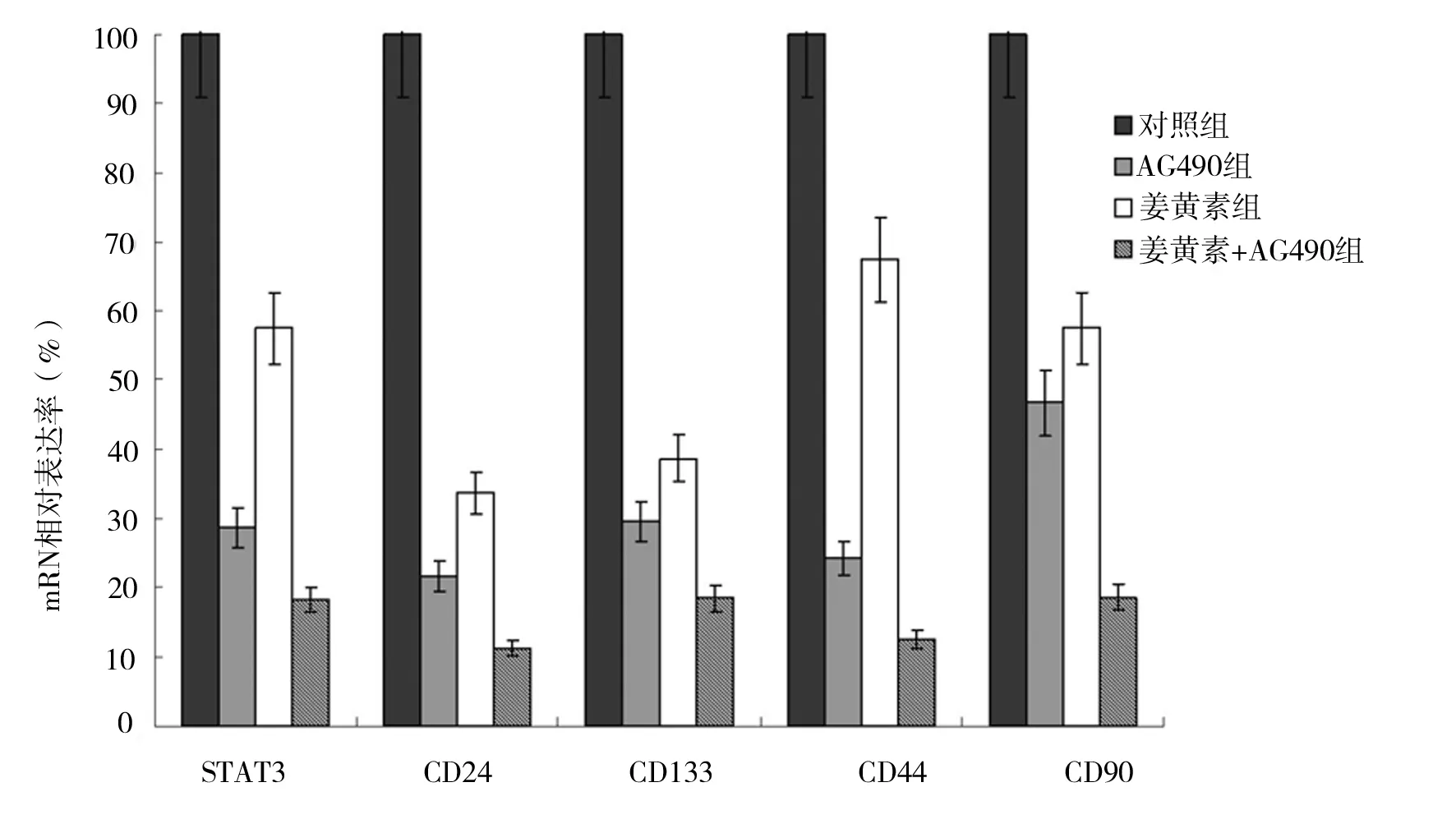
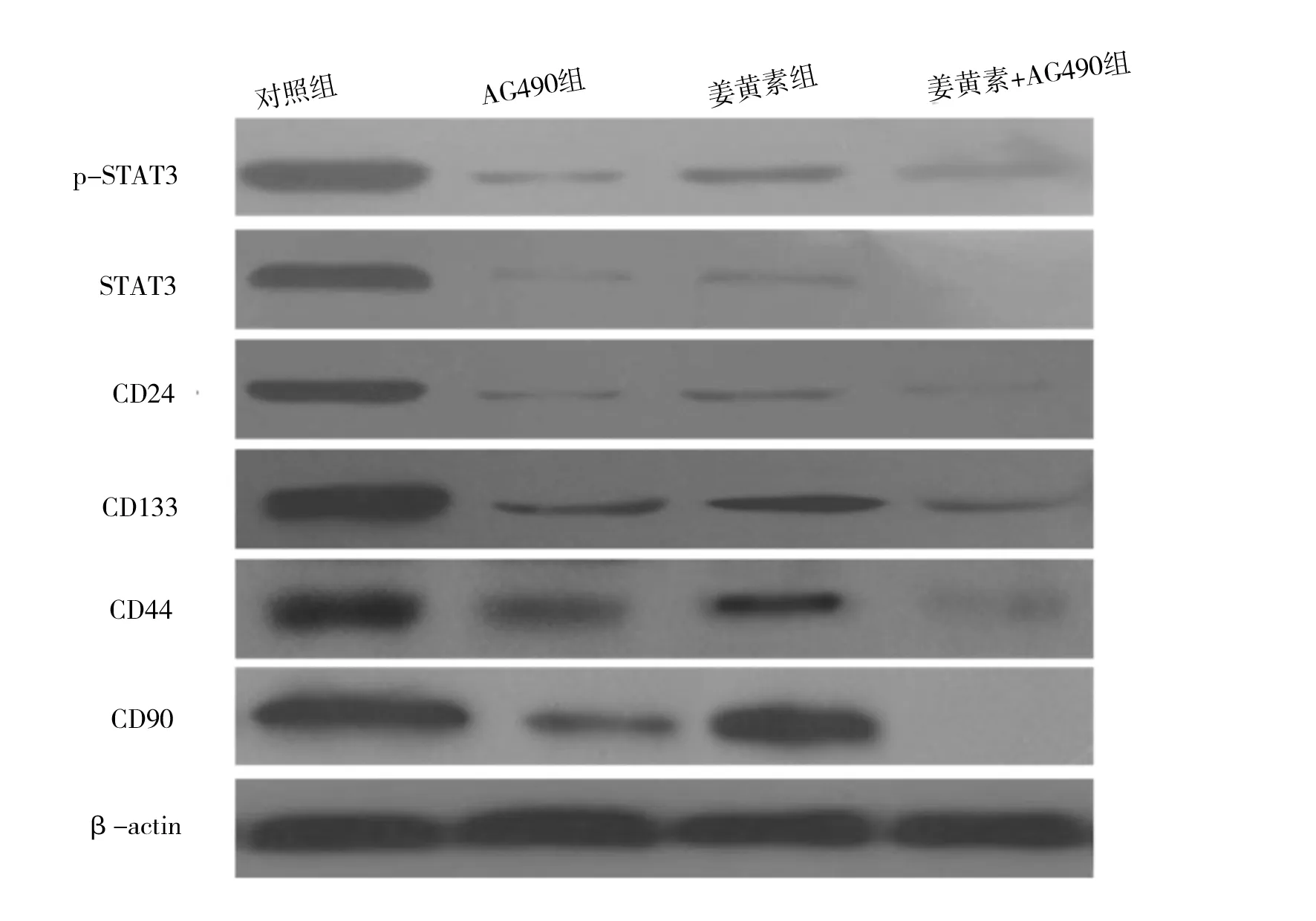
2.1 姜黄素抑制人肝癌细胞SMCC-7721增殖 MTT法检测结果显示,人肝癌细胞SMCC-7721经不同分组的药物作用后,姜黄素显示了一定的抑制增殖作用,不同分组抑制作用表现为姜黄素组 图1 各组不同药物浓度细胞抑制率情况 2.2 姜黄素对人肝癌细胞SMCC-7721相关基因mRNA水平的影响 RT-PCR检测结果显示,如“1.3”中分组STAT3 mRNA表达分别是对照组的29.4%、60.2%和18.3%;CD24 mRNA表达分别是对照组的21.7%、35.0%和12.0%;CD133 mRNA表达分别是对照组的30.8%、40.9%和18.8%;CD44 mRNA表达分别是对照组的25.1%、68.4%和12.8%;CD90 mRNA表达分别是对照组的47.9%、61.0%和18.9%(见图2)。 2.3 姜黄素对人肝癌细胞SMCC-7721相关蛋白的影响 蛋白质印迹法检测结果显示,与对照组相比,各分组的药物作用人肝癌细胞SMCC-7721 24 h后,STAT3、p-STAT3、CD24、CD133、CD44和CD90表达均显著减少,说明姜黄素能下调肝癌细胞SMCC-7721细胞相关蛋白的表达,且与阳性对照药AG490有协同作用(见图3)。 图2 姜黄素对人肝癌细胞SMCC-7721相关基因mRNA表达的影响 图3 姜黄素对人肝癌细胞SMCC-7721相关蛋白表达的影响 Janus激酶/信号转导和转录激活因子(Janus Kinase/signal transducers and activators of transcription,JAK/STAT)信号通路是近年发现的一条由细胞因子刺激的信号转导通路,STAT3作为STAT家族成员之一,是JAK-STAT信号通路中重要信号因子,磷酸化的STAT3(p-STAT3)是其激活后的形式。正常信号转导中STAT3蛋白的激活快速而短暂,异常激活的JAK-STAT信号通路与肿瘤的发生、发展、侵袭、转移及预后密切相关。在许多肿瘤的形成过程中发现有STAT3持续激活[8-10]。其在恶性肿瘤发生发展中的作用备受关注,是多种人类肿瘤干预治疗有效的分子标靶之一[11]。近年来,JAK-STAT信号通路与肝癌的关系越来越受人们重视。 肿瘤干细胞是近几年提出的关于肿瘤发生、发展机制的新理论,该理论认为导致肿瘤发生和维持肿瘤生长的是一小群叫做肿瘤干细胞的细胞,这些细胞在肿瘤组织中数量极少,具有自我更新、分化及抗治疗能力等干细胞特性,影响着肿瘤的进展、复发和转移,只有消灭这些细胞才能根治肿瘤。 《Cell stem cell》在2011年7月发表了香港大学李嘉诚医学院的一项新的研究成果[12]。在研究中发现导致肝癌复发及产生化疗抗药性的元凶是一种癌干细胞,只要抑制该干细胞传递消息的蛋白物,就可提升治疗肝癌的效果。并利用基因表达谱芯片找出了癌干细胞的表面标志物CD24+。进一步的研究中还突破性地拆解了CD24+标志的癌干细胞启动肿瘤发展和自我更新的机制。研究发现,CD24+标志的癌干细胞是通过激活STAT3信号来维持肝癌干细胞自我更新,促使肿瘤形成。研究结果表明,STAT3磷酸化在CD24+信号传递中起关键性作用。研究人员相信通过抑制STAT3磷酸化可控制肿瘤生长,大大提升完全消减肝癌的机会。 张斌等[13]选取196例肝细胞性肝癌组织标本,以正常肝脏组织标本20例作为对照,应用免疫组化方法(SABC法)检测JAK1蛋白和STAT3蛋白的表达,发现肝细胞性肝癌组织中JAK1蛋白和STAT3蛋白的表达明显高于正常肝脏组织,并表明JAK1蛋白和STAT3蛋白均为影响肝细胞性肝癌预后的独立危险因素。苟泽鹏等[14]发现肝癌组织中STAT3主要在细胞质中表达,而p-STAT3主要表达在细胞核内;STAT3和p-STAT3在肝癌组织中阳性表达率明显高于癌旁组织,其表达与卫星灶、血管浸润及AJCC分期有关,可能参与了肝癌的浸润转移。Liu Y等[15]通过激活肝癌中白细胞介素-6(IL-6),而使STAT3信号活化,促进肝癌细胞的生长。而通过使用STAT3小分子抑制剂LLL12可以阻断IL-6诱导STAT3的磷酸化,IL-6抗凋亡作用减弱,抑制肝癌细胞的生长。张丽杰等[16]通过实验首次证明,人肝癌细胞株SMMC-7721存在STAT3蛋白的高表达及p-STAT3的高表达,提示STAT3的异常表达和活化可能与人肝癌的发生有关。提示抑制肿瘤细胞持续活化的STAT3信号通路将为肿瘤治疗及肿瘤药物筛选提供新的思路。 姜黄素,分子式为C21H20O6,分子量为368.37。其已成为肿瘤预防和治疗的一个研究热点[1-2],在肝癌领域也有很多报道,研究显示姜黄素可明显抑制小鼠腹水型肝癌和人肝癌细胞的增殖,并呈剂量依赖性[17]。厉红元等[18]发现姜黄素可干扰肝癌细胞的细胞周期分布,具有细胞毒、抗增殖、诱导细胞凋亡的作用。并且江敏华等[19]发现姜黄素具有抑制人肝癌SMMC-7721细胞体外侵袭和转移的作用。 然而,目前关于姜黄素抗肝癌治疗作用的机制尚无明确定论,近几年姜黄素对STAT3活性的调控作用越来越受人们重视,杨芳等[20]通过研究发现姜黄素作用于人胰腺癌细胞系SW1990后,细胞增殖水平明显下降,姜黄素呈时间、剂量依赖型方式抑制胰腺癌细胞增殖。姜黄素对STAT3的蛋白表达水平无明显影响,而对p-STAT3蛋白表达水平的抑制作用呈现为剂量依赖型,并抑制SW1990细胞内STAT3靶基因Bcl-2、Bak以及Survivin的mRNA转录水平,而使Bax mRNA的表达上调。提出姜黄素的抗肿瘤作用可能与姜黄素抑制STAT3信号分子的活化,并进一步抑制其下游靶基因的表达有关。王晓飞等[21]也提出姜黄素可以通过抑制STAT3的活化(即p-STAT3),降低基质金属蛋白酶-9(MMP-9)、MMP-2的蛋白表达水平,从而抑制乳腺癌细胞MDA-MB-231的侵袭迁移性。 本研究结果发现,姜黄素可直接抑制人肝癌细胞SMCC-7721的增殖,并降低STAT3、p-STAT3、CD24、CD133、CD44和CD90的蛋白表达水平,可初步推测姜黄素是通过调控STAT3磷酸化来干预肝癌干细胞标志物的表达,从而起到抑制肝癌细胞的作用,为姜黄素临床应用于治疗肝癌提供了理论及实验基础,但其深入的作用机制还有待于进一步研究。 [1] Huang AC,Chang CL,Yu CS,et al.Induction of apoptosis by curcumin in murine myelomonocytic leukemia WEHI-3 cells is mediated via endoplasmic reticulum stress and mitochondria-dependent pathways[J].2013,28(5):255-266. [2] Anand P,Sundaram C,Jhurani S,et al.Curcumin and cancer: an "old-age" disease with an "age-old" solution[J].Cancer Lett,2008,267(1):133-164. [3] 周涛.GRIM-19和STAT3在乳腺癌组织中的表达及相关性[D].济南:山东大学,2013. [4] 柯少迎.ALCAM、CD24在肝癌中的表达及其意义[D].福州:福建医科大学,2009. [5] 别国梁.CD44不同剪接体在喉鳞癌中的表达与临床意义[D].福州:福建医科大学,2010. [6] 姚杰,张涛,曹文淼,等.CD133功能对人脑胶质瘤及恶性黑色素瘤细胞体外生长的影响[J].华中科技大学学报:医学版,2009,(5):641-644. [7] 王小岩.CD90在人脑胶质瘤中的表达及临床意义[D].石家庄:河北医科大学,2014. [8] Achcar Rde O, Cagle PT, Jagirdar J. Expression of activated and latent signal transducer and activator of transcription 3 in 303 non-small cell lung carcinomas and 44 malignant mesotheliomas: possible role for chemotherapeutic intervention[J].Arch Pathol Lab Med,2007,131(9):1350-1360. [9] 张文,王雅杰,薛春燕.乳腺癌组织磷酸化STAT3表达及其与淋巴结转移关系的研究[J].中华肿瘤防治杂志,2008,15(6):440-443. [10] Messina JL, Yu H, Riker AI, et al. Activated stat-3 in melanoma[J].Cancer Control,2008,15(3):196-201. [11] Qu P, Roberts J, Li Y, et al. Stat3 downstream genes serve as biomarkers in human lung carcinomas and chronic obstructive pulmonary disease[J].Lung Cancer,2009,63(3):341-347. [12] Lee TK,Castilho A,Cheung VC, et al. CD24(+) liver tumor-initiating cells drive self-renewal and tumor initiation through STAT3-mediated NANOG regulation[J].Cell Stem Cell,2011,9(1):50-63. [13] 张斌,钟德玝,王群伟,等.JAK/STAT信号通路与肝细胞性肝癌的肿瘤进展和预后的相关性研究[J].细胞与分子免疫学杂志,2010,26(4):368-373. [14] 苟泽鹏,王德盛,周亮,等.STAT3蛋白在肝癌组织中的表达及临床意义[J].临床肝胆病杂志,2013,29(7):520-524. [15] Liu Y, Li PK, Li C. Inhibition of STAT3 signaling blocks the anti-apoptotic activity of IL-6 in human liver cancer cells[J]. J Biol Chem,2010,285(35):27429-27439. [16] 张丽杰,单保恩,鹿刚,等.STAT3在人肝癌细胞株SMMC27721细胞内的表达[J].临床检验杂志,2007,25(5):371-372. [17] Garcia-Alloza M, Borrelli LA, Rozkalne A,et al. Curcumin labels amyloid pathology in vivo, disrupts existing plaques, and partially restores distorted neurites in an Alzheimer mouse model[J].J Neurochem,2007,102(4):1095-1104. [18] 厉红元,车艺,汤为学,等.姜黄素对人肝癌细胞增殖和凋亡的影响[J].中华肝脏病杂志,2002,10(6):449-451. [19] 江敏华,谢莹,胡凤霞,等.姜黄素对人肝癌细胞SMMC7721侵袭转移的影响[J].江苏医药,2010,26(23):2780-2782. [20] 杨芳,赵秋,王渝,等.姜黄素抑制STAT3信号通路对胰腺癌细胞增殖的影响[J].世界华人消化杂志,2011,19(30):3149-3153. [21] 王晓飞,郭变琴,张曦文,等.联氨基姜黄素抑制STAT3信号通路对乳腺癌MDA-MB-231细胞侵袭迁移性的影响[J].第三军医大学学报,2011,33(2):111-115. (本文编辑:董军杰) Effects of curcumin on human hepatocellular carcinoma SMCC-7721 cells proliferation and stem cell markers expression and its mechanism WANGBin*,PANZhanyu,YANZhuchen,etal. DepartmentofIntegratedTraditionalandWesternMedicine,TianjinMedicalUniversityCancerInstituteandHospital,Tianjin300060 Objective To observe the effects of curcumin on the human hepatocellular carcinoma SMCC-7721 cells proliferation and stem cell markers expression and to investigate its related mechanism. Methods The experiment includes blank group, curcumin group, JAK2 kinase inhibitor AG490 group and curcumin+AG490 group. The human hepatocellular carcinoma SMCC-7721 cells in each group received corresponding intervention. Colorimetric MTT assay was used to assess the inhibitory effect of curcumin, AG490, and their combination on the proliferation of human hepatocellular carcinoma SMCC-7721 cells. The expressions the protein and mRNA of STAT3, p-STAT3, CD24, CD133, CD44 and CD90 were measured by real time RT-PCR and western blot in human hepatocellular carcinoma SMCC-7721 cells. Results Curcumin inhibited the proliferation of SMCC-7721 cells and down-regulated the protein expression of STAT3, p-STAT3, CD24, CD133, CD44 and CD90. Its action was slightly weaker than AG490, but their combination showed a synergistic effect. Conclusion Curcumin inhibits the proliferation of SMCC-7721 cells, which involves curcumin-induced decline in the expression of CD24, CD133, CD44 and CD99 by repressing STAT3 phosphorylation. Curcumin; Liver tumor; Genetic expression; Apoptosis; Chinese medicine therapy 10.3969/j.issn.1002-2619.2016.12.005 ※ 项目来源:天津医科大学肿瘤医院科研项目基金(编号:1320) 王斌(1983—),男,主治医师,硕士。从事中西医结合肿瘤内科基础及临床研究。 R282.71;R735.7;R735.705.31;R979.5 A 1002-2619(2016)12-1778-06 2016-11-07)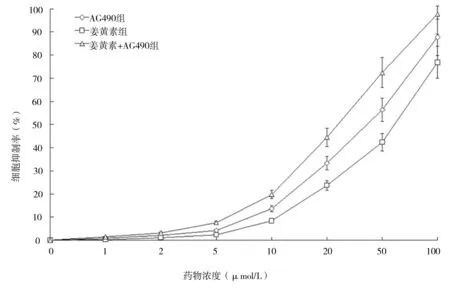
3 讨 论
