不同系统梨品种抗旱性初步评价
2016-03-07赵德英袁继存张少瑜侯桂学
赵德英 ,徐 锴 ,袁继存 ,闫 帅 ,张少瑜 ,侯桂学
(1农业部果树种质资源利用重点实验室,辽宁 兴城 125100;2中国农业科学院果树研究所,辽宁 兴城 125100)
近年来,受厄尔尼诺现象的影响,我国部分地区旱情严重,土壤水分亏缺成为限制干旱、半干旱地区果树生长、生存和产量的主要因子之一[1]。我国是梨树植物的起源中心之一,中国梨的栽培品种涵盖了白梨、砂梨、秋子梨、新疆梨和西洋梨5个种[2]。梨树具有树体高大、直根发达、须根少、根系分布深、单位面积土壤根系密度低的特征,且梨树大多分布在灌溉条件差的山地或缓坡丘陵地,因此对水分胁迫反应更加敏感[3]。干旱地区栽植梨树除了改善灌溉条件之外,筛选抗旱性强的栽培品种也是有效途径之一。渗透调节是果树抵御和忍耐干旱的重要生理机制,对果树干旱适应性或抗旱品种选择有着重要的意义[4]。果树为保证树体代谢机能的正常,对干旱胁迫条件下细胞内自由基产生和伤害具有抵御、适应和调节的能力,通过抗氧化酶系统可有效清除膜脂过氧化产物丙二醛[5]。本试验通过不同系统梨主栽品种水分胁迫条件下膜脂过氧化产物、渗透调节物质和抗氧化酶系统指标的变化,旨在为评价不同系统梨品种的抗旱能力、筛选抗旱梨品种、实现梨优质高效栽培提供参考。
1 材料与方法
1.1 试验材料
试验于2013年4月—2015年10月在中国农业科学院果树研究所温泉试验基地进行。2013年4月在加仑盆(规格为36cm×28cm×32cm)中栽植一年生杜梨幼苗,栽培基质配置比例为园土∶有机肥=4∶1。同年8月从国家梨种质资源圃采集品种接穗于地面以上5cm处进行芽接,2014年4月剪砧,秋季成苗。2015年选择生长整齐一致的盆栽苗为试材,每10株为1次重复,重复3次。所有盆栽植株土肥水管理保持一致。试材包括白梨(Pyrus bretschneideri Rehd.)、砂梨(Pyrus pyrifolia(Burm.f.)Nakai)、 西洋梨 (Pyrus communis L.)、 新疆梨(Pyrus sinkiangensis Yü)和秋子梨(Pyrus ussuriensis Maxim.)5大品系共计20个品种,分别为‘砀山酥梨’(Dang Shan Su Li)、‘鸭梨’(Ya Li)、‘秋白梨’(Qiu Bai Li)、‘锦丰’(Jin Feng)、‘翠冠’(Cui Guan)、‘黄花’(Huang Hua)、‘黄金 ’(Whangkeumbae)、‘丰 水 ’(Housui)、‘ 巴 梨 ’(Bartlett)、‘康弗伦斯’(Conference)、‘早红考蜜斯’(Red Doyenne du Comice)、‘阿巴特’(Abbe Fetel)、‘库尔勒香梨’(Ku Er Le Xiang Li)、‘奎克句句’(Kui Ke Ju Ju)、‘红那禾’(Hong Na He)、‘昆切克’(Kun Qie Ke)、‘南果梨’(Nan Guo Li)、‘京白梨’(Jing Bai Li)、‘花盖’(Hua Gai)、‘尖把梨’(Jian Ba Li)。
1.2 试验设计
2015年6月初,选择生长均匀一致的2年生盆栽梨苗移入避雨棚内进行持续干旱处理,第9天胁迫植株进行复水处理。处理前采用LI-6400便携式光合系统测定不同系统梨品种的净光合速率(Pn)、蒸腾速率(Tr)等光合指标,Pn/Tr为水分效率,叶面饱和蒸汽压亏缺(Vpdl)按照叶温的饱和蒸汽压计算[6]。分别于处理后 1、3、5、7、9、11d 取样,第 11 天取样后复水,复水 2d后取样,每次每个品种选3盆取样。选择新梢顶部第5~第7节位功能叶片,迅速放入冰盒,液氮处理后保存于-70℃冰箱中待测。各系统4个栽培品种测定数值取平均数作为本系统的最后测定值。
1.3 测定方法和数据处理
丙二醛(MDA)含量采用硫代巴比妥酸法测定,活性氧产生速率采用羟胺法测定,脯氨酸含量采用磺基水氨酸法测定,超氧化物歧化酶(SOD)采用氮蓝四唑光化学还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定[6]。
利用Excel2010进行数据处理及作图,SPSS17.0软件分析进行Duncan多重比较和单因素方差分析。
2 结果与分析
2.1 不同系统梨品种水分利用效率差异分析
由表1可以看出,5个系统梨品种净光合速率差异显著。秋子梨系统梨叶片净光合速率最大,其次为白梨、新疆梨,最小为西洋梨系统。不同系统梨的蒸腾速率存在显著差异,砂梨系统最大,新疆梨系统最小。气孔导度秋子梨最大,西洋梨最小。各系统品种梨的水分利用效率差异也很明显,秋子梨系统的水分利用率最高,其次为新疆梨和白梨,最小的为砂梨系统。叶面饱和蒸汽压亏缺各系统差异显著,砂梨最大,秋子梨最小。
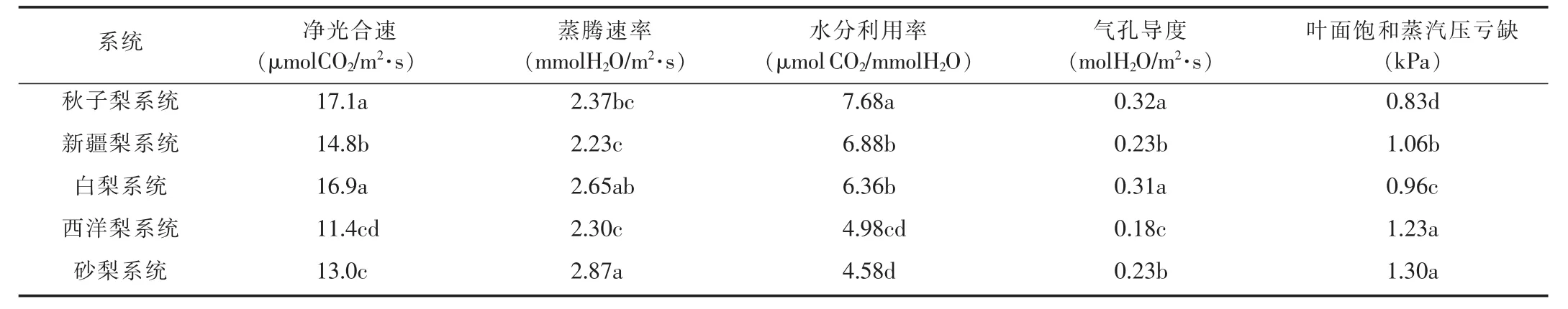
表1 不同系统梨品种光合生理特性差异分析
2.2 水分胁迫处理对不同系统梨品种叶片丙二醛含量的影响
丙二醛作为膜脂过氧化的主要产物之一,是判断膜脂过氧化伤害程度的主要指标。如图1所示,随着水分胁迫时间的延长,不同系统梨品种的MDA含量总体呈上升趋势,白梨系统梨品种在处理后第9天达到最高值,其余梨栽培品种均在处理后第11天达到峰值。处理第11天,秋子梨、新疆梨、白梨、西洋梨和砂梨的MDA含量分别比处理第1天增加82.37%,85.94%,100.43%,137.91%和321.44%。复水后,不同系统梨品种MDA含量均呈下降趋势,秋子梨、新疆梨和白梨的MDA含量比处理第1天降低6.31%,3.57和26.58%,西洋梨和砂梨的MDA含量仍分别比处理第1天增加80.84%和75.93%。
2.3 水分胁迫处理对不同系统梨品种叶片超氧阴离子含量的影响
如图2所示,西洋梨在水分胁迫过程中O2·-(超氧阴离子)产生速率呈持续上升的变化趋势,在处理后第11 d达到最高值,此时O2·-产生速率比处理第1天增加189.1%。砂梨在处理7d前变化不明显,之后急剧上升,第11天达到最高值,比处理第1d增加263.9%。秋子梨和白梨O2·-产生速率较为平稳,处理第11天比处理第1天增加40.2%和80.5%。新疆梨在水分胁迫过程中呈波动性上升趋势,比处理第1天增加53.8%。复水处理后,各品种O2·-产生速率呈降低趋势,秋子梨O2·-产生速率比处理第1天降低5.0%,新疆梨、白梨、西洋梨和砂梨的O2·-产生速率仍分别比处理第1d增加49.5%,9.8%,73.3%和72.5%。
2.4 水分胁迫处理对不同系统梨品种叶片脯氨酸含量的影响
脯氨酸在植物细胞中主要起渗透调节作用,叶片脯氨酸含量增加,可提高细胞溶质含量,增强其渗透调节能力。如图3所示,在水分胁迫处理5d前,不同系统梨品种的脯氨酸含量变化不明显。5d后,西洋梨和白梨的脯氨酸含量大幅增加,在处理11d达到最高值,分别比处理第1天增加226.8%和144.8%。新疆梨在处理7 d后脯氨酸含量增长迅速,比处理第1天增加232.6%。砂梨脯氨酸含量前期变化不大,在处理11d突然升高,达到最高值,比处理第1天增加157.2%。秋子梨脯氨酸含量呈波动式变化趋势,处理11d达到峰值,比处理第1天增加95.9%。复水处理后,梨品种的脯氨酸含量有所降低,但仍高于处理初期,秋子梨、新疆梨、白梨、西洋梨和砂梨的脯氨酸含量分别比处理第1天增加94.8%,51.3%,108.6%,76.5%和 101.9%。
2.5 水分胁迫处理对不同系统梨品种叶片超氧化物歧化酶(SOD)活性的影响
如图4所示,水分胁迫条件下,秋子梨、西洋梨和砂梨在处理第7天SOD活性达到峰值,分别比处理后第1天增加316.6%,85.8%和70.1%。白梨系统梨品种在处理后第5天 达到最高值,比处理后第1天增加197.9%,之后SOD活性迅速降低并维持在一定水平。水分胁迫过程中新疆梨SOD活性在处理第3天略有升高,之后变化较为平稳。复水处理后,新疆梨SOD活性有所增加,其他系统梨SOD活性变化不大。
2.6 水分胁迫处理对不同系统梨品种叶片过氧化物酶(POD)活性的影响
从图5可以看出,水分胁迫过程中白梨和砂梨系统梨品种POD活性在处理后第5天达到峰值,分别比处理后第1天增加284.38%和47.72%,之后呈持续降低趋势。秋子梨、新疆梨和西洋梨系统梨品种POD活性在处理后7d达到峰值,分别比处理后第1天增加131.49%,79.99%和79.07%,之后一直降低。复水处理后,秋子梨、新疆梨和白梨的POD活性有所回升,西洋梨和砂梨POD活性则变化不大。
3 结论与讨论
水分利用效率是反映品种抗旱性强弱的重要性状[7]。研究表明,高光合速率、高水分利用率和低蒸腾速率品种具有较强的抗旱能力,抗旱性强的品种在低水势下具有较强的渗透调节能力,能够维持一定的膨压,进而维持相对高的气孔导度和净光合速率[8]。本试验条件下,秋子梨系统梨品种具有较高的净光合速率、气孔导度和水分利用效率,较低的蒸腾速率和叶面饱和蒸汽压亏缺,抗旱性强于其他品种。砂梨则抗旱性最弱。
干旱导致细胞膜脂过氧化增强,使膜脂中不饱和脂肪酸含量下降,饱和脂肪酸增加,膜透性增强;同时,过氧化产物丙二醛使膜中的酶蛋白发生交联失活,质膜透性加大,促进了膜磷脂的脱脂化反应,结果导致细胞膜解体,膜结构和功能遭到破坏,离子外流,代谢紊乱,最终导致细胞死亡[9~11]。因此,MDA可作为衡量植物抗旱性强弱的重要指标之一[12]。本试验研究结果表明,水分胁迫前期各品种的MDA含量和O2·-产生速率略有升高,但差异不明显,而随着水分胁迫时间的延长,抗旱性较弱的西洋梨和砂梨MDA和O2·-含量迅速增加,细胞液的外渗率增加,表明膜系统受到严重的伤害,可能是由于重度的水分胁迫引起了气孔关闭,光合作用减弱,光合电子大量堆积,诱发产生大量高度反应性氧自由基,减弱了抗氧化防御系统,严重破坏了细胞内自由基的产生和清除平衡,自由基首先攻击质膜系统,使其透性增大,从而使细胞受到伤害,电导率增大,叶片相对含水量下降,进而对植株产生危害。
脯氨酸是果树体内重要的有机渗透调节物质之一,当植株遭受水分胁迫时,树体内会累积大量脯氨酸,脯氨酸的累积量随着水分胁迫的增强而增加。脯氨酸的积累可降低蛋白质水解导致的游离氨的毒害,为水分胁迫解除后提供碳源和呼吸基质[13]。在相同的水分胁迫程度下,不同品种脯氨酸含量不同,脯氨酸含量变化程度与品种的抗旱性密切相关。本研究研究表明,西洋梨和白梨在干旱胁迫前期脯氨酸变化幅度一直很小,但在干旱胁迫的第7天其含量骤增,表明大量积累脯氨酸需要持续干旱的胁迫信号刺激。砂梨和秋子梨在整个水分胁迫期间脯氨酸累含量变化幅度不大,表明砂梨和秋子梨渗透调节对水分胁迫反应不敏感。
SOD是机体防御超氧阴离子的第一道防线,在清除因水分胁迫而导致活性氧伤害细胞膜方面比POD起着更为重要的作用,抗旱品种SOD的增加量大于不抗旱品种。水分胁迫大幅度提高了保护酶系统SOD、POD活性,能有效地清除活性氧,从而使细胞免于伤害或减轻伤害。SOD和POD活性与品种抗旱性呈极显著正相关[14]。果树受伤害的程度与渗透物质及内源保护酶在对水分胁迫的反映上存在某种联系[3]。本研究结果表明,水分胁迫前期,不同系统梨品种SOD和POD活性呈持续上升趋势,随着胁迫时间的延长,活性降低。表明不同系统梨品种受到水分胁迫时,O2·-的增加诱导了SOD活性的增加,SOD活性的升高使H2O2必然增多,进而使清除H2O2的POD活性开始增高,这是植物的自我保护机制。胁迫后期酶活性的降低表明梨品种体内保护酶维持膜系统稳定性的能力是有限的,随着水分胁迫的加剧,这种能力会逐渐丧失,可能是由于植物体内膜受到严重伤害而影响了酶活。
[1]Monclus R,Dreyer E,Villar M et al.Impact of drought on productivity and water use efficiency in 29 genotypes of Populus deltoids × Populus nigra[J].New Phytologist,2006,169:765-777.
[2]路娟,吴俊,张绍铃,等.不同系统梨种质遗传多样性与分类关系的 SSR 分析[J].南京农业大学学报,2011,34(2):38-46.
[3]孙继亮,李六林,陶书田,等.干旱胁迫和复水对梨幼树生理特性的影响[J].应用与环境生物学报,2012,18(2):218-223.
[4]王有年,杨爱珍,于同泉,等.水分胁迫对爱宕梨渗透调节的影响[J].北京农学院学报,2003,18(1):17-20.
[5]胡国霞,马莲菊,陈强,等.植物抗氧化系统对水分胁迫及复水响应研究进展[J].安徽农业科学,2011,39(3):1 278-1 280,1 282.
[6]李合生主编.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:260-261.
[7]李荣生,许煌灿,尹光天,等.植物水分利用效率的研究进展[J].林业科学研究,2003,16(3):366-371.
[8]张建军,王勇,李尚忠.农业生物节水研究进展[J].作物杂志,2006(6):4-8.
[9]孙彩霞,沈秀瑛,刘志刚.作物抗旱生理生化机制的研究现状和进展[J].杂粮作物,2002,22(5):285-288.
[10]蒋学莉,史锋厚,李新芝,等.豆梨叶片对干旱胁迫生理响应机制研究[J].江苏林业科技,2015(1):23-27.
[11]范雪涛,马丹炜,向莎,等.不同逆境条件下辣子草抗氧化酶系统的变化[J].应用与环境生物学报,2008,14(5):616-619.
[12]张敏,李静媛,张占彪,等.干旱胁迫对‘夕阳红’幼苗生长和生理生化指标的影响[J].灌溉排水学报,2015,34(9):99-104.
[13]邵艳军,山仑.植物抗旱机制研究进展[J].中国生态农业学报,2006,14(4):16-20.
[14]周志林,刘恩良,金平,等.甘薯抗旱初步鉴定及渗透胁迫对抗氧化生理指标的影响[J].植物遗传资源学报,2015,16(5):1128-1134.
