肿节风对小型猪放射性肺损伤后上皮间质转化的抑制作用*
2016-03-06岳海英陈玉华刘文其王仁生
岳海英,胡 凯,蒋 健,陈玉华,刘文其,王仁生**
(1. 广西医科大学第四附属医院 柳州市工人医院肿瘤科 柳州 545005;2. 广西医科大学第一附属医院放疗科 南宁 530000;3. 广西壮族自治区妇幼保健院病理科 南宁 530000)
肿节风对小型猪放射性肺损伤后上皮间质转化的抑制作用*
岳海英1,胡 凯2,蒋 健2,陈玉华3,刘文其2,王仁生2**
(1. 广西医科大学第四附属医院 柳州市工人医院肿瘤科 柳州 545005;2. 广西医科大学第一附属医院放疗科 南宁 530000;3. 广西壮族自治区妇幼保健院病理科 南宁 530000)
目的:本研究主要探讨了肿节风对小型猪经右胸单次照射后上皮间质转化(EMT)的抑制作用及其分子机制。方法:雄性小型猪随机分为对照组、单照组和药照组,单照组和药照组行右胸单次15 Gy照射,对照组不予照射。药照组于照射前一周予肿节风配方颗粒溶液,对照组和单照组予等量生理盐水。照射后不同时间点分别从三组随机取5头小型猪采集右肺组织,行免疫印迹检测肺表面活性蛋白A(SP-A)、α平滑肌肌动蛋白(α-SMA)、vimentin和E-cadherin的蛋白表达;免疫荧光双染观察α-SMA和SP-A的共表达。结果:在照射后不同时间点,单照组中α-SMA和vimentin蛋白表达较对照组明显升高;而SP-A和E-cadherin蛋白表达却呈下降趋势,药照组中,上述4个观察指标的蛋白表达则介于二者之间,且4个不同时间点,三组之间两两比较,差异均具有统计学意义。单照组和药照组在激光共聚焦显微镜下均观察到了肺泡II型上皮细胞出现α-SMA和SP-A共染,对照组则没有此现象。结论:肿节风可能通过抑制肺泡II型上皮细胞发生EMT来减少胶原纤维的产生,进而减慢放射性肺纤维化的进展。
放射治疗 小型猪 肿节风 肺泡II型上皮细胞 上皮间质转化
放射治疗是肺癌、食管癌等胸部恶性肿瘤患者综合治疗的重要组成部分,治疗过程中可使肿瘤附近的肺组织产生不同程度的损伤。因此,放射性肺损伤(Radiation-Induced Lung Injury,RILI)已经成为胸部肿瘤患者放射治疗的常见并发症,不但制约放射剂量提高,还影响患者的生活质量[1]。RILI包括早期的放射性肺炎和晚期的纤维化,而放射性纤维化一旦发生则是不可逆转的。目前,国内外尚无放射性肺损伤理想的治疗方法,现有的治疗方法如抗炎、大剂量激素治疗只能在一定程度上减轻放射性肺损伤的相关症状,因此,寻求新的有效的防治方法已成为肿瘤放射治疗工作者面临的难题之一。本研究拟通过动态检测α-SMA、SP-A、vimentin和E-cadherin的蛋白表达变化,并观察α-SMA和SP-A在肺泡II型上皮细胞的共染情况,探讨肿节风对放射性肺损伤的防护作用及可能机制。
1 材料与方法
1.1 动物分组
60头健康雄性小型猪由广西医科大学动物实验中心提供(动物合格证号SCXK桂2009-0002),2-3月龄,体质量10-15 kg,该中心给予标准能量喂养,室温25±1℃,湿度55±5%,在此条件下饲养1周后无异常者入组实验。将入组的巴马小型猪按随机分组的方法分为对照组、单照组和药照组(n=20)。
1.2 照射方式及标本采集
采用60COγ射线放射治疗仪(GWXJ80型中国核动力研究设计院设备制造厂)作为照射源,单次剂量15 Gy照射右全肺,源皮距80 cm,吸收剂量率3 Gy·min-1,对照组不予放射治疗[2]。药照组于放疗前一周开始按30 mg·kg-1经口腔给予肿节风配方颗粒溶液(sarcandra glabra,广西培力药业有限公司,批号:A00884-01),每日1次;对照组和单照组给予等体积的生理盐水,直至实验结束。分别于照射后4、8、12、24周各组按简单随机抽样的方法取5头小型猪以3% 戊巴比妥钠(30 mg·kg-1)腹腔麻醉后开胸,取右侧肺组织,上叶于4%多聚甲醛中固定;下叶称重后分装,于-80℃冰箱冻存。
1.3 肺组织病理学
石蜡包埋的肺组织以约4 μm的厚度连续切片,行HE染色以观察肺组织的病理改变。按照Szapiel等的方法评价肺组织病理变化的严重程度,具体标准见表1。
1.4 免疫荧光双染检测SP-A和α-SMA共表达
石蜡切片常规脱蜡、水化,枸橼酸液高压修复2 min后,驴血清37℃封闭20min后,加入含有anti-SP-A(1:100)和anti-α-SMA(1:100)的混合物4℃过夜,经PBS洗后加入AlexaFluor 594 驴抗小鼠和AlexaFluor 488驴抗兔二抗于室温避光孵育1 h,经PBS洗后细胞核由4',6-二脒基-2-苯基吲哚(北京碧云天生物技术研究所)室温避光孵育8 min。切片用激光扫描共聚焦显微镜(NikonA1)观察,绿色荧光标记的为SP-A表达阳性的肺泡上皮细胞,红色荧光标记的为α-SMA表达阳性的间质细胞,SP-A和α-SMA共表达的为橙色标记的细胞。
1.5 Western blot法检测蛋白含量
肺组织在液氮中磨碎后,每40-80 mg加入700 μL含PMSF的RIPA裂解液(北京碧云天生物技术研究所)裂解提取各组总蛋白,并用BCA法(北京碧云天生物技术研究所)测定蛋白浓度。蛋白样品(上样量40 μg)经SDS-PAGE电泳后恒流(200 mA,80 min)转膜,然后将PVDF膜移至封闭液中并于摇床上室温封闭1 h,分别加入相应的抗体(GAPDH 1:5000;α-SMA 1:400;SP-A 1:100;E-cadherin 1:500,vimentin 1:1000)于4℃孵育过夜。1×TBST洗膜3次(10 min/次),再分别加入相应的HRP酶标记的二抗(1:2000)室温孵育1 h,然后用ECL+化学发光试剂盒检测,最后将PVDF膜经ImageQuant LAS 500(GE)拍摄后用凝胶图象处理系统进行半定量分析。
1.6 统计方法
采用SPSS 13.0统计软件包进行数据处理,数据经方差齐性检验后,各组间比较采用单因素方差分析,两两比较方差齐者采用LSD-t检验,方差不齐者采用Games-Howell检验,以P≤0.05为差异有统计学意义。统计结果用均数±标准差表示。
2 结果
2.1 肺组织病理形态学改变
肺组织HE染色光镜下所见:对照组肺组织结构清晰,肺泡腔结构正常,无炎症细胞浸润。在单照组,照射后第4周,肺组织以渗出性病变为主,表现为肺间质及肺毛细血管充血,较多炎性细胞浸润。照射后第8、12周,渗出性病变开始减轻,纤维性病变逐渐加重,可见肺泡壁明显增厚,肺泡间隔增宽伴融合,并见纤维组织增生导致局部肺实变;照射后第24周,肺实质内可见较多淡红色呈条索状、旋涡状分布的纤维素样病灶,较多的肺泡腔塌陷消失,甚至可见局部肺组织结构消失。药照组的肺组织病理改变与单照组相似,但程度均有所减轻(见图1、表2)。
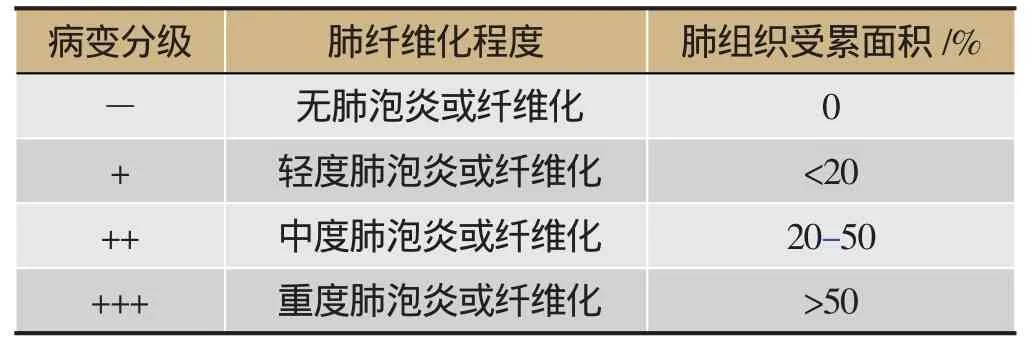
表1 Szapiel等的肺组织病理变化评价方法
2.2 肺组织中α-SMA、SP-A、vimentin和E-cadherin蛋白表达
在同一时间点,α-SMA和vimentin的蛋白表达量为:单照组>药照组>对照组。经方差分析,照射后第4、8、12和24周,α-SMA和vimentin的蛋白表达变化在三组之间,差异均有统计学意义(α-SMA:F4W=6.917,P=0.044;F8W=8.023,P=0.037;F12W=11.264,P=0.026;F24W=30.429,P=0.021;vimentin:F4W=19.172,P=0.023;F8W=35.294,P=0.020;F12W=49.538,P=0.009;F24W=56.326,P=0.002)。进一步分层分析,经LSD-t检验显示:α-SMA和vimentin的蛋白表达在单照组、药照组与对照组之间于不同时间点差异都有统计学意义(P<0.01),在单照组和药照组之间于不同时间点差异也都有统计学意义(P<0.05)。
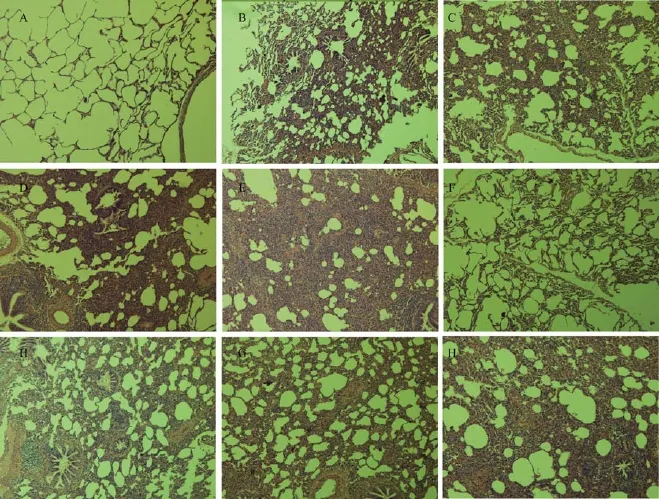
图1 放射治疗对肺组织的影响(SP×100)
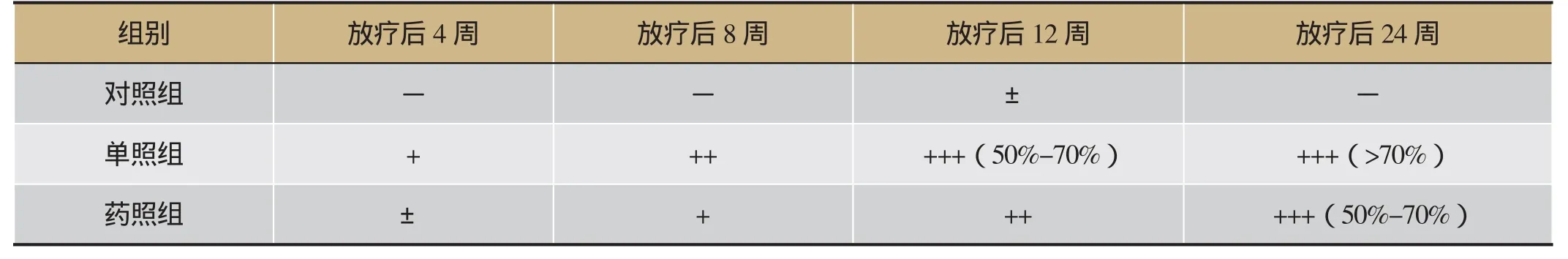
表2 各组小型猪肺组织HE染色肺泡炎或纤维化程度
SP-A和E-cadherin的蛋白表达呈降低趋势,表达量为对照组>药照组>单照组,经方差分析,照射后第4、8、12和24周,SP-A和E-cadherin的蛋白表达变化在三组之间,差异均有统计学意义(SP-A:F4W=18.263,P=0.024;F8W=23.622,P=0.022;F12W=32.602,P=0.019;F24W=64.293,P=0.000。E-cadherin:F4W=24.812,P=0.022;F8W=35.084,P=0.020;F12W=43.774.,P=0.013;F24W=53.137, P=0.008)。进一步分层分析,经LSD-t检验显示:SP-A和E-cadherin的蛋白表达在单照组、药照组与对照组之间于不同时间点差异都有统计学意义(P<0.01),在单照组和药照组之间于不同时间点差异也都有统计学意义(P<0.05)。详见图2。
2.3 α-SMA和SP-A蛋白在肺泡上皮细胞的共表达
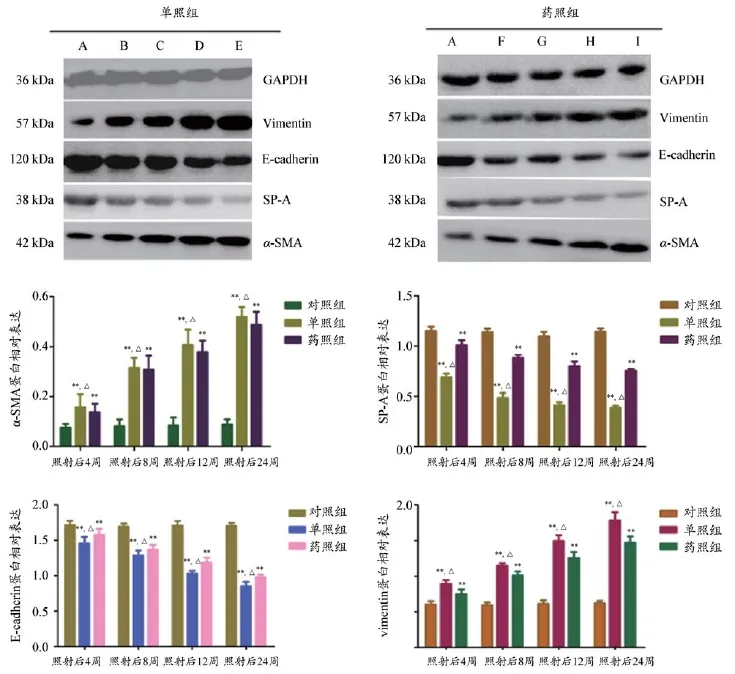
图2 照射后不同时间点SP-A、α-SMA、E-cadherin和vimentin蛋白的表达变化
表3 照射后 SP-A和α-SMA共表达的相对变化(±s,n=5)
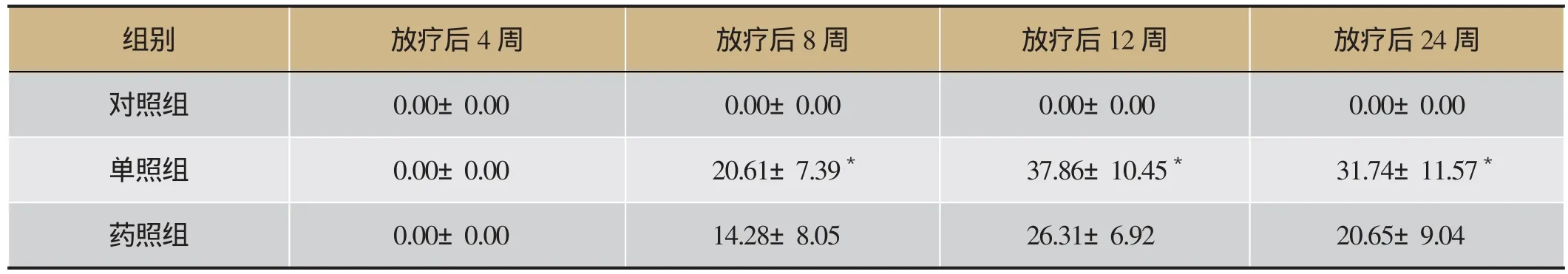
表3 照射后 SP-A和α-SMA共表达的相对变化(±s,n=5)
注:为单照组与药照组相比,t分别为1.94、2.47、2.15,P<0.05。
组别 放疗后4周 放疗后8周 放疗后12周 放疗后24周对照组 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00单照组 0.00±0.00 20.61±7.39* 37.86±10.45* 31.74±11.57*药照组 0.00±0.00 14.28±8.05 26.31±6.92 20.65±9.04
肺组织切片用α-SMA和SP-A蛋白共染,采用两种蛋白荧光组合定位技术,经激光共聚焦扫描显微镜,在放射治疗后8周,肺间质内可观察到一些橙色标记的细胞,即为α-SMA和SP-A共表达的细胞,多分布在纤维化病灶的边缘区域,少量分布于纤维化病灶的内部。而药照组在相应时间点,橙色标记的细胞明显较单照组少,对照组则没有发现共染现象。而且通过比较各组之间橙色荧光的强度,发现在照射后的8、12、24周,单照组中橙色荧光的强度都高于药照组,且差异具有统计学意义(见图3、表3)。
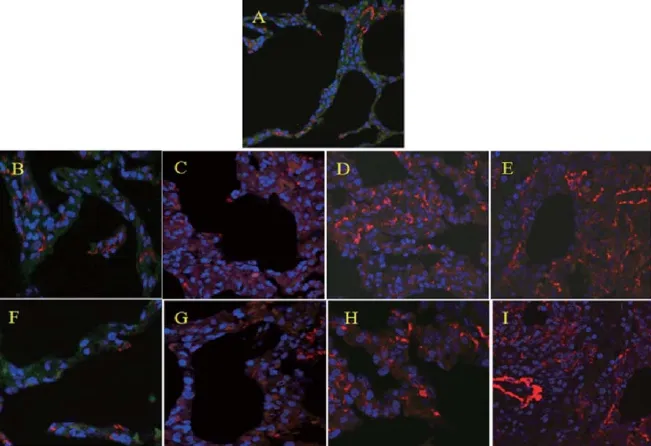
图3 照射后不同时间点肺组织的α-SMA与SP-A共染(油镜×200)
3 讨论
RILI已经成为接受胸部放射治疗患者的常见并发症,不仅影响患者的生活质量,甚至导致治疗的中断[1]。目前关于RILI的研究多采用啮齿类动物作为模型[3,4],而啮齿类动物的肺不仅在解剖结构上与人肺差别较大,且不同小鼠品系的肺组织对放疗的反应也不相同[5]。小型猪的肺组织不仅在结构上与人较为接近,且体积较大,便于控制照射体积,重要的是单次照射的剂量-效应关系也与人相似[2]。因此,本研究选用小型猪作为实验对象以观察肿节风对放射性肺损伤的防护作用及可能机制。
放射性肺炎一般发生在放疗后的1-3个月内,表现为肺间质水肿,毛细血管充血、淤血,肺泡壁增厚及较多的炎症细胞浸润。肺纤维化多发生在照射后6个月到一年,表现为纤维母细胞过度增殖,胶原和基质蛋白沉积[6]。在本研究中,小型猪在给与15 Gy的右胸单次照射后,于第4周可以看到放射性肺炎的变化,在照射后第24周形成放射性肺纤维化。药照组的肺组织改变与单照组相似,但程度明显较轻。这些变化提示已建立了RILI的模型,且放射性肺炎和纤维化在照射后第8周并没有完全分开,而是有部分重叠。
肺泡上皮细胞由形态、功能都不同的I型细胞和II型细胞组成,其中II型细胞被认为是肺泡上皮的干细胞,且肺纤维化的发生发展主要由异常激活的肺泡II型上皮细胞所介导[7]。SP-A为II型细胞分泌的表面活性蛋白,有文献表明,SP-A可通过CD14通路来抑制某些炎症因子的产生和释放,从而避免了级联反应的发生,减轻了肺的损伤[8]。因此SP-A可以看作是一种抗炎介质,当肺受到照射致使炎症介质增多时,即打破了炎症介质/抗炎介质的平衡。Sasaki还发现[9],SP-A可在肺放射性损伤的早期预测中起着重要作用。并且,SP-A的合成或表达异常与肺纤维化密切相关。Prata等[10]在博来霉素诱导小鼠肺纤维化的模型中,提出SP-A的表达可作为评估肺纤维化的预测指标。在本实验中,单照组和药照组中SP-A的蛋白表达随时间呈下降趋势;且单照组中SP-A的蛋白表达下降尤其明显,提示I型细胞因放射性损伤脱落引起II型细胞发生了改变,导致肺表面活性物质分泌减少,说明SP-A蛋白的下调可能促进了炎症因子的表达,从而加速了放射性肺损伤的发生发展。而SP-A在照射后第4周下降最显著,提示SP-A可作为放射性肺损伤的预测指标之一。
EMT是指上皮细胞在形态学上发生间质细胞表型的转变的过程,即上皮细胞的极性和细胞间连接消失,上皮细胞的标志E-钙黏蛋白(E-cadherin)表达下调,获得间质细胞的标志(α-SMA、vimentin的表达上调),细胞的侵袭性和迁移性增加[11]。最近,研究人员在人特发性肺纤维化和其他实验性肺纤维化疾病中观察到了II型肺泡上皮细胞发生EMT的现象[12,13]。同样,大鼠的肺上皮II型细胞进行照射后获得了间质细胞的表型,且由ROS/ERK/GSK3β信号通路进行调节[14],动物实验也发现,照射后小鼠的肺上皮II型细胞也检测到了α-SMA和pro-SP-C共染的现象[15]。在本实验中,小型猪经15 Gy的照射后,肌成纤维细胞的标记物α-SMA和间质细胞标记物vimentin的蛋白表达均呈时间依赖型升高,上皮细胞标记物E-cadherin和SP-A的蛋白表达逐步下降,提示肺泡II型上皮细胞获得了间质细胞的表型,而α-SMA表达升高,则提示照射后有较多的肌成纤维细胞产生,进而可产生较多的胶原纤维。同时,在单照组中,经激光共聚焦扫描显微镜也观察到了α-SMA和SP-A共染,进一步从形态学上说明了小型猪经15 Gy的右胸单次照射后,部分肺泡II型上皮细胞向间质细胞转化。在药照组中,无论是α-SMA、vimentin、E-cadherin和SP-A的蛋白表达,还是α-SMA和SP-A共染的现象,均介于单照组与对照组之间,表明肿节风在一定程度上可以减缓肺泡II型上皮细胞获得间质细胞的表型,从而减少胶原纤维的产生。
中医学认为,放射性肺损伤的症状属于中医“咳嗽”、“喘证”、“肺痿”等范畴;放射线属中医的热毒之邪,具有穿透性,致病与一般的热毒之邪不同,易灼伤机体津液,损伤机体正气和阴血,可以不遵循卫气营血的传变规律,而直击肺脏血络;治疗以清热解毒、养阴清肺、健脾和胃、活血化瘀为主要治则。目前研究表明,除了中药方剂痰热清注射液、生脉饮/参麦注射液[16,17]等在放疗前或放疗时应用能有效预防或推迟放射性肺炎的发生外,各种体内外实验已证实白黎芦醇对肺部炎性反应及损伤具有保护作用[18,19]。肿节风,又名九节茶、草珊瑚,系金粟兰科草珊瑚属植物,其主要成分包括黄酮苷类、挥发油、氰苷、香豆素、内酯等,具有清热凉血、活血消斑、祛风通络的功能,临床上主要用于抗菌消炎、抑制肿瘤、改善免疫等的治疗。我们的前期工作研究发现,肿节风能通过抑制腮腺细胞过度凋亡、降低细胞凋亡率、促进细胞修复增值及清除自由基等,对腮腺的放射性损伤发挥较好的防护和修复作用,在临床上亦观察到了肿节风水提物具有减轻放射性口干的作用[20-22]。在本研究中,经15 Gy的右胸单次照射后,药照组中E-cadherin和SP-A的蛋白表达高于单照组,vimentin和α-SMA的表达较照射组低,且α-SMA和SP-A共染的现象较单照组减少,这些结果提示肿节风可以通过上调E-cadherin和SP-A的蛋白表达,下调vimentin和α-SMA的蛋白表达,进而在一定程度上抑制肺泡II型上皮细胞发生EMT,从而减缓放射性肺损伤的发生发展,发挥一定的放射防护作用。
1 Cappuccini F,Eldh T,Bruder D,et al. New insights into the molecular pathology of radiation-induced pneumopathy. Radiother Oncol,2011,101(1): 86-92.
2 Hopewell J W,Rezvani M,Moustafa H F. The pig as a model for the study of radiation effects on the lung. Int J Radiat Biol,2000,76(4): 447-452.
3 Li M,Abdollahi A,Gröne H J,et al. Late treatment with imatinib mesylate ameliorates radiation-induced lung fibrosis in a mouse model. Radiat Oncol,2009,4: 66.
4 Molthen R C,Wu Q,Fish B L,et al. Mitigation of radiation inducedpulmonary vascular injury by delayed treatment with captopril. Respirology,2012,17(8): 1261-1268.
5 Williams J P,Brown S L,Georges G E,et al. Animal Models for Medical Countermeasures to Radiation Exposure. Radiat Res,2010,173(4): 557-578.
6 Travis E L. The sequence of histological changes in mouse lungs after single doses of x-rays. Int J Radiat Oncol Biol Phys,1980,6(3): 345-347.
7 King T E Jr,Pardo A,Selman M. Idiopathic pulmonary fibrosis. Lancet,2011,378(9807): 1949-1961.
8 Alcorn J F,Wright J R. Surfactant protein A inhibits alveolar macrophage cytokine production by CD14-independent pathway. Am J Physiol Lung Cell Mol Physiol,2004,286(1): L129-L136.
9 Sasaki R,Soejima T,Matsumoto A,et al. Clinical significance of serum pulmonary surfactant proteins a and d for the early detection of radiation pneumonitis. Int J Radiat Oncol Biol Phys,2001,50(2): 301-307.
10 Prata L O,Oliveira F M,Ribeiro T M,et al. Exercise attenuates pulmonary injury in mice with bleomycin-induced pulmonary fibrosis. Exp Biol Med (Maywood),2012,237(8): 873-883.
11 Kalluri R,Weinberg R A. The basics of epithelial-mesenchymal transition. J Clin Invest,2009,119(6): 1420-1428.
12 Chen T,Nie H,Gao X,et al. Epithelial-mesenchymal transition involved in pulmonary fibrosis induced by multi-walled carbon nanotubes via TGF-beta/Smad signaling pathway. Toxicol Lett,2014,226(2): 150-162.
13 Lomas N J,Watts K L,Akram K M,et al. Idiopathic pulmonary fibrosis: immunohistochemical analysis provides fresh insights into lung tissue remodelling with implications for novel prognostic markers. Int J Clin Exp Pathol,2012,5(1): 58-71.
14 Nagarajan D,Melo T,Deng Z,et al. ERK/GSK3beta/Snail signaling mediates radiation-induced alveolar epithelial-to-mesenchymal transition. Free Radic Biol Med,2012,52(6): 983-992.
15 Almeida C,Nagarajan D,Tian J,et al. The role of alveolar epithelium in radiation-induced lung injury. PLoS One,2013,8: e53628.
16 吴稚冰,马胜林,张爱琴,等.痰热清注射液对大鼠急性放射性肺损伤的防治.中华放射医学与防护杂志,2008,28(4): 364-367.
17 姚春筱.生脉注射液防治放射性肺损伤96例疗效分析.中华放射医学与防护杂志,2004,24(1): 52-53.
18 Carsten R E,Bachand A M,Bailey S M,et al. Resveratrol reduces radiation-induced chromosome aberration frequencies in mouse bone marrow cells. Radiat Res,2008,169(6): 633.
19 Arora R,Gupta D,Chawla R,et al. Radio protection by plant products: present status and future prospects. Phytothel Res,2005,19(1): 1.
20 张婷婷,王仁生,许卓华,等.肿节风颗粒对60Coγ射线照射后小型猪腮腺细胞凋亡的抑制作用.中国实验方剂学杂志,2013,19(5): 170-174.
21 许卓华,王仁生,张婷婷,等.肿节风颗粒对小型猪腮腺放射防护作用的研究.中华肿瘤防治杂志,2013,20(15): 1150-1152.
22 吴芳,王仁生,韦波,等.肿节风配方颗粒防治放射性口干的临床观察.广西医学,2012,34(11): 1459-1462.
Sarcandra Glabra Inhibits the Epithelial-Mesenchymal Transition in Radiation-Induced Lung Injury Minipigs
Yue Haiying1,Hu Kai2,Jiang Jian2,Chen Yuhua3,Liu Wenqi2,Wang Rensheng2
(1. Department of Oncology,The Fourth Affiliated Hospital of Guangxi Medical University / Liuzhou City Worker Hospital,Liuzhou 545000,China; 2. Department of Radiotherapy,The First Affiliated Hospital of Guangxi Medical University,Nanning 530000,China; 3. Department of Pathology,Guangxi Province Maternity and Child Care Hospital,Nanning 530000,China)
This study aimd to investigate the inhibitory effects and molecular mechanism of sarcandra glabra on epithelial-mesenchymal transition (EMT) produced by right thoracic single irradiation of minipigs. Minipigs were randomly divided into the control group,the radiotherapy group and the medicine plus radiotherapy group. Minipigs of the radiotherapy group and the medicine plus radiotherapy group received either right thoracic irradiation (15 Gy) or sham-irradiation; while those of the medicine plus radiotherapy group took the prescription of sarcandra glabra orally one week prior to the radiotherapy. Meanwhile,minipigs of the control and the radiotherapy groups were administered with the same volume of physiological saline as the prescription. Finally,five minipigs were randomly selected from each group,and right lung tissue was prepared. Thus,the protein levels of SP-A,α-SMA,vimentin and E-cadherin were detected by western blot,while the distributions of SP-Aand α-SMA were merged via double immunofluorescence staining. It was found that the protein expressions of α-SMA and vimentin increased,while those of SP-A and E-cadherin decreased in the radiotherapy group compared with the control group within a time-dependent manner postirradiation. The protein levels of α-SMA,vimentin,SP-A and E-cadherin in the medicine plus radiotherapy group were in the midst of the expression ranges of the control and the radiotherapy groups,which showed significant statistic differences according to the parewise comparison method. Moreover,the coexpression of SP-A and α-SMA was observed in type II alveolar epithelial cells in the radiotherapy group and the medicine plus radiotherapy group via a confocal laser scanning microscope,while the coexpression didn’t presented in the control group. In conclusion,a lower level of collagen fibers may be synthesized out of suppressing the EMT of type II alveolar epithelial cells and the slowdown in the process of radioactive pulmonary fibrosis.
Radiotherapy,minipigs,sarcandra glabra,type II alveolar epithelial cells,epithelial-mesenchymal transition
10.11842/wst.2016.05.021
R2-03
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2015-11-16
修回日期:2016-03-01
* 广西壮族自治区科学技术厅科技攻关与新产品试制项目(1140003A-24):中草药对放射性肺损伤的防护研究,负责人:刘文其。
** 通讯作者:王仁生,主任医师,博士,主要研究方向:肿瘤的放射防护。
