脱细胞粘膜基质的热原试验研究
2016-03-06陈丹丹黄清泉施畅赵宝红
陈丹丹黄清泉*施畅赵宝红
脱细胞粘膜基质的热原试验研究
陈丹丹1黄清泉1*施畅2赵宝红3
目的 考察脱细胞粘膜基质的热原试验方法的可行性。方法依据《中华人民共和国药典》2010年版二部附录XIE细菌内毒素检查法和ISO10993.12 Biological evaluationofmedicaldevices-Part 12:Sample preparation and reference materials,使用离心法消除样品浸提液的悬浮颗粒,使用动态浊度法验证离心条件是否会影响浸提液中细菌内毒素的检测。依据《中华人民共和国药典》2010年版三部附录XIID热原检查法检测脱细胞粘膜基质的热原试验是否合格。结果本实验中采用的离心条件不会影响样品浸提液中细菌内毒素的检测,热原试验合格。结论该产品可以采用此离心条件进行热原检测。
脱细胞粘膜基质;热原试验;动态浊度法
脱细胞粘膜基质是用猪的正常小肠组织,经脱细胞去抗原技术制备而成。可用于疝、瘘等软组织缺损修复及增强。
热原实验能够有效检测医疗器械和生物材料中的以细菌内毒素为主的热原物质,降低临床热原反应的发生率。由于产品特性,脱细胞粘膜基质长时间浸泡于浸提液中会有不溶性颗粒物质(胶原蛋白不溶性颗粒),不能直接用于热原试验中家兔的耳缘静脉注射。在中国药典2010年版一部附录IXR不溶性微粒检查法中规定不溶性颗粒不能用于静脉注射[1],在ISO-10993.12中规定浸提液必须进行离心以去除悬浮粒子时,应说明理由[2]。本研究为除去浸提液中的悬浮颗粒,拟采用离心条件:7500转,30分钟(该离心条件和产品生产工艺中的离心条件一致)。为证实此离心条件是否会影响浸提液中的细菌内毒素含量,笔者做了如下研究。这个离心条件如果经过验证不会影响浸提液中的细菌内毒素含量,对于其他可降解的医疗器械产品有可能导致的浸提液中含有悬浮颗粒和混浊,在进行热原试验时也可以考虑此离心的方法。
1 材料与方法
1.1 材料与仪器
1.2 方法
1.2.1 标准曲线制备及可靠性[3-6]
细菌内毒素检查用水将内毒素工作标准品进行逐级稀释,最终细菌内毒素浓度分别为1.0EUomL-1、0.1EUomL-1、0.01 EUomL-1稀释系列;各取0.1mL分别加到预先加有0.1 mL TAL试剂反应管内,混合均匀,立即插入32孔动态试管仪内进行自动检测,其中每一浓度重复3管。
1.2.2 样品溶液的制备
用细菌内毒素检查用水将内毒素工作标准品进行逐级稀释,最终获得细菌内毒素浓度为0.2EUomL-1的溶液,取其中37 mL溶液在37℃培养1小时后离心,另取37 mL溶液在37℃培养1小时后不离心。之后这2份溶液同时进行细菌内毒素定量测试。
1.2.3 样品溶液正式试验[7-10]
分别取2份制备好的溶液,用细菌内毒素检查用水稀释2倍,记为Ai液;同时另取2份制备好的溶液,并在溶液中添加浓度为0.2EUomL-1的细菌内毒素标准溶液,记为Bi液;分别取上述各液0.1 mL,加入0.1 mL TAL试剂的反应管进行检测,其中每一个浓度重复2管,计算回收率。
1.2.4 热原试验
取脱细胞粘膜基质(批号:120201,陕西瑞盛生物科技有限公司,规格:SIS-T5)表面积118cm2,置于一个无热原的玻璃广口瓶中,加入94mL氯化钠注射液,在(37±1)℃下浸提72小时后,浸提液在7500转离心30分钟后用于家兔耳缘静脉注射,操作方法按照中国药典2010年版三部附录XIID热原检查法进行[11]。
2 结果
标准曲线制备及可靠性的结果见附表1。回归方程:lgT= 2.7494- 0.3006lgC,其中,相关系数 r=-0.9982;最低浓度1=0.01 EUomL-1,空白对照管在检测时间外,故标准曲线成立。
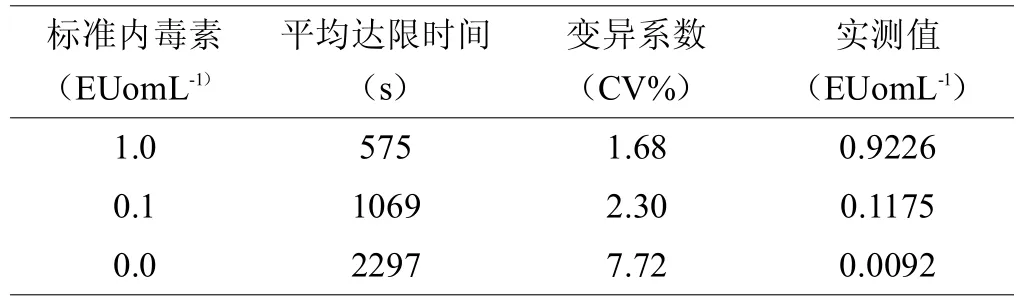
表1 标准曲线的可靠性(n=3)
样品溶液正式试验中的细菌内毒素定量检测结果见附表2。标准曲线:lgT=2.8731-0.2635lgC,其中,相关系数r= -0.9966,2份供试溶液的2倍稀释液回收率均在50%~200%范围内,表明供试液在本实验条件下对TAL试剂无干扰影响。在37℃培养1小时后,离心前和离心后溶液中的细菌内毒素浓度分别是0.170EUomL-1,0.196EUomL-1,都接近添加的0.2EUomL-1的细菌内毒素标准品的浓度。所以该离心条件:7500转,30分钟,不会影响溶液中的细菌内毒素浓度。
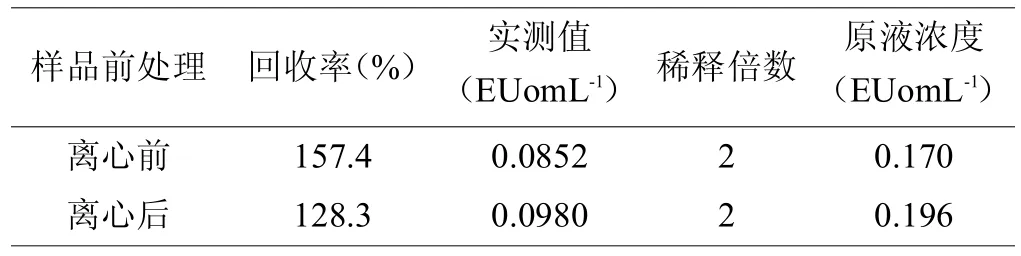
表2 供试品溶液正式试验(n=2)
热原试验的结果是三只家兔的升温幅度分别为:0.2℃,0.0℃,0.0℃,升温总和为0.2℃。符合药典中规定要求:初试3只家兔体温升高均低于0.6℃,且升温总和低于1.3℃。所以热原检测合格。在验证离心条件的试验中,细菌内毒素标准溶液的浓度为0.2 EUomL-1,离心后溶液中的细菌内毒素浓度0.196EUomL-1,差别只有0.004 EUomL-1。
3 讨论
3.1 由于脱细胞粘膜基质的浸提液中含有悬浮颗粒和混浊,不能直接进行家兔耳缘静脉注射。浸提液必须在注射前进行离心处理,采用的离心条件和样品制备工艺一致。通过动态浊度法定量检测的方法,发现离心不会影响溶液中的细菌内毒素含量。所以在对脱细胞粘膜基质进行热原检测时,可以采用此离心条件。同时本研究说明:对于其他可降解的医疗器械产品有可能导致的浸提液中含有悬浮颗粒和混浊,在进行热原试验时也可以考虑采用离心的方法。
3.2 由于本研究中使用的细菌内毒素工作标准品在外环境中的稳定性要低于实际外环境中存在的细菌内毒素的稳定性,所以本研究考察了在37℃培养1小时的情况,以得到准确数据。
3.3 脱细胞粘膜基质的热原试验结果合格。
[1]中华人民共和国药典[M].一部.附录,IXR:不溶性微粒检查法,2010:58-60.
[2]ISO10993.12 Biological evaluation of medical devices-Part 12:Sample preparation and reference materials
[3]中华人民共和国药典[M].二部.附录,XIE:细菌内毒素检查法,2010:99-102.
[4]万丽卿,唐黎明.血浆中细菌内毒素定量测定方法的研究[J].药物分析杂志,2012,32(9):1677-1682.
[5]祝清芬,魏霞.动态浊度法测定多西他赛注射液中细菌内毒素的含量[J].中国药房,2011,22(1):54-55.
[6]姚明達,黄仙梅,王梅娟.动态浊度法定量检测舒肝宁注射液中细菌内毒素[J].中国药学杂志,2011,46(3):239-240.
[7] 王莉蓓,陈华龙,姜丽君.动态浊度法定量检测血栓通注射液中细菌内毒素[J].齐鲁药事,2011,30(1):27-28.
[8]黄云战,刘金明,汤瑜.纤维蛋白原细菌内毒素检测中干扰因素的分析与排除[J].齐鲁药事,2010,29(4):215-217.
[9]赵海欣,王梅娟.动态浊度法定量检测茵栀黄注射液中细菌内毒素[J].现代中西医结合杂志,2010,19(10):53-54.
[10]劳海燕,林秋晓,冯聚锦.注射用头孢菌素类抗生素细菌内毒素动态比浊定量法的研究[J].中国药科大学学报,2005,36(3):234-237
[11]中华人民共和国药典[M].三部.附录,XIID:热原检查法,2010:94-95.
Pyrogen test of decellularized mucosa matrix
Chen Dandan1,Huang Qingquan1,Shi Chang2,et al.
1 National Institute for the Control of food and Pharmaceutical Products,Beijing,100050;2 Beijing Institute of Pharmacology and Toxicology,National Beijing Center for New Drug SafetyEvaluationandResearch,Beijing,100850;3Planting Center,Hospitalof Stomatology,China Medical University, Shenyang Liaoning,110002,China
Objective The research investigates the feasibility of pyrogen test for decellularized mucosa matrix.Methods The sample extract liquid was prepared according to the ISO 10993 Biological evaluation of medical devices-Part 12:Sample preparation and reference materials.And the suspended particles were removed by centrifugation.To inspect whethercentrifugation will influence the bacterium endotoxinconcentration of the extract liquid,kineticturbiditymethodwasperformedaccording to the Chinese pharmacopoeia 2010editionappendix XIE.Thenpyrogentestofdecellularized mucosamatrixwasperformedaccordingto the Chinese pharmacopoeia 2010editionappendix XIID.Result Theprocedure of centrifugationusedin the study didn't influence the bacterium endotoxinconcentration of the sampleextract liquid.The pyrogen test result met the standard.Conclution Pyrogen test of decellularized mucosa matrix is feasible under the centrifugation condition.
Decellularized mucosa metrix;Pyrogen test;Kinetic turbidity method
R927.12;R289-03
A
10.3969/j.issn.1672-5972.2016.04.003
swgk2015-09-00188
陈丹丹(1972-)女,硕士,副教授。研究方向:医疗器械生物安全性评价。
2015-09-23)
1中国食品药品检定研究院,北京100050;2军事医学科学院毒物药物研究所,国家北京药物安全评价研究中心,北京100850;3中国医科大学附属口腔医院种植中心,辽宁沈阳110002
