超低温冷冻对俄罗斯鲟精子顶体酶活性及DNA损伤的影响
2016-03-06黄晓荣冯广朋刘鉴毅章龙珍
黄晓荣,张 涛,冯广朋,赵 峰,刘鉴毅,王 妤,章龙珍,庄 平
(中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090)
超低温冷冻对俄罗斯鲟精子顶体酶活性及DNA损伤的影响
黄晓荣,张 涛,冯广朋,赵 峰,刘鉴毅,王 妤,章龙珍,庄 平
(中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090)
选取6 ind健康的雄性俄罗斯鲟(Acipenser gueldenstaedti),经人工催产后获得成熟的精子,研究超低温冷冻(-196℃)对俄罗斯鲟精子顶体酶活性及DNA损伤影响。结果显示:俄罗斯鲟鲜精中顶体酶的平均活性为(36.18±2.54)μIU·10-6,经过超低温冷冻后,精子顶体酶活性显著降低,添加抗冻保护液精子中顶体酶活性降至(21.55±0.79)μIU·10-6,未添加抗冻保护液精子中顶体酶活性降至(9.58±1.08)μIU· 10-6,且三者间有显著性差异(P<0.05)。单细胞凝胶电泳结果表明,俄罗斯鲟鲜精彗星率为(37.33± 7.77)%,添加抗冻剂后冻精的彗星率为(63.67±5.13)%,未添加抗冻剂直接冷冻彗星率高达(86.00± 3.61)%,三者间有显著差异(P<0.05)。用CASP分析软件分析测量彗星拖尾长度(L tail)、彗星尾部DNA的相对含量(Tail DNA)、尾动量(TM)、Olive尾动量(OTM)等各项表征DNA损伤的指标,发现冻精组的各项指标均显著高于鲜精组,未添加抗冻剂直接冷冻组又高于添加抗冻剂组,3组间有显著性差异(P<0.05)。本研究结果表明:超低温冷冻能导致精子顶体酶活性下降和DNA损伤,抗冻剂对精子具有保护作用。
超低温冷冻;俄罗斯鲟;精子;顶体酶活性;DNA损伤
俄罗斯鲟(Acipenser gueldenstaedti)属鲟形目(Acipenseriformes),鲟科(Acipenseridae),鲟属,不但肉味鲜美、营养丰富,还具有药用、美容、滋补功效,自古以来就被视为水中珍品[1]。由于过度捕捞、水电工程建设和环境污染等原因,鲟鱼资源量大幅度下降并处于濒危状态,已经被国际自然和资源保护联盟(IUCN)(1996)列为易危种,1997年世界濒危动物贸易公约组织(CITES)将其列为附录Ⅱ[2]。
精子顶体酶是精子顶体部特有的胰蛋白酶。在顶体反应、精子和卵子透明带的结合及穿透中起重要作用,精子顶体酶活性的高低可直接影响其受精能力[3]。在生殖医学上,很多学者也将其作为评价男性生殖能力的一个重要指标[4-5]。在水生生物顶体酶研究上,目前仅见锯缘青蟹(Scylla serrata)的报道[6]。DNA作为遗传物质,其损伤情况将直接影响鱼类精子的质量及其下一代生长发育,因此,精子DNA损伤情况是检测精子质量的一个重要依据。在鱼类精子DNA损伤的研究上,目前已有虹鳟(Oncorhynchus mykiss)[7]、海鲈(Dicentrarchus labrax)[8]、真鲷(Pagrosomus major)[9]等相关报道,但未见鲟科鱼类精子顶体酶活性及DNA损伤研究的报道。本研究利用低温生物学的原理开展精子超低温冷冻保存及损伤机理研究,以期对俄罗斯鲟种质资源的保护以及养殖俄罗斯鲟种质的改良起到参考作用。
1 材料与方法
1.1 材料来源
实验用亲鱼取自杭州千岛湖鲟龙科技开发有限公司千岛湖养殖基地,雄鱼为7龄,在网箱中进行养殖。在俄罗斯鲟繁殖季节,选取体长93.6~108.7 cm、体质量4.27~6.18 kg的雄鱼6 ind用于实验。
1.2 精子采集
经人工催产后取精。待亲鱼麻醉后,用直径5 mm左右的聚丙烯塑料软管直接插入生殖孔,轻轻挤压腹部,让精液流入塑料袋中,要求精液无血、无水、无粪便等污染,经镜检选取精子活力90%以上者用于实验。
1.3 样本制备
将采集精液分为3个处理组,分别为:(1)鲜精,即对照组;(2)以10%的甲醇作为抗冻剂,以含23.4 mM蔗糖+0.25 mM KCl+30 mM Tris(pH 8.0)的混合溶液作为稀释液[10],将精液与预冷(4℃)的抗冻保护液按1∶1(V/V)混合后,装入250μL塑料离心管,液氮面1 cm处平衡1 min后,迅速放入-196℃的液氮中保存。测定前置于38℃的水浴中解冻;(3)不添加任何抗冻剂和稀释液,直接将精液装入250μL塑料离心管,液氮面1 cm处平衡1 min后,迅速放入-196℃的液氮中保存。测定前置于38℃水浴中解冻。3个处理组样本中分别取一部分用于顶体酶测定,一部分用于DNA损伤研究。
1.4 顶体酶活性测定
测定方法参考KENNEDY等[11],并适当加以调整。首先测定精子密度,按每管(2~10)×106cell精子数计算所需精液量;每组取5 mL离心管2个,一个为测定管,标“T”,另一个为对照管,标“C”;每管加A液0.5 mL,其上铺所需精液量,1 500 r·min-1离心30 min,仔细吸出上层精浆和溶液。对照管加100μL C液,C和T管均加1.0 mL E液,混匀,25℃孵育3 h,每小时震荡1次;添加100μL C液到所有测试管,对照管除外,震荡,1 500 r·min-1离心30 min。调整分光光度计,在410 nm处测量,E液为空白调零,分别测定C管和T管的OD值。
酶活力计算:顶体酶的国际单位,用在23℃降解lμmol BAPNA·min-1来表示,为了获得整数,顶体酶活力用μIU·10-6精子,活力用试验组和对照组之间的平均差异表示[6],各组实验均重复3次,结果取平均值。
1.5 单细胞凝胶电泳(SCGE)实验
SCGE参考徐西长等[8]的方法。鲜精、添加抗冻剂组和未添加抗冻剂组分别制备3个平行样,每个平行样都进行单细胞凝胶电泳检测。将DNA损伤按以下标准进行等级划分:0级(G0)为无损伤,精子核完整;1级(G1)为轻度损伤,可见彗尾,精子核缩小;2级(G2)为中度损伤,可见明显彗尾,精子核缩小;3级(G3)为重度损伤信号强而密,并见明显缩小的精子核;4级(G4)为完全损伤,仅见荧光强而密的彗尾,精子核基本消失。用CASP分析软件分析测量DNA迁移的各种参数[12]:彗星拖尾长度(L tail)、彗星尾部DNA的相对含量(Tail DNA)、尾动量(TM,即L tail× Tail DNA)、Olive尾动量(OTM,即Tail DNA×迁移DNA中心密度)等,检测精子冷冻保存前后的DNA损伤程度。
1.6 数据分析
实验数据采用SPSS 13.0进行统计分析,用单因子方差分析(One-Way ANOVA)检验各处理组间的差异,差异显著性水平为P<0.05。
2 结果与分析
2.1 超低温冷冻对俄罗斯鲟精子顶体酶活性的影响
俄罗斯鲟鲜精中顶体酶的平均活性为(36.18±2.54)μIU·10-6,经超低温冷冻后,精子中顶体酶活性显著下降,其中未添加抗冻保护液精子中顶体酶活性降至(9.58±1.08)μIU· 10-6,添加冷冻保护液精子中顶体酶活性降至(21.55±0.79)μIU·10-6。统计分析表明,冷冻前后各处理组间精子的顶体酶活性有显著性差异(P<0.05)(图1)。
2.2 超低温冷冻对俄罗斯鲟精子DNA损伤的影响
2.2.1 精子DNA彗星分级检测结果
随机选取100 cell精子,统计各损伤级别精子个数,计算各级别精子所占精子总数的百分比,结果见图2,同时统计损伤精子占总精子数的百分比,记为彗星率,结果见图3。
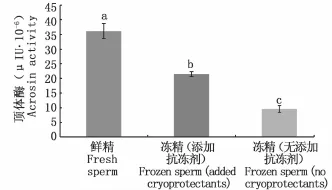
图1 超低温冷冻对精子顶体酶活性的影响Fig.1 Effects of cryopreservation on the acrosin activity of semen
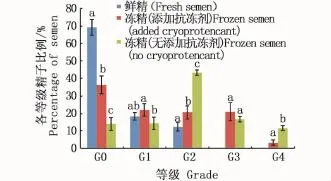
图2 各处理下不同等级精子的分级结果Fig.2 Classification results of each grade of semen under difference treatment

图3 精子彗星率Fig.3 Comet rate of semen
由图2可见,对于G0级,鲜精中无损伤精子所占比例为(69.33±3.51)%,冷冻后添加抗冻剂组精子所占比例为(36.33±5.13)%,两者间有显著性差异(P<0.05)。G1级,鲜精中轻度损伤精子所占比例为(18.33±2.08)%,冷冻后添加抗冻剂组精子所占比例为(22.00±3.61)%,无添加组精子所占比例为(14.33±3.51)%,后两者间存在显著差异(P<0.05)。G2级,鲜精中中度损伤精子所占比例为(12.33±2.52)%,冷冻后添加抗冻剂组精子比例为(20.67± 3.79)%,无添加组精子比例为(43.33± 1.53)%,各组间差异显著(P<0.05)。G3级,冷冻后添加抗冻剂组中精子重度损伤的比例为(21.00±5.20)%,无添加组为(16.67± 1.53)%,两组间差异不显著(P>0.05);但因鲜精中无重损伤的精子,因此冷冻组与鲜精存在显著差异(P<0.05)。对于G4级,鲜精中无完全损伤的精子,冷冻后添加抗冻剂组中完全损伤的精子所占比例为(3.33±1.53)%,无添加组中为(11.67±1.53)%,两组间差异显著(P<0.05)。
由图3可见,俄罗斯鲟鲜精彗星率为(37.33 ±7.77)%,经过超低温冷冻后,添加抗冻剂组冻精的彗星率为(63.67±5.13)%,未添加抗冻剂直接冷冻组彗星率高达(86.00±3.61)%,且3组间有显著性差异(P<0.05)。
2.2.2 精子DNA损伤指标分析
从表征DNA损伤程度的各项指标来看(表1),鲜精组的各项指标均显著低于冻精组,而未添加抗冻剂直接冷冻组又显著高于添加抗冻剂组,3组间存在显著差异(P<0.05)。
鲜精组经电泳后,大部分精子的DNA在电场中几乎不泳动,染色后成圆形的荧光团,无拖尾现象,添加抗冻剂冻精组均出现不同程度的拖尾现象,未添加抗冻剂组精子DNA拖尾现象尤为严重(图4)。
3 讨论
3.1 超低温冷冻对鲟鱼精子顶体酶活性影响
鲟鱼精子是由顶体、头部、中段和一条鞭毛组成。精子顶体酶是精子顶体部特有的胰蛋白酶,为丝氨酸蛋白酶,是受精过程中一种重要的蛋白水解酶,此酶能水解卵细胞的透明带,使得精卵能相互融合。顶体酶还能够促进生殖系统中

表1 精子冷冻前后各组DNA损伤的彗星分析Tab.1 Comet assays of DNA damage of semen after cryopreservation

图4 精子DNA单细胞凝胶电泳图(×400)Fig.3 Electrophoretic images of semen DNAs by SCGE(×400)
激肽的释放,后者能够增强精子的活力和促进精子的运动。一般顶体酶是以未激活的原顶体酶前体形式存在,在顶体反应时通过特定的蛋白水解作用而激活,顶体酶原释放[13]。前顶体酶和顶体酶的活力是由精浆和精子中的顶体酶抑制剂控制的,主要由其中几种丝氨酸蛋白酶抑制剂调控[14]。顶体酶活力能够反映雄性亲体繁殖能力,医学上已将精子顶体酶作为检测男性是否不育的一个重要指标,同时也可作为治疗效果的参照指标,并得到广泛的应用和认可,正开始转向临床应用水平[15]。目前低温对精子顶体酶活性影响报道较少,而低温对鱼类精子顶体酶活性的影响则尚未见报道。刘睿智等[16-17]研究发现,人精子顶体酶活性冷冻后较冷冻前显著降低(P<0.05),且添加不同抗冻剂和使用不同冷冻方法对精子顶体酶活性具有显著性影响(P<0.05)。陈田飞等[18]对家蚕(Bombyx moil)精子的研究发现,超低温冷冻后家蚕精子顶体酶活性较冷冻前显著降低(P<0.05),冷冻90 d与冷冻360 d精子顶体酶活性无显著差异。本研究中,俄罗斯鲟鲜精中顶体酶活性较高,经超低温冷冻后顶体酶活性显著下降(P<0.05),未添加冷冻保护剂组酶活性降至更低,且与添加抗冻剂组存在显著差异(P<0.05),这些都与上述研究结果基本一致。这一研究结果也表明超低温冷冻会导致精子顶体酶活性的降低,抗冻剂能有效保护精子,减少精子顶体酶活性的丧失。
3.2 超低温冷冻对俄罗斯鲟精子DNA损伤的影响
在碱性SCGE中并不完全是只有已存的单双链断裂位点才能形成彗尾,碱性SCGE的彗星率只是显示了核DNA的碱性敏感位点的数目(包括核DNA单、双链断裂位点)[9]。因此SCGE检测核DNA稳定性的结果与精子染色体结构分析(SCSA)和原位缺口末端标记(TUNEL)获得的结果无法相比,但使用SCGE检测人类冷冻精子DNA损伤的实验中获得的结果与SCSA和TUNEL获得的结果明显相关[19]。所以可通过此种方法来检测精子核DNA的稳定性[20]。
本研究中,由于分级标准为人为设计,且在观察中彗尾的明显程度不易掌握,特别是G0与G1差异在镜下不易断定,需要快速观察,否则荧光会萃灭,所以在一定程度上造成了平行样标准偏差较大。虽然采用了人工分级标准统计彗星率的方法,但此种方法没有对核的彗星图像精确度量分析、主观性较强,定量化程度不够[21],但比较简便实用,缩短了实验时间,适合快速大样品检测。进一步的精确分析可采用测量彗尾长度及彗星头部晕圈直径等数据或用专门的彗星图像分析软件来对实验结果进行分析。
通常认为冷冻条件下DNA比较稳定,其完整性不易被破坏。STEELE等[22]对冰冻保存的人精液标本进行了SCGE分析,结果未显示冷冻对精子遗传物质的影响。徐西长等[9]在对真鲷精子的低温冷冻保存研究中发现,用30%DMSO冷冻保存后,精子DNA损伤状况与鲜精差异明显。陈东华等[23]在对中华绒螯蟹(Eriocheir sinensis)精子低温冷冻保存研究中发现,加入冷冻保护剂的精子与鲜精相比其DNA已出现不同程度的损伤,而冷冻后对蟹精子DNA的损伤程度更大,其中10%DMSO保存的精子DNA损伤最为明显。黄晓荣等[24]研究表明,超低温冷冻对中华绒螯蟹胚胎线粒体DNA也有一定程度的影响。ZILLI等[8]发现,海鲈精子经超低温冷冻后,其DNA损伤与鲜精存在显著差异。CABRITA等[25]研究发现,虹鳟和金头鲷(Sparus aurata)精子DNA冷冻后较冷冻前出现明显损伤。本研究中,冷冻后的俄罗斯鲟精子与鲜精相比其DNA出现明显损伤,各项彗星分析指标均存在显著差异,表明超低温冷冻对俄罗斯鲟精子DNA有显著影响。研究同时发现未添加抗冻剂组精子DNA损伤指标显著高于添加抗冻剂组,表明抗冻剂除可以保护精子活力外,还可在一定程度上保护精子DNA免受损伤。因此,在评价俄罗斯鲟精子冷冻保存效果时,不仅要关注其解冻后的活力和寿命,同时更应关注冷冻对精子DNA的损伤。
在实验过程中,针对实验材料对传统的SCGE方法进行了改进:(1)有些学者[26-27]认为载玻片要预热,本实验表明预热的载玻片不利于凝胶与玻片的附着,容易导致胶的脱落,因此本实验未对玻片进行预热;(2)铺胶过程中有些学者采用了铺三层胶的方法:底层为正常融点的琼脂糖凝胶(NMA),顶层为LMA,中间为精子与LMA的混合液[28];或者铺两层胶:底层精子与LMA的混合液,顶层为LMA[29],但通过实验比较,结果并无明显差异,因此本实验采用徐西长等[9]的方法只铺一层胶,不仅节省了铺胶时间,而且减少了脱胶问题,便于显微观察;(3)先将精子细胞预处理后再铺胶电泳,使实验相对容易操作,避免了铺胶后精子细胞预处理而造成的脱胶等问题。(4)电泳时电压、电流及时间的长短会直接影响DNA迁移长度,造成假阳性或假阴性[30]。因此,本实验在电泳过程中一直持续监测,根据实际情况及时吸出或加入电泳液,调节液面高度,保持电压与电流的恒定,减少了假阳性或假阴性结果的出现。
[1] 黄晓荣,张 涛,冯广朋,等.人工养殖条件下俄罗斯鲟精子主要生物学特性[J].海洋渔业,2015,37(4):357-363.
HUANG X R,ZHANG T,FENG G P,et al.Main biological characteristics of sperm in Acipenser gueldenstaedti under artificial cultivation[J].Marine Fisheries,2015,37(4):357-363.
[2] 汪 松.中国濒危动物红皮书(鱼类)[M].北京:科学出版社,1998:6-7.
WANG S.China red data book of endangered animals(fishes)[M].Beijing:Science Press,1998:6-7.
[3] HOWES L,JONES R.Interactions between zona pellucid glycoproteins and sperm proacrosin/acrosin during fertilization[J].Journal of Reproduction Immunology,2002,53(1-2):181
[4] 王忠山,左文静,王成忠,等.精子顶体酶活性检测方法研究[J].白求恩医科大学学报,1995,21(5):465-468.
WANG Z S,ZUOW J,WANG C Z,etal.Study on assaying acrosin activity of human spermatozoa[J].Journal of Norman Bethune University of Medical Science,1995,21(5):465-468.
[5] 王成忠,许宗革,左文静,等.人精子顶体酶活性及影响因素分析[J].白求恩医科大学学报,1996,22(6):583-585.
WANG C Z,XU ZG,ZUOW J,et al.Analysis on influence factor and activity of human sperm acrosin[J].Journal of Norman Bethune University of Medical Science,1996,22(6):583-585.
[6] 管卫兵,王桂忠,李少菁,等.锯缘青蟹纳精囊精子顶体酶活力研究[J].海洋通报,2005,24(6):77-91.
GUANW B,WANG G Z,LI S J,et al.Acrosin activity of spermatozoa in spermathecae of Scylla serrata[J].Marine Science Bulletin,2005,24(6):77-91.
[7] LABBE C,MARTORIATI A,DEVAUX A,et al.Effect of sperm cryopreservation on sperm DNA stability and progeny development in rainbow trout[J].Molecular Reproduction and Development,2001,(60):397-404.
[8] ZILLI L,SCHIAVONE R,ZONNO V,et al.Evalution of DNA damage inDicentrarchus labraxsperm following cryopreservation[J].Cryobiology,2003,(47):227-235.
[9] 徐西长,丁福红,李 军.单细胞凝胶电泳用于检测低温保存的真鲷(Pagrosomusmajor)精子DNA损伤[J].海洋与湖沼,2005,36(3):221-225.
XU X C,DING F H,LI J.Cryopreservation caused sperm DNA damage in red sea breamPagrosomus majorand its detection[J].Oceanologia et Limnologia Sinica,2005,36(3):221-225.
[10] BÉLA U,ÁKOSH,BALÁZSK.Successful hybridization of Acipenser species using cryopreserved sperm[J].Aquaculture International,2004(12):47-56.
[11] KENNEDY W P,KAMINSKI JM,VAN H H,et al.A simple,clinical assay to evaluate the activity of human spermatozoa[J].Journal of Andrology,1989(10):221-231.
[12] KONCA K,LANKOF A,BANASIK A,et al.A cross-platform public domain PC image-analysis program for the comet assay[J].Mutation Research,2003,534(1-2):15-20.
[13] BABA T,KASHIWABARA S,WATANABE K,et al.Activation and maturation mechanisms of boar acrosin zymogen based on the deduced primary structure[J].Journal of Biochemical,1989(264):11920-11927.
[14] FRITZ H,TSCHCSCHE H,FINK E.Proteinase inhibitors from boar seminal plasma[J].Methods in Enzymology,1976(45):834-847.
[15] 洪 文,李建强.顶体蛋白酶在男性不育症中的应用[J].中国男科学杂志,2002,16(2):134-136.
HONGW,LI J Q.The application of acrosin in male infertility[J].Chinese Journal of Andrology,2002,16(2):134-136.
[16] 刘睿智,郭 航,孙 妍.冷冻保存对人精子顶体酶活性影响[J].中国实验诊断学,2004,8(6):647-648.
LIU R Z,GUO H,SUN Y,et al.Effects of freezing on acrosin activities of human spermatozoa[J].Chinese Journal of Laboratory Diagnosis,2004,8(6):647-648.
[17] 刘睿智,董乃屹,许宗革,等.冷冻方法和冷冻保护剂对人精子顶体酶活性影响[J].吉林医学,2005,26(2):144-145.
LIU R Z,DONG N Y,XU Z G,et al.Effects of different cryopreservation methods and medium on acrosin activities of human spermatozoa[J].Jilin Medical Journal,2005,26(2):144-145.
[18] 陈田飞,吴大洋,李春峰.家蚕精子顶体酶活性分析及冷冻精液的人工授精[J].蚕业科学,2006,32(1):47-51.
CHEN T F,WU D Y,LI C F.Acrosin activity analysis of silkworm sperm and artificial insemination with cryopreservation sperm[J].Science of Sericulture,2006,32(1):47-51.
[19] ARAVINDAN G R,BJORDAHL J,JOST L K,et al.Susceptibility of human sperm to in situ DNA denaturation is strongly correlated with DNA strand breaks identified by single-cell electrophoresis[J].Experimental Cell Research,1997,236(1):231-237.
[20] 苏锦祥.鱼类学与海水鱼类养殖[M].北京:中国农业出版社,1979:307-323.
SU JX.Fish and marine fish culture[M].Beijing:China Agriculture Press,1979:307-323.
[21] 田 云,卢向阳,易 克,等.单细胞凝胶电泳技术[J].生命的化学,2004,24(1):77-78.TIAN Y,LU X Y,YIK,et al.Technology of single cell gel electrophoresis assay[J].Chemistry of Life,2004,24(1):77-78.
[22] STEELE E K,MECLURE N,LEWIS S E.Comparison of the effects of the two methods cryopreservation on testicular sperm DNA[J].Fertility and Sterility,2000,74(3):450-453.
[23] 陈东华,李艳东,贾林芝,等.冷冻保护剂及预冷时间对河蟹精子体外冷冻保存的影响[J].水生生物学报,2008,32(4):579-585.
CHEN D H,LI Y D,JIA L Z,et al.Cryopreservation ofEriocheir sinensissperm(in vitro)with different cryoprotective solutions and prefreezing time[J].Acta Hydrobiologica Sinica,2008,32(4):579-585.
[24] 黄晓荣,章龙珍,庄 平,等.超低温冷冻对中华绒螯蟹胚胎线粒体DNA的影响[J].海洋渔业,2014,36(5):437-444.
HUANG X R,ZHANG L Z,ZHUANG P,et al.Effects of cryopreservation on mitochondrial DNA of Chinese mitten crab Eriocheir sinensis embryos[J].Marine Fisheries,2014,36(5):437-444.
[25] CABRITA E,ROBLES V,REBORDINOS L,et al.Evaluation of DNA damage in rainbow trout(Oncorhynchus mykiss)and gilthead sea bream(Sparus aurata)cryopreserved sperm[J].Cryobiology,2005(50):144-153.
[26] RANK J,JENSEN K.Comet assay on gill cells and haemocytes from the blue mussel,Mytilus edulis,Ecotox[J].Environment Safe,2002(54):323-329.
[27] ASMUSSM,MULLENDERS L H,EKER A,et al.Differential effects of toxic metal compounds on the activities of FPG and XPA,two zinc finger proteins involved in DNA repair[J].Carcinogenesis,2000(21):2097-2104.
[28] LABBE C,MARTORIATI A,DEVAUX A,et al.Effect of sperm cryopreservation on sperm DNA stability and progeny development in rainbow trout[J].Molecular Reproduction and Development,2001,(60):397-404.
[29] 宋 博,郑履康,邓丽霞,等.冰冻对精子DNA的影响[J].中华男科学,2002,8(4):253-254.
SONG B,ZHENG L K,DENG L X,et al.Freezing Effect on Sperm DNA[J].National Journal of Andrology,2002,8(4):253-254.
[30] 朱文文,王晓涛.DNA损伤检测-单细胞凝胶电泳技术的研究[J].微量元素与健康研究,2007,24(3):6-7.
ZHUW W,WANG X T.Review on DNA damage assay using single cell gel electrophoresis assay[J].Studies of Trace Elements and Health,2007,24(3):6-7.
Effects of cryopreservation on acrosin activity and DNA damage of Russian sturgeon(Acipenser gueldenstaedti)semen
HUANG Xiao-rong,ZHANG Tao,FENG Guang-peng,ZHAO Feng,LIU Jian-yi,WANG Yu,ZHANG Long-zhen,ZHUANG Ping
(East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key laboratory of East China Sea and Oceanic Fishery Resources Exploitation and Utilization,Shanghai200090,China)
Purpose:The study was conducted about the effects of cryopreservation on acrosin activity and DNA damage ofAcipenser gueldenstaedtisemen,with a view to providing references for the protection of germplasm resources and improvement of germplasm breeding of Russian sturgeon.Materials:The parents ofAcipenser gueldenstaedtiwere collected from Qiandao lake,Zhejiang Province,P.R.China and the males were 7 aged.The average length ranged 93.6~108.7 cm and average weight ranged 4.27~6.18 kg.6 mature males were selected to extract non-polluted spermatozoa through gohopore.The sperm motility was examined by microscope,and samples above 90%of sperm motility were used for this experiment.Methods:The collected semen were randomly divided into 3 groups,and they are as follows(1)Fresh semen,namely control group;(2)original semen was diluted by 1∶1 with 23.4 mM sucrose+0.25 mMKCl+30 mMTris(pH 8.0)and addition 10%glycol as cryoprotectants and then mixtures were placed in 250μL plastic centrifuge tube,and then samples were equilibrated for 20 min at 4℃,then 1 min at-20℃,fimally preserved in liquid nitrogen;(3)semen without diluent and cryoprotectant.The samples were placed into 250μL plastic centrifuge tube,and equilibrated for 20 min at4℃,then 1 min at-20℃,and finally preserved in liquid nitrogen.The samples were thawed in 38℃bath before determination.A portion of the samples from three groups were used to determine the acrosin activity and the rest samples were used to detect the DNA damage.The acrosin activity was determined by spectrophotometric method,and the DNA damage was studied by single cell gel electrophoresis method.Results:The average acrosin activity in fresh semen ofA.gueldenstaedtiwas(36.18±2.54)μIU·10-6After cryopreservation,The acrosin activity declined significantly.The activity of frozen semen which cryoprotectants had been added declined to(21.55±0.79)μIU·10-6,while the activity of frozen semen which cryoprotectants had not been added declined to(9.58±1.08)μIU·10-6.There were significant differences among the three groups(P<0.05).The results of single cell gel electrophoresis(SCGE)showed,the comet rate of fresh semen was(37.33±7.77)%,while the comet rate of frozen semen which cryoprotectants had been added was(63.67±5.13)%,and the comet rate of frozen semen which cryoprotectants had not been added was(86.00±3.61)%.There were significant differences among the three groups(P<0.05).DNA damage indexes including L-tail,Tail DNA,TM and OTM were analyzed with CASP software.The results showed that various indexes in frozen semen were higher than those of fresh semen and the indexes in the group without cryoprotectants were higher than those of the group with cryoprotectants.There were significant differences among the three groups(P<0.05).Conclusions:Cryopreservation could induce the decline of acrosin activity and DNA damage,but cryoprotectant could protect the semen in cryopreservation.
cryopreservation;Acipenser gueldenstaedti;semen;acrosin activity;DNA damage
S 917
A
1004-2490(2016)05-0487-08
2015-11-04
公益性行业(农业)科研专项经费项目(201203065);国家重大科技成果转化项目(ZD-2012-345-2);国家科技基础条件平台项目
黄晓荣(1978-),女,博士,副研究员,从事鱼类生理及低温生物学研究。E-mail:hxr828@126.com
庄 平,研究员。E-mail:pzhuang@ecsf.ac.cn
