CDH1基因甲基化状态与结直肠癌临床病理特征及预后的相关性研究
2016-03-06方日王小文
方日,王小文
(湖南师范大学附属湘南医院中国人民解放军第169医院肿瘤科,湖南 衡阳 421002)
CDH1基因甲基化状态与结直肠癌临床病理特征及预后的相关性研究
方日,王小文
(湖南师范大学附属湘南医院中国人民解放军第169医院肿瘤科,湖南 衡阳 421002)
目的 探讨CDH1基因启动子所在5'-CpG岛的异常甲基化与临床病情发展、病理变化及术后预后的相关性。方法选取2013年1~12月在我院肿瘤科进行结直肠癌切除术的原发性结直肠癌患者184例,其中甲基化组86例,非甲基化组98例,所有入选患者由专人进行跟踪随访。检测CDH1基因启动子所在5'-CpG岛的异常甲基化,通过全基因组扩增技术对修饰后的DNA进行扩增,根据GenBank基因库设计CDH1基因甲基化特异性引物及CDH1基因非甲基化特异性引物。结果甲基化组肿瘤直径为(6.5±2.1)cm,大于非甲基化组的(3.2±2.2)cm,甲基化组肿瘤浸润性所占比例54.7%,高于非甲基化组的42.9%,差异均有显著统计学意义(P<0.01);甲基化组肿瘤分化程度(高分化14.0%,中分化36.0%)低于非甲基化组(高分化40.8%,中分化45.9%%),差异有显著统计学意义(P<0.01);甲基化组淋巴转移率为67.4%、远处转移率为31.4%,高于非甲基化组的21.4%和17.3%,差异均有统计学意义(P<0.05);甲基化组临床TNM分期更晚(甲基化组:Ⅰ期11.6%,Ⅱ期11.6%,Ⅲ期37.2%,Ⅳ期39.5%;非甲基化组:Ⅰ期27.6%,Ⅱ期32.7%,Ⅲ期20.4%,Ⅳ期19.4%),差异均有显著统计学意义(P<0.01);非甲基化组患者生存率(89.5%)高于甲基化组患者(68.7%),差异有统计学意义(P<0.05)。Cox比例风险模型结果显示,腹腔灌洗液悬浮细胞CDH1基因甲基化是原发性结直肠癌患者术后预后生存率的独立危险因素(RR=28.5,P<0.01)。结论原发性结直肠癌患者腹腔灌洗液悬浮细胞CDH1基因甲基化程度提高,恶性程度高,预后差。
结直肠癌;CDH1基因;甲基化;腹腔灌洗液;预后
基因CDH1是一种依赖钙离子的细胞粘附分子,编码上皮性钙黏蛋白(E-cadherin),定位于染色体16q22.1的,对同种细胞细胞间的粘附有重要作用,它功能缺失与肿瘤的发生发展有着极为密切的相关性[1-2]。有研究报道,消化道肿瘤患者肿瘤组织中可检测到CDH1的缺失、上皮性钙黏蛋白的缺失或其表达水平的降低[3]。在其他常见肿瘤如卵巢肿瘤、头颈部肿瘤中也有不同程度的确实或表达水平降低[2,4]。位于5'-CpG岛的CDH1基因启动子,其异常甲基化可影响上皮性钙黏蛋白表达,进一步影响肿瘤的发生发展[5]。本研究选用实时荧光PCR技术,检测甲基化特异性,获取入选结直肠癌患者术中腹腔灌洗液,制备细胞悬浮液,检测CDH1基因启动子所在5'-CpG岛的异常甲基化,同时对其异常甲基化与临床病情发展、病理变化及术后预后的相关性进行探讨。
1 资料与方法
1.1 一般资料 选取2013年1~12月在我院肿瘤科进行结直肠癌切除术的原发性结直肠癌患者184例,所有入选患者由专人进行跟踪随访,随访频率根据患者自身情况决定,随访截止日期2014年12月31日。本研究由我院医学伦理委员会批准通过并进行监督,所有患者及家属对本研究内容及风险均表示知情并理解,并签署知情同意书。纳入标准:结肠镜检诊断为原发性结直肠癌;镜检获取活组织病理切片确认为原发性结直肠癌;手术切除前未进行任何放化疗等辅助治疗;影像学CT及MRI判定为可切除肿瘤。排除标准:心脏超声、血生化、肺通气等检查显示患者身体情况无法接受手术者结直肠癌肿瘤位于腹膜反折下者。
1.2 DNA提取及亚硫酸盐修饰方法 患者麻醉后,在开腹后、手术前温热生理盐水500 mL灌洗腹腔,收集灌洗液,以备检查。腹腔灌洗液细胞悬浮,提取悬浮细胞DNA,测定DNA浓度及纯度,操作严格按照步骤进行。使用亚硫酸盐转化试剂盒对提取的DNA进行亚硫酸盐修饰。亚硫酸亚转化试剂盒操作步骤如下:10 μg提取DNA加入5 μL浓度为3 mol/L的NaOH裂解液。37℃20 min变性。加入浓度为2 mol/L的NaHSO4溶液520 μL,所用NaHSO4溶液浓度为2 mol/L。加入浓度为0.2 mol/L氢醌溶液30 μL。50℃16~18 h水浴。DNA样品、8%异丙醇2 mL加入DNA纯化树脂1 mL进行滤析。加入3 mol/L醋酸钠、无水乙醇进行沉淀。离心,弃上清。自然干燥。加入TE溶液20 μL溶解。使用全基因组扩增技术对修饰后的DNA进行扩增。-20℃保存备用。
1.3 DNA甲基化检测方法 根据GenBank基因库设计CDH1基因甲基化特异性引物及CDH1基因非甲基化特异性引物。其中CDH1基因甲基化特异性引物正义链为5'-TTAGGTTAGAGGGTTATCGCGT-3',反义链为5'-TAATTTAGGTTAGAGGGTTATTGT-3',扩增片段116 bp。CDH1基因非甲基化特异性引物正义链为5'-TAACTAAAAATTCACCTACCGAC-3',反义链为5'-CACMCCAATCAACAACACA-3',扩增片段97 bp。空白对照使用蒸馏水代替。阳性对照使用体外Sssl甲基转移酶处理的人基因组全DNA。阴性对照组使用体外未经处理的人基因组全DNA。检测使用ABI7500 PCR仪进行检测,加入甲基化引物、非甲基化引物、各对照组样本、各检测组样本进行实时荧光PCR检测甲基化特异性。
1.4 甲基化的标准 根据测得CT值绘制标准曲线,计算各组甲基化DNA拷贝数,计算甲基化比率,计算公式为甲基化百分数=[甲基化DNA拷贝数/(甲基化DNA拷贝数+非甲基化DNA拷贝数)]×100%。所得甲基化百分数小于等于20%认为非甲基化,大于20%认为甲基化。将PCR所得产物使用2.0%琼脂糖凝胶电泳分离,紫外凝胶成像观察所得条带,出现甲基化条带认为甲基化,出现非甲基化条带认为非甲基化。综合上述结果,将样本及产物分为 甲基化组和非甲基化组。
1.5 统计学方法 应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料组间比较采用χ2检验。绘制生存曲线计算生存率。利用Cox比例风险模型进行多因素生存分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 临床病理比较 本组184例,其中男性109例,女性75例;年龄33~69岁,平均(48.2±9.6)岁。腹腔灌洗液悬浮细胞甲基化检测结果显示,甲基化组86例,非甲基化组98例。对两组患者临床病理结果检查可知甲基化组肿瘤直径大于非甲基化组(P<0.01),甲基化组肿瘤浸润性所占比例高于非甲基化组(P<0.01),甲基化组肿瘤分化程度低于非甲基化组(P< 0.001),甲基化组淋巴结转移率、远处转移率高于非甲基化组(P<0.05),甲基化组临床TNM分期更晚(P<0.01),见表1、表2和表3。
2.2 预后比较 对所有患者进行专人随访,随访时间为12~24个月。随访结果显示,非甲基化组患者生存率(89.5%)高于甲基化组患者的生存率(68.7%) (P<0.05),见图1。Cox比例风险模型结果显示,患者腹腔灌洗液悬浮细胞CDH1基因甲基化是原发性结直肠癌患者术后预后生存率的独立危险因素,RR=28.5 (P<0.01)。
表1 两组患者的临床病理比较(±s)
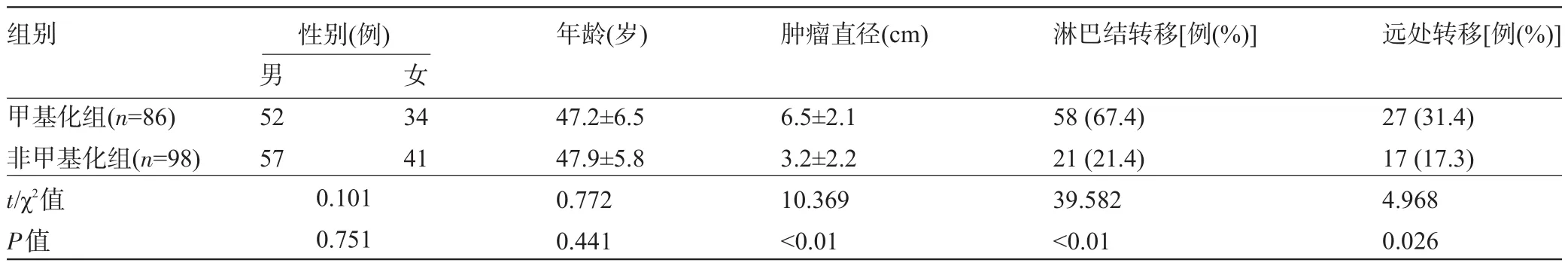
表1 两组患者的临床病理比较(±s)
组别 性别(例)年龄(岁)肿瘤直径(cm)淋巴结转移[例(%)]远处转移[例(%)]女甲基化组(n=86)非甲基化组(n=98) t/χ2值P值男52 57 34 41 0.101 0.751 47.2±6.5 47.9±5.8 0.772 0.441 6.5±2.1 3.2±2.2 10.369<0.01 58(67.4) 21(21.4) 39.582<0.01 27(31.4) 17(17.3) 4.968 0.026

表2 两组患者的肿瘤部位及大体类型比较[例(%)]
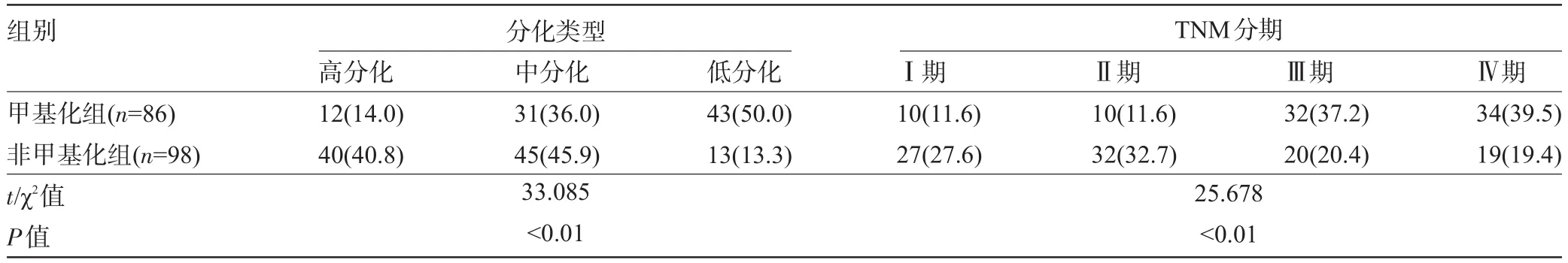
表3 两组患者肿的瘤分化类型及TNM分期对比[例(%)]
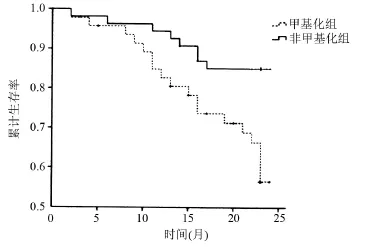
图1 患者生存曲线比较
3 讨 论
消化道肿瘤的发病率、死亡率随着我们社会进步、经济发展、饮食改变逐年增加,成为临床上极为常见的肿瘤之一[6]。作为一个在众多抑癌基因中研究较为透彻的CDH1,它的缺失或结构改变与肿瘤的发生发展有着密切的联系[7]。基因CDH1是一种依赖钙离子的细胞黏附分子,编码上皮性钙黏蛋白,定位于染色体16q22.1的,对同种细胞细胞间的黏附有重要作用,对细胞的分化也有着促进作用[8]。CDH1在细胞分化维持、细胞极性维持、细胞组织结构维持等方面起着重要作用[9]。有研究报道,消化道肿瘤患者肿瘤组织中可检测到CDH1的缺失、上皮性钙黏蛋白的缺失或其表达水平的降低[10]。研究发现,CDH1表达缺失或表达水平降低是导致消化道肿瘤发生发展的重要因素[11]。有文献报道,CDH1基因表达下降的原因可能是其基因突变或上游启动子甲基化[12]。近期有研究报道称,DNA上游启动子甲基化较其基因突变在肿瘤的发生发展中更为常见。在肿瘤发生发展进程中,基因表达降低的重要机理之一就是启动子区CpG岛的甲基化[13]。因此,对DNA甲基化、甲基化与肿瘤发生发展的相关性、甲基化与肿瘤相关基因的研究逐渐受到重视。
Katarzyna等[14]研究结果显示,所纳入研究的35例原发性结直肠癌患者中CDH1基因启动子区域CpG岛甲基化检出率为48%,同时研究发现原发性结直肠癌患者上皮性钙黏蛋白水平的降低与CDH1基因启动子区域甲基化有着显著的相关关系。本研究结果表明,纳入标准的184例原发性结直肠癌患者中,CDH1基因启动子区域CpG岛甲基化检出率为46.7%。
基因的甲基化产生的影响包括肿瘤组织的发生发展、肿瘤细胞脱落、患者术后及其他辅助治疗后预后等多方面[15]。基因甲基化可以导致远处组织如腹腔内肿瘤细胞脱落,作为腹腔种植转移的重要种子细胞。Yakirevich等[16]研究发现,腹腔灌洗液中无基因甲基化患者术后生存率高于、复发率低于发现基因甲基化患者。Benusiglio等[17]研究结果显示,腹腔灌洗液中发现甲基化基因患者术后腹腔转移率明显高于无甲基化患者,此外,部分患者发现出现肿瘤的肝肺转移。本研究结果表明,甲基化组患者淋巴转移率、远处转移率高于非甲基化组患者。随访结果进行生存分析显示,非甲基化组患者生存率高于甲基化组患者。Cox比例风险模型结果显示,患者腹腔灌洗液悬浮细胞CDH1基因甲基化是原发性结直肠癌患者术后预后生存率的独立危险因素。此结果与大多数文献报道结果一致。
综上所述,腹腔灌洗液悬浮细胞甲基化组患者较非甲基化组患者肿瘤直径大,肿瘤浸润性所占比例高,肿瘤分化程度低,淋巴转移率、远处转移率高,临床TNM分期晚。随访结果显示,非甲基化组患者生存率高。Cox比例风险模型结果显示,患者腹腔灌洗液悬浮细胞CDH1基因甲基化是原发性结直肠癌患者术后预后生存率的独立危险因素。
[1]李权,王亚旭,申海鹰,等.腺苷干预人结直肠癌SW480细胞RECK基因甲基化及其机制[J].第三军医大学学报,2015,37(1):46-50.
[2]鲁发龙,杜刚毅,郑少康,等.结直肠癌术中腹腔灌洗液悬浮细胞CDH1甲基化检测及其临床意义[J].中华胃肠外科杂志,2014,17 (11):1133-6.
[3]Bosanquet DC,Harris DA,Beynon EJ.Authors'reply:Systematic review and meta-analysis of intraoperative peritoneal lavage for colorectal cancer staging(Br J Surg 2013;100:853-862)[J].Br J Surg,2013,100(10):1398-1398.
[4]Bosanquet DC,Harris DA,Evans MD,et al.Systematic review and meta-analysis of intraoperative peritoneal lavage for colorectal cancer staging[J].British Journal of Surgery,2013,100(7):853-862.
[5]Passot G,Mohkam K,Cotte E,et al.Intra-operative peritoneal lavage for colorectal cancer[J].World Journal of Gastroenterology,2014,20 (8):1935-1939.
[6]冯宁,高海德,刘文志,等.胃癌中钙粘附分子启动子甲基化与幽门螺杆菌感染及肿瘤生物学特性的关系[J].华西医学,2014,8(1): 43-46.
[7]许春伟,王鲁平,葛畅.MGMT基因甲基化状态在结直肠锯齿状病变中的表达及意义[J].中国医药导报,2014,11(2):11-16.
[8]Sugimoto S,Yamada H,Takahashi M,et al.Early-onset diffuse gastric cancer associated with a de novo large genomic deletion of CDH1 gene[J].Gastric Cancer Official Journal of the International Gastric Cancer Association&the Japanese Gastric Cancer Association,2013,17(4):1-5.
[9]许春伟,葛畅,王鲁平.p16基因甲基化与结直肠锯齿腺瘤的Meta分析[J].诊断病理学杂志,2013,20(12):790-791.
[10]Li YX,Lu Y,Li CY,et al.Role of CDH1 promoter methylation in colorectal carcinogenesis:a meta-analysis[J].Dna&Cell Biology, 2014,33(7):455-462.
[11]Govatati S,Singamsetty GK,Nallabelli N,et al.Contribution of cyclin D1(CCND1)and E-cadherin(CDH1)alterations to colorectal cancer susceptibility:a case-control study[J].Tumour Biology,2014, 35(12):12059-12067.
[12]李晓阳,颜才华,马一杰,等.结直肠癌的DNA甲基化研究进展[J].中国医药导报,2013,10(23):28-30.
[13]王春晓,罗开元.DNA甲基化与结直肠癌的预后及治疗进展[J].中国医药科学,2013,3(1):48-51.
[14]Wójcik-Krowiranda K,Forma E,Zaczek A et al.Expression of E-cad herin and beta1-integrin mRNA in endometrial cancer[J].Ginekolo gia Polska,2013,84(11):910-914.
[15]Carneiro F.Gastric Cancer[J].Pathobiology of human disease,2014, 52(2):1305-1318.
[16]Yakirevich E,Resnick MB.Pathology of gastric cancer and its precursor lesions[J].Gastroenterology Clinics of North America,2013,42 (2):261-284.
[17]Benusiglio PR,David M,Etienne R,et al.CDH1 germline mutations and the hereditary diffuse gastric and lobular breast cancer syndrome:a multicentre study[J].Journal of Medical Genetics,2013,50 (7):486-489.
Correlation between CDH1 gene methylation status and clinical pathological characteristics and prognosis of colorectal cancer.
FANG Ri,WANG Xiao-wen.Department of Oncology,the 169thHospital of People's Liberation Army, Xiangnan Hospital Affiliated to Hunan Normal University,Hengyang 421002,Hunan,CHINA
ObjectiveTo investigate the correlation between the abnormal methylation of 5'-CpG islands harboring cadherin 1(CDH1)gene promoter in and the development of clinical condition,pathological changes and postoperative prognosis.MethodsA total of 184 patients with colorectal cancer resection of primary colorectal cancer in Department of Oncology in our hospital were selected and divided into methylation group(n=86)and non-methylation group(n=98)from January to December 2013.All patients were selected and followed up by specially-assigned person. The abnormal methylation of 5'-CpG islands harboring cadherin 1(CDH1)gene promoter was detected,and modified DNA genome was amplified by whole genome amplification technology.CDH1 gene methylation specific primers and CDH1 gene non-methylation specific primers were designed according to GenBank.ResultsThe diameter of methylation group was significantly larger than that of non-methylation group[(6.5±2.1)cm vs(3.2±2.2)cm],and the proportionof tumor invasion was significantly higher than that of non-methylation group(54.7%vs 42.9%),with statistically significant difference(P<0.01).Tumor differentiation degree in methylation group(high differentiation 14.0%,medium differentiation 36.0%)was significantly lower than that in the non-methylation group(high differentiation 40.8%,medium differentiation 45.9%),with statistically significant difference(P<0.01).The rate of lymph node metastasis and the distant metastasis of methylation group were significantly higher than those of the non-methylation group(67.4%vs 21.4%, 31.4%vs 17.3%,P<0.05).The clinical TNM staging was later in methylation group than non-methylation group(methylation group:11.6%in stageⅠ,11.6%in stageⅡ,37.2%in stageⅢ,39.5%in stageⅣ;non-methylation group:27.6% in stageⅠ,32.7%in stageⅡ,20.4%in stageⅢ,19.4%in stageⅣ),the differences were statistically significant(P<0.01).The survival rate of patients in non-methylation group was significantly higher than those in methylation group (89.5%vs 68.7%,P<0.01).Cox proportional hazard model results showed that CDH1 gene methylation of suspension cells in intraoperative abdominal lavage was an independent risk factor for prognosis in patients with primary colorectal cancer(RR=28.5,P<0.001).ConclusionColorectal cancer patients with higher aberrant methylation of 5'-CpG of CDH1 gene promoter of suspension cells in abdominal lavage have higher malignancy,more metastasis and worse prognosis.
Colorectal cancer;Cadherin 1(CDH1)gene;Methylation;Peritoneal lavage;Prognosis
R735
A
1003—6350(2016)11—1779—04
10.3969/j.issn.1003-6350.2016.11.019
2015-12-16)
方日。E-mail:fr5115@163.com
