青蒿素对大鼠心肌缺血再灌注损伤的影响及其作用机制探讨
2016-03-06马瑞松江洪李元红胡笑容刘自强
马瑞松,江洪,李元红,胡笑容,刘自强
(1.武汉大学人民医院心内科,湖北 武汉 430060;2.恩施土家族苗族自治州中心医院心内科,湖北 恩施 445000)
青蒿素对大鼠心肌缺血再灌注损伤的影响及其作用机制探讨
马瑞松1,江洪1,李元红2,胡笑容1,刘自强1
(1.武汉大学人民医院心内科,湖北 武汉 430060;2.恩施土家族苗族自治州中心医院心内科,湖北 恩施 445000)
目的 探讨青蒿素对大鼠心肌缺血再灌注损伤的影响及其可能作用机制。方法采用大鼠心肌缺血再灌注模型(缺血30 min,再灌注4 h),雄性SD大鼠30只根据随机数字表随机分为三组:假手术组(SO组,n=10)、缺血再灌注组(I/R组,n=10)和青蒿素治疗组(A+I/R组,n=10,Artemisinin:25 mg/kg,Tid,造模前1 d灌胃)。检测心肌损伤标记物肌酸激酶(CK)、乳酸脱氢酶(LDH)和肌钙蛋白I(cTnI);检测炎症因子高迁移率族蛋白1(HMGB1)、白介素17A(IL-17A)、肿瘤坏死因子α(TNF-α)、干扰素γ(INF-γ)和白介素6(IL-6);检测总p38(t-p38)和磷酸化p38(p-p38)。结果与SO组比较,I/R组中心肌损伤标记物CK[(3 891±245.44)U/L vs(1 539±140.57)U/L]、LDH [(1 917±140.54)U/L vs(889±87.23)U/L]、cTnI[(66.34±2.13)pg/mL vs(26.45±1.72)pg/mL];炎症因子HMGB1 [(0.423±0.059)vs(0.301±0.067)]、IL-17A[(149.29±5.88)pg/mL vs(55.26±4.33)pg/mL]、TNF-α[(185.27±5.61)pg/mL vs(95.34±3.56)pg/mL]、INF-γ[(418.86±12.37)pg/mL vs(223.35±10.51)pg/mL]、IL-6[(156.89±6.01)pg/mL vs (65.43±4.21 pg/mL]、p-p38[(0.416±0.025)vs(0.188±0.013)]表达明显增加,差异均有统计学意义(P<0.05);与I/R比较,A+I/R组中心肌损伤标记物CK[(1934±199.56)U/L]、LDH[(973±79.47)U/L]、cTnI[(38.1±2.69)pg/mL]和炎症因子HMGB1(0.174±0.026)、IL-17A[(93.65±2.69)pg/mL]、TNF-α[(145.85±3.92)pg/mL]、INF-γ[326.54±9.81]pg/mL]、IL-6[(95.47±3.16)pg/mL]、p-p38[(0.297±0.021)]表达明显降低,差异均有统计学意义(P<0.05)。结论青蒿素可能通过抑制p38MAPK通路减轻I/R中炎症反应;青蒿素亦可通过抑制炎症反应减轻心肌缺血再灌注损伤。
青蒿素;炎症;p38MAPK;心肌缺血再灌注损伤
急性心肌梗死是威胁我国人民健康的首要因素之一,早期再灌注治疗溶栓和急诊经皮冠脉介入治疗(PCI)可以最大程度地减轻心肌梗死的危害,改善人民的生存质量。组织缺血一段时间后再灌的同时也可以加重心肌组织的损伤,如凋亡和坏死,这种现象称为心肌缺血再灌注(I/R)损伤。缺血再灌注损伤是限制早期再灌注治疗获得最佳疗效的首要因素,因此,如何减轻心肌I/R损伤从而最大程度改善患者生存质量也是临床的重要任务之一。
青蒿素是青蒿的活性成分,且在世界范围内被证实为100%有效的抗疟药[1]。前期研究证实,青蒿素除抗疟作用外还可显著减少心肌I/R损伤,主要作用机制可能与抗氧化以及清除氧自由基有关[2]。大量实验证实,青蒿素具有明显的抗炎作用[3-5]。但青蒿素是否可以通过抑制炎症反应减弱心肌I/R损伤仍无相关研究。为了验证这个假设,我们在2015年11月至2016年1月进行了如下研究:
1 材料与方法
1.1 动物准备与分组 30只成年雄性SD大鼠,购于武汉大学动物实验中心。于恒温、恒湿、明/暗交替(12 h)的环境喂养48 h。大鼠缺血再灌注模型:2%戊巴比妥钠麻醉(40 mg/kg,ip)后,仰卧固定于鼠板,气管插管(频率70次/min,吸呼比1:1.5,潮气量3~4 mL/100 g)。胸骨左缘切口,暴露心脏,破心包膜;于左心耳下2~3 mm处将前降支与一个中间带有凹槽的空心乳胶管一起结扎。结扎线下心肌变苍白表明缺血成功。缺血30 min后,沿乳胶管凹槽剪断结扎线再灌注4 h。再灌注4 h,2%戊巴比妥钠麻醉(20 mg/kg,ip),颈静脉采血2 mL,迅速剪下心脏,剪除多余部分留取心梗区(白色)和缺血区(白色附近5 mm)用于检测。30只大鼠随机分为三组:假手术组(SO,n=10):仅插管、开胸、LAD下穿线但不结扎;缺血再灌注组(I/R,n=10):按照上面所述造模,缺血30 min,再灌注4 h;青蒿素治疗组(A+I/R,n=10):造模前1 d青蒿素灌胃(25 mg/kg。Tid),造模同I/R组。
1.2 检测指标和方法
1.2.1 分光光度法检测血清乳酸脱氢酶(LDH),肌酸激酶(CK)和肌钙蛋白I(cTnI) 静脉采血后静置10 min,待血液凝固后离心(3 000 r/min×15 min),取血清。选用南京建成生物工程研究所试剂盒,严格按照说明操作检测LDH和CK。
1.2.2 ELISA法检测心肌组织炎症因子 制备心肌组织匀浆,选用南京建成生物工程研究所试剂盒,严格按照说明操作检测心肌组织中白介素17A(IL-17A)、肿瘤坏死因子α(TNF-α)、干扰素γ(INF-γ)和白介素6 (IL-6)。根据标准曲线算出各因子浓度(pg/mL)。
1.2.3 Western blot法检测HMGB1、总P38(t-p38)和磷酸化p38(p-p38)方法如前所述[6],简言之,12% PAGE胶电泳,转膜,5%脱脂奶粉封闭,HMGB1、anti-p38和anti-p-p38的一抗液体中孵育过夜,在相应的二抗中孵育,ECL显色。以β-actin为参照计算HMGB1、t-p38和p-p38的相对表达量。
1.3 统计学方法 应用SPSS21.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间计量资料比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 三组大鼠的心肌损伤标记物比较 与SO组比较,I/R组中心肌损伤标记物(LDH,CK和cTnI)水平均明显升高(P<0.05);A+I/R组中CK和cTnI水平明显升高(P<0.05),但LDH水平与SO组相近,差异无统计学意义(P>0.05)。与I/R组比较,A+I/R组中LDH、CK和cTnI水平明显降低(P<0.05),见表1。
表1 三组大鼠的心肌损伤标记物比较(±s)

表1 三组大鼠的心肌损伤标记物比较(±s)
注:与SO组比较,aP<0.05;与I/R组比较,bP<0.05。
组别LDH(U/L)CK(U/L)cTnI(pg/mL) SO组I/R组A+I/R组F值P值889±87.23 1917±140.54a973±79.47b 175.7<0.01 1539±140.57 3891±245.44a1934±199.56ab478.3<0.01 26.45±1.72 66.34±2.13a38.1±2.69ab1858<0.01
2.2 三组大鼠的心肌组织中炎症因子表达比较 与SO组比较,I/R组和A+I/R组中炎症因子(HMGB1、IL-17A、TNF-α、INF-γ和IL-6)表达均明显升高(P<0.05)。与I/R组比较,A+I/R组中炎症因子(HMGB1、IL-17A、TNF-α、INF-γ和IL-6)的表达均明显降低,差异有统计学意义(P<0.05),见表2。
表2 三组大鼠的心肌组织中炎症因子表达比较(±s)

表2 三组大鼠的心肌组织中炎症因子表达比较(±s)
组别SO组I/R组A+I/R组F值P值HMGB1/β-actin 0.301±0.067 0.423±0.059a0.174±0.026ab51.59<0.01 IL-17A(pg/mL) 55.26±4.33 149.29±5.88a93.65±2.69ab404<0.01 TNF-α(pg/mL) 95.34±3.56 185.27±5.61a145.85±3.92ab479<0.01 INF-γ(pg/mL) 223.35±10.51 418.86±12.37a326.54±9.81ab801<0.01 IL-6(pg/mL) 65.43±4.21 156.89±6.01a95.47±3.16ab307<0.01
2.3 三组大鼠的p38-MAPK通路比较 与SO组比较,I/R组中p-p38表达水平明显升高(P<0.05),但t-p38表达水平相近,差异无统计学意义(P>0.05)。与I/R组比较,A+I/R组中p-p38水平明显降低(P<0.05),但t-p38表达水平相近,差异无统计学意义(P>0.05),见表3。
表3 三组大鼠的p38-MAPK通路比较(±s)
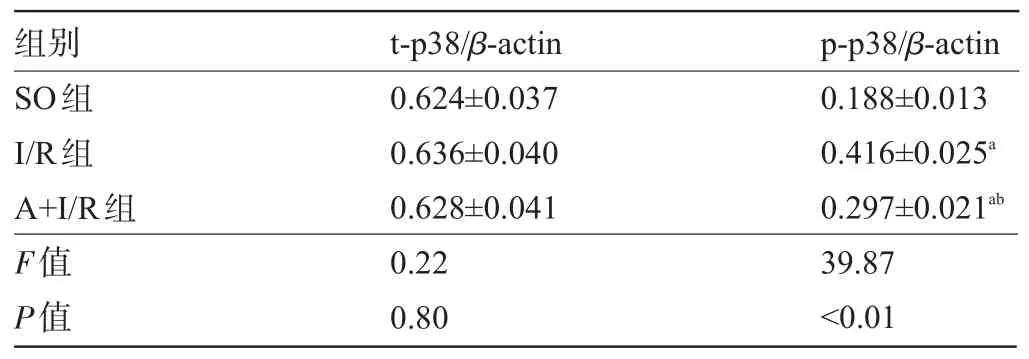
表3 三组大鼠的p38-MAPK通路比较(±s)
注:与SO组比较,aP<0.05;与I/R组比较,bP<0.05。
组别SO组I/R组A+I/R组p-p38/β-actin 0.188±0.013 0.416±0.025a0.297±0.021abt-p38/β-actin 0.624±0.037 0.636±0.040 0.628±0.041 F值P值39.87<0.01 0.22 0.80
3 讨 论
青蒿素是由我国专家最先从青蒿中提取的活性成分,因其100%的抗疟性而受到世界的关注[1]。近年的研究发现[3-5],青蒿素可以通过代谢为二氢青蒿素发挥显著的抗炎作用。在风湿性和类风湿性疾病中,青蒿素不但可以调节体液免疫还可以调节细胞免疫,显著抑制IL-1和IL-6等炎症因子的表达,进而抑制炎症反应[7]。进一步的研究发现,青蒿素可以调节T调节细胞(Treg)的表达,Treg细胞可以直接作用于未分化的CD4+T细胞或通过分泌转化生长因子(TGFβ)等细胞因子作用于未分化的CD4+T细胞,抑制Th17细胞的分化,Th17细胞是近年新发现的不同于Th1和Th2的辅助型细胞亚群,主要分泌IL-17A。故青蒿素可以通过抑制IL-17A表达,抑制炎症反应。在心脏方面,Gu等[3,8]发现青蒿素可以通过减弱心梗后炎症反应(TNF-α、IL-1β表达)抑制心梗后交感神经重构,以及恶性心律失常的发生,且可能与核因子kappaB (NF-kappaB)通路相关。本研究发现,青蒿素可以显著抑制缺血再灌注诱导的心肌酶和炎症因子HMGB1、IL-17A、TNF-α、INF-γ和IL-6的表达,有明显的抗炎和心肌保护作用。
HMGB1、IL-17A、TNF-α、INF-γ和IL-6均是心肌缺血再灌注损伤中典型的炎症因子[9],其表达水平反映了缺血再灌注损伤的炎症水平。HMGB1是近年新发现的促炎因子,在心肌缺血再灌注损伤中发挥了重要作用[10-11]。HMGB1存在于细胞核内,当细胞坏死时被释放到细胞外,可作为一种独立炎症因子,加重局部的炎症反应,同时还可以通过HMGB1-TLR4-IL-23/IL-17A轴调节下游IL-6和TNF-α的分泌进一步加重炎症反应[12-14]。如上所述,青蒿素还可以作用于幼稚型CD4+T细胞抑制Th17的分化,进而减少IL-17A的产生,减轻心肌缺血再灌注损伤,这也与本研究结果一致。此外,本研究发现,青蒿素可显著抑制I/R中p38MAPK通路激活。P38MAPK通路是一条经典的炎症通路,参与了多种炎症反应,包括心肌I/R损伤[14]。前期的研究证实,抑制p38MAPK通路激活可显著抑制HMGB1等炎症因子的释放[12]。因此,青蒿素可能通过抑制p38MAPK通路,抑制心肌缺血再灌注损伤中炎症反应。
综上所述,青蒿素可能通过抑制p38MAPK通路抑制HMGB1等炎症因子表达,也可通过抑制炎症反应减轻心肌缺血再灌注损伤。
[1]Haynes RK.Artemisinin and derivatives:the future for malaria treatment?[J].Curr Opin Infect Dis,2001,14(6):719-726.
[2]孙丽红,李鸿珠,韩丽萍,等.青篙素对离体大鼠的心肌缺血/再灌注损伤的保护作用[J].中国中药杂志,2007,32(15):1547-1551.
[3]Gu YW,Wang X,Wu G,et al.Artemisinin suppresses sympathetic hyperinnervation fowwlowing myocardial infarction via anti-inflammatory effects[J].J Mol Histol,2012,43(6):737-743.
[4]Li T,Chen H,Wei N,et al.Anti-inflammatory and immunomodulatory mechanisms of artemisinin on contact hypersensitivity[J].Int Immunopharmacol,2012,12(1):144-150.
[5]Wang Z,Qiu J,Guo TB,et al.Anti-inflammatory properties and regulatory mechanism of a novel derivative of artemisinin in experimental autoimmune encephalomyelitis[J].J Immunol,2007,179(9): 5958-5965.
[6]江洪,马瑞松,李元红,等.白介素33激活P38-MAPK通路保护心肌缺血再灌注损伤[J].实用医学杂志,2015,31(12):1911-1914.
[7]Efferth T,Romero MR,Wolf DG,et al.The antiviral activities of artemisinin and artesunate[J].Clin Infect Dis,2008,47(6):804-811.
[8]Gu YW,Wang X,Wu G,et al.Artemisinin prevents electric remodeling following myocardial infarction possibley by upregulating the expression of connexin 43[J].Mol Med Rep,2014,10(4): 1851-1856.
[9]Zhu H,Li J,Wang S,et al.Hmgb1-TLR4-IL-23-IL-17A axis promote ischemia-reperfusion injury in a cardiac transplantation model [J].Transplantation,2013,95(12):1448-1454.
[10]Hu X,Cui B,Zhou X,et al.Ethyl pyruvate reduces myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats[J].Mol Biol Rep,2012,39(1):227-231.
[11]Andrassy M,Volz HC,Igwe JC,et al.High-mobility group box-1 in ischemia-reperfusion injury of the heart[J].Circulation,2008,117 (25):3216-3226.
[12]Kawahara K,Biswas KK,Unoshima M,et al.C-reactive protein induces high mobility group box-1 protein release through activation of p38MAPK in macrophage RAW264.7 cells[J].Cardiovasc Pathol, 2008,17(3):129-138.
[13]Ding HS,Yang J,Chen P,et al.The HMGB1-TLR4 axis contributes to myocardial ischemia/reperfusion injury via regulation of cardiomyocyte apoptosis[J].Gene,2013(1):527:389-393.
[14]Gao XF,Zhou Y,Wang DY,et al.Urocortin-2 suppression of p38MAPK signaling as an additional mechanism for ischemic cardioprotection[J]. Mol Cell Biochem,2015,398(1-2):135-146.
Effects and mechanism of artemisinin on myocardial ischemia reperfusion injury in rats.
MA Rui-song1,JIANG Hong1,LI Yuan-hong2,HU Xiao-rong1,LIU Zi-qiang1.1.Department of Cardiology,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA;2.Department of Cardiology,the Central Hospital of Enshi Autonomous Prefecture,Enshi 445000,Hubei,CHINA
ObjectiveTo investigate the effects and possible mechanism of artemisinin on myocardial ischemia reperfusion injury in rats.MethodsRat I/R models were established by ischemia 30 min and reperfusion 4 h. Thirty SD rats were divided into three groups according to the random number table:sham operation group(SO,n=10), ischemia and reperfusion group(I/R,n=10)and artemisinin treatment group(A+I/R,n=10).Cardiac injury markers,including creatine kinase(CK),lactate dehydrogenase(LDH),and cardiac troponin(cTnI)were detected.The inflammatory cytokines[high mobility group box protein 1(HMGB1),interleukin-17A(IL-17A),tumor necrosis factor-α (TNF-α),gamma interferon(INF-γ),interleukin-6(IL-6)],total p38(t-p38),phosphorylation p38(p-p38))were detected.ResultsCompared with SO group,I/R group was significantly higher(P<0.05)in the cardiac injury markers of CK [(3 891±245.44)U/L vs(1 539±140.57)U/L],LDH[(1 917±140.54)U/L vs(889±87.23)U/L]and cTnI[(66.34±2.13)pg/mL vs(26.45±1.72)pg/mL],the inflammatory cytokines of HMGB1[(0.423±0.059)vs(0.301±0.067)],IL-17A[(149.29± 5.88)pg/mL vs(55.26±4.33)pg/mL],TNF-α[(185.27±5.61)pg/mL vs(95.34±3.56)pg/mL],INF-γ[(418.86±12.37)pg/mL vs(223.35±10.51)pg/mL],IL-6[(156.89±6.01)pg/mL vs(65.43±4.21)pg/mL],and p-p38[(0.416±0.025)vs(0.188± 0.013)].Compared with I/R group,A+I/R group was significantly lower(P<0.05)in the cardiac injury markers of CK [(1 934±199.56)U/L],LDH[(973±79.47)U/L]and cTnI[(38.1±2.69)pg/mL],inflammatory cytokines of HMGB1 [(0.174±0.026)],IL-17A[(93.65±2.69)pg/mL],TNF-α[(145.85±3.92)pg/mL],INF-γ[(326.54±9.81)pg/mL],IL-6 [(95.47±3.16)pg/mL],and p-p38[(0.297±0.021)].ConclusionArtemisinin can inhibit inflammatory responses probably via suppressing p38 MAPK signaling pathway activation,and thus attenuate myocardial I/R injury.
Artemisinin;Inflammation;p38MAPK;Myocardial ischemia and reperfusion injury
R-332
A
1003—6350(2016)11—1734—03
2016-01-19)
国家自然科学基金(编号:81370308);湖北省卫计委重点项目(编号:WJ2015MA021)
江洪。E-mail:jianghwurm@163.com;李元红。E-mail:yuanhongwhu@126.com
