一株拮抗稻瘟病内生链霉菌OsiSh—10的筛选与鉴定
2016-03-05廖红东袁珊珊杨远柱刘选明
廖红东++袁珊珊++杨远柱++刘选明++徐婷++胡小纯++曾夏冬++张鑫++刘雨晴++朱咏华��

摘 要:从湖南浏阳大围山种植的湘矮早7号水稻中,筛选到一株对水稻稻瘟病菌有显著抑制效果的水稻内生放线菌OsiSh-10菌株.由拮抗菌包覆种子和喷晒水稻叶面的实验表明将该菌喷晒于水稻叶面可以对叶瘟起到明显的控制效果,且喷一次的效果比喷两次的效果好,包覆种子反而使病情指数升高.根据形态特征、培养特征、生理生化、16s rRNA序列比对及进化树构建鉴定OsiSh-10菌株属于白色链霉菌(Streptomyces albus).OsiSh-10是一株具有稻瘟病生防潜力的菌株.
关键词:鉴定;内生放线菌;稻瘟病;筛选;白色链霉菌
中图分类号:Q781 文献标识码:A
Screening and Indentification of an Endophytic
Streptomyces to Antagonize Rice Blast
LIAO Hong-dong1, YUAN Shan-shan1, YAN Yuan-zhu2,LIU Xuan-ming1,XU Ting1,
HU Xiao-chun2,ZENG Xia-dong1,ZHANG Xin1,LIU Yu-qing1,ZHU Yong-hua1
(1.College of Biology, Hunan Univ, Changsha,Hunan 410082, China;
2.Hunan Yahua Seed Scientific Research Institute, Changsha,Hunan 410116, China)
Abstract: An endophytic actinomycete strain OsiSh-10 significantly against rice blast pathogens was successfully isolated from Xiangaizao 7 rice (Oryza indica) of Liuyang Dawei Mountain in Hunan Province. The control effects of OsiSh-10 on leaf blast in field were investigated by coating seeds and spraying leaf of rice with it, which were as follows: leaf blast was controlled by spraying OsiSh-10 on leaf of rice , but coated seeds with OsiSh-10 unworked for leaf blast. According to its morphological features, culture characteristics, physiological and biochemical characteristics, 16s rRNA gene sequence comparison, and phylogenetic tree construction analysis, OsiSh-10 strain was classified as Streptomyces albus. OsiSh-10 strain is a promising biocontrol actinomycete for rice blast.
Key words:identification; endophytic actinomycetes; rice blast; screening;streptomyces albus
全世界一半以上的人口以水稻作为主食,尤其是东亚和东南亚地区[ 1].许多研究表明,至2030年水稻的产量需提高40%才能养活日益增长的人口[ 2].稻瘟病是一种由梨孢霉菌(Magnaporthe oryzae)引起的严重危害水稻产量的真菌性病害,能在全世界各个水稻种植区广泛地爆发[ 3].每年因稻瘟病的发生导致全世界的水稻产量降低1%~50%,这些损失价值7百亿美元,可以养活6千万人口[ 2].利用化学农药和抗稻瘟病品种仍是稻瘟病防治的普遍措施.长期大量使用化学农药不仅会污染环境,而且其毒性会损害人类健康,同时还引起病原菌产生抗药性;由于受环境影响及抗病品种单一导致稻瘟病致病性变异而产生新的生理小种,使得抗病品种在3~5年后就丧失抗病性,因此这两种措施都有了一定的局限性[ 4].生物防治有高效、广谱、不污染环境、不导致病原菌产生抗性等优点[ 5].目前利用微生物对植物病害进行防治的生物防治已经逐渐引起人们的注意[ 6].
湖南大学学报(自然科学版)2015年
第12期廖红东等:一株拮抗稻瘟病内生链霉菌OsiSh-10的筛选与鉴定
近来研究显示水稻体内自身就存在一些具有抑制水稻疾病的内生菌[ 5, 7-8].内生菌是一种能够在植物体内生存而不对寄主植物产生明显伤害的微生物,是一种天然的微生物活体农药来源,因其生存在植物体内,可以减少田间操作、气候变化等因素对其生长、繁殖和防治效果的影响[ 9].通过严格的表面消毒和合适的培养方式,越来越多的内生菌从水稻的根[ 10-11]、茎[ 12]、叶[ 13]中被分离出来和鉴定.由于放线菌生长缓慢且分离条件相对苛刻,目前分离出的内生菌大多是细菌和真菌[ 14-16],内生菌放线菌分离的报道较少,尤其是具有抑制稻瘟病菌性能的内生放线菌的研究并不多.放线菌是已知产生生物活性物质最多的一类微生物[ 17],分离并筛选新的拮抗稻瘟病内生放线菌具有非常重要的实际意义.
本文从湖南省浏阳市大围山种植的湘矮早7号水稻中分离筛选出一株对稻瘟病菌有明显抑制效果的放线菌OsiSh-10菌株,经形态特征、培养特征、生理生化特征和16S rRNA序列进行分析,鉴定为白色链霉菌(Streptomyces alblus).这是白色链霉(Streptomyces alblus)拮抗稻瘟病的首次报道,为水稻稻瘟病的生物防治及菌株拮抗作用机制提供了新的思路.
1 材料与方法
1.1 材 料
1.1.1 样品及供试菌株
从湖南省浏阳大围山采取湘矮早7号水稻;稻瘟病菌生理小种梨孢霉菌62,S07取自于湖南农业大学,梨孢霉菌RB3取自湖南亚华种子有限公司;湘矮早7号种子取自湖南亚华种子有限公司.
1.1.2 培养基
分离筛选水稻内生放线菌的培养基:
1)维他命B腐植酸琼脂培养基(HV):腐植酸1 g,磷酸氢二钠0.25 g,氯化钾 0.85 g,七水合硫酸镁0.025 g,七水合硫酸亚铁0.05 g,碳酸钙0.01 g,琼脂粉18 g,Vitamin B 100× 1 mL,纯水1 000 mL,pH值7.2 ± 0.2,1×105 Pa灭菌25 min.其中腐植酸用0.2 mol/L的氢氧化钠溶液稀释溶解后再加入到培养基溶液中;Vitamin B 100×:盐酸硫胺素5 mg,核黄素5 mg,烟酸5 mg,维生素B6 5 mg,肌醇5 mg,泛酸钙5 mg,对氨基苯甲酸25 mg,生物素25 mg,纯水100 mL,须经过直径0.22 μm的微孔滤膜过滤除菌,在高温灭菌的HV培养基冷却至55 ℃左右时,在无菌条件下加入1 mL Vitamin B 100×充分混匀后倒板;
2)甘露醇大豆琼脂培养基(MS):甘露醇20 g,大豆粉20 g,琼脂粉20 g,纯水1000 mL,pH值7.2 ± 0.2,1×105Pa灭菌25 min.其中大豆粉单独灭菌烘干,待培养基冷却至55 ℃左右时,在无菌条件下加入大豆粉充分混匀后倒板;
3)酵母提取物琼脂培养基(TWYE):酵母提取物0.25 g,磷酸氢二钾0.5 g,琼脂粉18 g,纯水1 000 mL,pH值7.2 ± 0.2,1×105 Pa灭菌25 min;
4)水琼脂培养基(WA):琼脂粉18 g,纯水1 000 mL,pH值7.2 ± 0.2,1×105 Pa灭菌25 min;
5)无机盐淀粉培养基(ISP4):可溶性淀粉10 g,磷酸氢二钾1 g,氯化钠1 g,硫酸铵2 g,碳酸钙2 g,七水硫酸镁1 g,七水硫酸亚铁0.001 g,七水氯化锰0.001 g,琼脂粉18 g,pH值7.2 ± 0.2,1×105 Pa灭菌25 min.
用于放线菌的培养及拮抗实验的培养基:马铃薯葡萄糖琼脂(PDA):北京奥博星生物技术有限责任公司购买的马铃薯葡萄糖琼脂38 g,纯水定容至1 000 mL,自然pH,1×105 Pa灭菌25 min.
1.2 方 法
1.2.1 放线菌的分离与纯化
水稻组织表面消毒分离法.将采集的新鲜水稻上的泥沙用清水洗净,室温放置过夜干燥.将干燥好的水稻分成根、茎、叶和鞘4个组织,并在超净工作台中对各组织进行表面消毒:浸于124 mmol/L的磷酸氢二钠缓冲液中超声1 min,无水乙醇浸泡1 min,4%(质量分数)的次氯酸钠溶液浸泡6 min,70%(体积分数)的乙醇处理30 s,再用无菌水清洗样品30 s后将样品浸泡于5%(质量分数)的硫代硫酸钠溶液中5 min,最后用无菌水清洗5次并置于干净培养皿中,在超净台里干燥1~3 h.为了验证表面消毒是否彻底,收集水稻表面消毒最后一步中清洗过水稻的无菌水,取200 μL均匀涂布于TWYE培养基上放入培养箱培养24 h左右.若24 h后TWYE培养基上无任何微生物生长即说明此次表面消毒有效[18].在超净工作台中用剪刀将干燥好的水稻组织样品剪成1 cm左右长的小段,再将这些小段置于5种分离培养基上(HV,MS,TWYE,WA和ISP4),分别在27 ℃及37 ℃的温度下培养至8周左右.观察培养皿中放线菌的析出情况,将析出的放线菌挑出转移到PDA培养基中培养.将挑出的内生菌在PDA培养基上不断划线培养从而获得该菌的纯培养物,用50%甘油储存放到-80 ℃冰箱中保存,备用.
1.2.2 拮抗放线菌的筛选及抗菌效果测定
拮抗放线菌的筛选采用平板对峙法.稻瘟病菌生理小种梨孢霉菌RB3,S07和62在PDA养基上28 ℃培养7 d备用,将5 mm梨孢霉菌RB3的菌块接于直径90 mm的PDA培养基平板中央,并在距离培养皿中心30 mm的位置上接种活化好的放线菌,每个处理重复3次,以不接待测放线菌为对照,置于28 ℃恒温培养箱中培养,10 d后观察实验结果,测量真菌菌落边缘与放线菌之间的距离和真菌菌丝生生抑制率.真菌菌丝生长抑制率按照下式计算:真菌菌丝生长抑制率=[ 1-(实验组真菌菌丝生长直径平均数/对照组真菌菌丝生长直径平均数)×100%].
1.2.3 拮抗菌株大田抗稻瘟病性能的测定
首先将湘矮早7号水稻种子进行表面消毒[ 19],再将消过毒的种子分别做4种处理.空白组:水稻种子未经OsiSh-10菌株处理,置于铺有两层湿润滤纸片的培养皿中,再于37 ℃恒温培养箱中4 d直至发芽,最后将发芽的水稻种子播种于大田,并在田间4周播种已经感染稻瘟病的发芽的水稻幼苗;1组:水稻种子用3×107cfu浓度的OsiSh-10孢子液包覆种子,再进行如空白组一样的发芽和播种;2组:水稻种子进行如空白组一样的处理,但在幼苗生长的第10 d和第20 d向水稻叶面喷晒浓度为107~108cfu的OsiSh-10孢子液;3组:水稻种子进行如空白组一样的处理,但只在幼苗生长的第20 d向水稻叶面喷晒浓度为107~108cfu的OsiSh-10孢子液.每个实验组做3块田平行.最后在水稻生长的30 d观察各实验组的发病情况,从每个实验组的每块田随机采集100个水稻叶片,并按照《稻瘟病检测调查规范中华人民共和国国家标准》来统计记算各组叶片发病程度和病情指数.发病程度是感染病斑的面积占整个叶片面积的百分比.病情指数的计算公式:病情指数=[ ∑(各级发病程度×各级发病程度的叶片数)/(最高发病程度×调查的总叶片数)]×100%.
1.2.4 拮抗菌株形态特征、培养特征及生理生化特
征的测定
首先记录拮抗菌在PDA培养基上培养7 d后的菌落形态特征,并取拮抗菌插片在光学显微镜下观察气生菌丝的分支形状,按照《伯杰氏细菌鉴定手册》和ISP法[ 20]对拮抗菌株的生理生化特征和不同培养基上的培养特征进行检测,从而对菌株进行初步鉴定.
1.2.5 拮抗菌株DNA提取、16S rRNA基因PCR
扩增及系统进化树的构建
首先取新鲜的菌液加到灭菌的抽提器中研磨,使菌团散开,收集磨好的菌液置于1.5 mL eppendorf管中12 000 r/min转速离心2 min,去上清.用试剂盒中的TE缓冲液重悬菌体,加入0.5 mL体积的玻璃珠,漩涡震荡2 min,收集液体到干净的Ep管中.按照上海GENEray公司细菌DNA提取试剂盒说明书提取拮抗菌株的DNA.以所提取的DNA为模板,分别以引物27f:5′-AGAGTTTGATCCTGGCTCAG-3′,765r:5′-CTGTTTGCTCCCCAC GCTTTC -3′和引物704f:5′-GTAGCGGTG AAATGCCTAGA-3′,492r:5′-GGTTACCTTGTTACGACTT-3′,这两对引物扩增16S rRNA.PCR反应体系(35 μL):10× buffer 3.5 μL,20 mmol/L浓度的MgCl2 3.5 μL,一对10 μmol/L引物共2.8 μL,10 mmol/L dNTP 1.4 μL,2 U/μL Taq酶0.7 μL,ddH2O 22.1 μL,DNA模板 1 μL.PCR反应程序为(30 d循环):95 ℃预变性5 min,94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1.5 min,72 ℃后延伸10 min.琼脂糖凝胶电泳分析扩增产物.并将两段PCR产物送至铂尚生物技术(上海)有限公司进行测序以及将所测得两段序列拼接为16S rRNA基因序列,再将该拼接后的序列与NCBI上的核酸数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行对比分析,用Clustalxl1.83软件和MEGA5.1软件进行序列比对分析和系统进化树的构建(邻接法).
2 结果与分析
2.1 拮抗稻瘟病菌的放线菌的筛选及抗菌效果测定结果
通过表面消毒结合5种分离培养基(HV,MS,TWYE,WA和ISP4)的方法从健康的湘矮早7号水稻中分离出25株水稻内生放线菌,用平板对峙培养法进行筛选,最终获得一株对稻瘟病菌有显著拮抗效果的菌株,编号为OsiSh-10.该拮抗菌对3种稻瘟病菌生理小种(RB3,S07,62)的抑制作用如图1所示.均表现出对稻瘟病菌有明显的抑制作用.OsiSh-10菌株对RB3,S07和62的菌丝生长抑制率分别是48.15%,40.54%和59.1%,对RB3,S07和62的抑菌距离分别是15 mm,17 mm和21 mm.
2.2 OsiSh-10处理后对大田水稻抗稻瘟病性能的初步分析
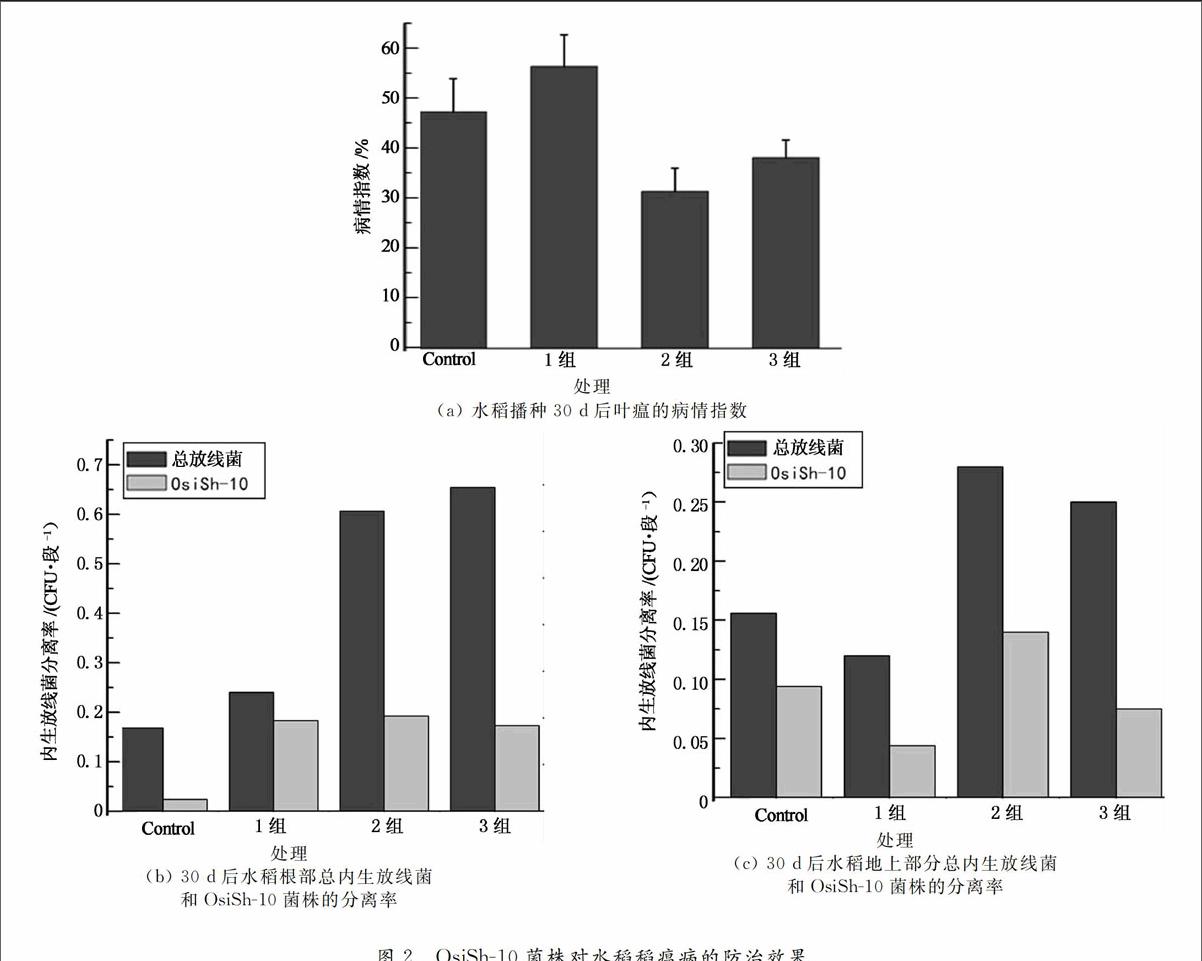
大田条件下,OsiSh-10菌株对30 d稻瘟病叶瘟的防治效果如图2(a)所示,经OsiSh-10菌株孢子液喷晒一次(3组)的水稻叶瘟病情指数是37.7%,低于空白组水稻叶瘟病情指数(46.75%),喷晒二次(2组)的水稻叶瘟病情指数达31.01%,显示OsiSh-10菌株孢子液喷晒对叶瘟病有较好的控制效果,而且增加喷洒次数对叶瘟防治有促进作用.然而采用OsiSh-10菌株包覆水稻种子(1组)的水稻叶瘟病情指数却为55.73%,高于未经处理的空白组水稻叶瘟病情指数.
由水稻根部总内生放线菌和OsiSh-10的重分离结果(图2(b))可知,经OsiSh-10菌株孢子液喷晒一次(3组)的水稻根部总内生放线菌分离率0.68%、喷晒二次(2组)的水稻根部总内生放线菌分离率0.63%和包覆种子(1组)的水稻根部总内生放线菌分离率0.25%菌比空白组(0.18%)大;经OsiSh-10菌株孢子液喷晒一次(1组)的水稻根部OsiSh-10分离率0.18%、喷晒二次(2组)的水稻根部OsiSh-10分离率0.2%与包覆种子(3组)的水稻根部OsiSh-10分离率0.19%相差不大,但都比空白组(0.03%)大.结果显示接种OsiSh-10菌株会增加其在根部的数量,但接种部位(叶面或者根部)对于其根部的菌株分离率影响不大,接种OsiSh-10菌株后,水稻根部的其他内生放线菌的数量提高,特别是用叶面喷洒方式接种时,提高尤为显著,显示出OsiSh-10对水稻根部微生态有明显影响.
由水稻地上部分总内生放线菌和OsiSh-10的重分离结果(图2(c))可知,经OsiSh-10菌株孢子液喷晒二次的水稻地上部分总内生放线菌分离率0.28%、喷晒一次的水稻地上部分部总内生放线菌分离率0.25%比空白组(0.16%)大,但包覆种子的水稻地上部分部总内生放线菌分离率0.12%比空白组小;在水稻地上部分OsiSh-10分离率中,仅经OsiSh-10菌株孢子液喷晒二次的分离率0.14%比空白组(0.09%)大,喷晒一次(0.08%)和包覆种子(0.04%)均比空白组小.与根部情况不同,OsiSh-10菌株接种并不普遍提高其地上部分的菌株分离率,经种子包覆接种和仅喷洒一次接种,其OsiSh-10菌株分离数量反而轻微降低,只有重复喷洒接种方式才能提高地上部分的OsiSh-10分离率,但是喷洒方式依然能够提高地上部分分离的内生放线菌总量.由病情结果显示,喷洒接种OsiSh-10菌株能够显著降低稻瘟病病情指数,分离结果提示OsiSh-10菌株存在多重抗稻瘟病机制,除了直接分泌拮抗物质之外,对水稻体内微生态的影响也是一个重要因素.
2.3 OsiSh-10菌株的菌落形态特征、培养特征以及生理生化特征
OsiSh-10菌株在PDA培养基上培养7 d后菌落呈圆形,干燥多皱、气生菌丝淡黄色且呈同心环状,不产生可溶性色素;在光学显微镜下观察到OsiSh-10菌株的基内菌丝和气生菌丝均生长丰茂,且分枝多;孢子丝为螺旋形(图3).培养特征实验结果(表1)表明,OsiSh-10菌株在蔗糖硝酸盐培养基、葡萄糖天门冬素培养基和甘油天门冬素培养基上长势较差,在其他培养基上生长较良好.在8种培养基上气生菌丝和基内菌丝的颜色及可溶性色素的产生情况基本一致.生理生化及碳源利用试验结果(表2)表明,OsiSh-10菌株可以在15~40 ℃及pH 5~11范围内生长,能水解淀粉和酪氨酸,明胶液化,不能水解纤维素,能利用葡糖糖、木糖、阿拉伯糖、鼠李糖、果糖、半乳糖、甘露醇,很轻微地利用蔗糖和柳醇,不能利用棉子糖和肌醇.根据形态特征、培养特征、生理生化特征结合《伯杰氏细菌手册》和文献[ 21]描述初步认定该菌为白色链霉菌.
2.4 16S rRNA序列及系统发育分析
利用两对引物通过PCR方法所克隆出的两段序列.经测序和拼接,最后得到OsiSh-10菌株的16S rRNA基因序列长度为1 359 bp.将OsiSh-10菌株的16S rRNA基因序列在NCBI上通过BLAST比对分析,发现OsiSh-10菌株与白色链霉菌的遗传距离最小,且同源性达99%,16S rRNA基因序列建立的系统发育树见图4.基于16S rRNA序列分析进行细菌鉴定是国际上通用的分子鉴定技术.16S rRNA序列同源性小于98%,则认为种不同;同源性小于93%~95%,则认为属不同[ 22].综合OsiSh-10菌株的形态特征、培养特征、生理生化特征和16S rRNA基因序列,最终鉴定其为白色链霉菌(Streptomyces alblus).
注:分支点上的数字表示构建系统进化树时1 000次计算时形成该节点的百分比;
标尺或刻度0.1代表10%的16S rRNA基因序列的进化差异.
图4 基于16S rRNA基因序列建立的OsiSh-10菌株系统发育树
Fig.4 Phylogenetic tree of OsiSh-10 strain based on 16S rRNA gene sequences
3 讨 论
新型拮抗内生放线菌的分离和评价是通过生物防治来控制和解决稻瘟病的重要研究领域之一,拮抗效果显著的菌株不仅能够提高生物防治技术的实用性,还对内生菌防治机理的研究大有裨益.本研究从湖南省大围山种植的湘矮早7号水稻地上部分分离出25株内生放线菌,从中筛选出一株编号为OsiSh-10的菌株,该菌株在平板对持实验中对3种水稻稻瘟病菌生理小种均有明显拮抗效果,这3种生理小种均自感染稻瘟病的水稻内直接分离出来的,由此表明OsiSh-10菌株有较好的稻瘟病生防潜力.初步的田间实验结果显示,OsiSh-10菌株孢子液喷晒于水稻叶片,可以对叶瘟起到明显的控制效果,且喷晒二次的效果比一次的效果好,但是用菌孢子包覆方式接种反而加重病情.实验结果显示无论采用哪种接种方式,OsiSh-10菌株在水稻根部的分离率基本一致,暗示其在根部的定殖可能受到一定的数量限制,在根部的过量接种反而引起植物的应急反应,使水稻地上部分内生放线菌的总量降低,减低了抵抗稻瘟病的能力.内生菌主要通过几个方面达到抗菌作用:产生抗性代谢物杀死或抑制病原菌;激活植物的系统获得性抗性(SAR)和诱导抗性(ISR)等免疫反应,刺激植物次生代谢的分泌、细胞程序死亡或促进植物生长等来提高对病原菌的抵抗能力;争夺或影响生态位来减缓或者抑制稻瘟病.OsiSh-10菌株分离自水稻叶鞘,直接喷洒显然有助于增加其在叶片中的定殖量并提高水稻的抗病能力.虽然,明显的平板拮抗效应显示OsiSh-10可能分泌某种代谢物抑制稻瘟病菌的生长,但是大田实验重分离结果显示由OsiSh-10介导的微生态变化可能有更为重要的作用.这有待于对0siSh-10菌株拮抗代谢物分离鉴定及其拮抗机制作进一步研究.经形态特征、培养特征、生理生化特征和16S rRNA 序列进行分析,鉴定OsiSh-10菌株为白色链霉菌,白色链霉菌是链霉菌的模式种,而其作为拮抗稻瘟病的水稻内生菌则是首次报道,这有利于利用该模式种的丰富研究基础来进一步探索内生放线菌抗稻瘟病的机理以及田间防治方式.
参考文献
[1] XIONG Zhi-qiang, TU Xiao-rong, WEI Sai-jin, et al. In vitro antifungal activity of antifungalmycin 702, a new polyene macrolide antibiotic, against the rice blast fungus Magnaporthe grisea[ J]. Biotechnology Letters, 2013, 35(9): 1475-1479.
[2] KHUSH G S. What it will take to feed 5.0 billion rice consumer in 2030[ J]. Plant Molecular Biology, 2005, 59(1): 1-6.
[3] SCHEUERMANN K K, RAIMONDI J V, MARSCHALEK R, et al. Magnaporthe oryzae genetic diversity and its outcomes on the search for durable resistance[ J]. Agricultural and Biological Sciences, 2012, 3(30): 331-356.
[4] 温小红, 谢明杰, 姜健, 等. 水稻稻瘟病防治方法研究进展[ J]. 中国农学通报, 2013, 29(3): 190-195.
WEN Xiao-hong, XIE Ming-jie, JIANG Jian, et al. Advances in research on control method of rice blast[ J]. Chinese Agricultural Science Bulletin, 2013, 29(3): 190-195. (In Chinese)
[5] SHAN Hong-ying, ZHAO Ming-min, CHEN De-xin, et al. Biocontrol of rice blast by the phenaminom ethylacetic acid producer of Bacillus methylotrophicus strain BC79[ J]. Crop Protection, 2013, 44(2):29-37.
[6] 闫梦红, 蔡正求, 韩继刚, 等. 植物内生细菌在防治植物病害中的应用研究[ J]. 生物技术通报, 2004(3): 8-12.
YAN Meng-hong, CAI Zheng-qiu, HAN Ji-gang, et al. The applied research of endophytic bacteria in biological control of plant disease[ J]. Biotechnology Bullietin, 2004(3): 8-12. (In Chinese)
[7] SUADA I K, CHUN K W, CHA J Y, et al. Ability of endophytic fungi isolated from rice to inhibit Pyricularia oryzae induced rice blast in indonesia[ J]. Journal of the Faculty of Agriculture Kyushu University, 2012, 57(1): 51-53.
[8] YASUDA M, SHINOZAKI S, ISAEA T, et al. Effects of colonization of a bacterial endophyte, Azospirillum sp B510, on disease resistance in Rice[ J]. Bioscience, Biotechnology and Biochemistry, 2009, 73(12): 2595-2599.
[9] YU Hong-sheng, ZHANG Lei, LIN Li, et al. Recent developments and future prospects of antimicrobial metabolites produced by endophytes[ J]. Microbiological Research, 2010, 165(6): 437-449.
[10]SESSITSCH A, HARDOIM P, DORING J, et al. Functional characteristics of an endophyte community colonizing rice roots as revealed by metagenomic analysis[ J]. Molecular Plant-Microbe Interactions, 2012, 25(1): 28-36.
[11]ZHU Bo, LIU He, TIAN Wen-xiao, et al. Genome sequence of Stenotrophomonas maltophilia RR-10, isolated as an endophyte from rice root[ J]. Journal of Bacteriology, 2012, 194(5): 1280-1281.
[12]YUAN Zhi-lin, SU Zhen-zhu, MAO Li-jian, et al. Distinctive endophytic fungal assemblage in stems of wild rice (Oryza granulata) in China with special reference to two species of Muscodor (Xylariaceae)[ J]. The Journal of Microbiology, 2011, 49(1): 15-23.
[13]MAHAPATRA S, BANERJEE D. Diversity and screening for antimicrobial activity of endophytic fungi from alstonia scholaris[ J]. Acta Microbiologica and Immunologica Hungarica, 2010, 57(3): 215-223.
[14]SPENCE C, ALFF E, JOHNSON C, et al. Nature rice rhizospheric microbes suppress rice blast infection[ J]. BioMedCentral Plant Biology, 2014, 14: 130-146.
[15]SAIKIA R, GOGOI D K, YADAV A, et al. Brevibacillus laterosporus strain BPM3, a potential biocontrol agent isolated from a natural hot water spring of Assam, India[ J]. Microbiological Research, 2011, 166(3): 216-225.
[16]SU Zhen-zhu, MAO Li-juan, LI Na, et al. Evidence for biotrophic lifestyle and biocontrol potential of dark septate endophyte Harpophora oryzae to Rice Blast disease[ J]. Plos One, 2013, 8(4): e61332.
[17]蒋怡, 唐蜀昆, 张玉琴, 等. 放线菌产生的生物活性物质[ J]. 微生物学通报, 2007, 34(1): 188-190.
JIANG Yi, TANG Shu-kun, ZHANG Yu-qin, et al. Biological active substance produced by actinomycetes[ J]. Microbiology Bulletin, 2007, 34(1):188-190. (In Chinese)
[18]KAEWKLA O, FRANCO C M. Rational approaches to improving the isolation of endophytic actinobacteria from australian native trees[ J]. Microbiology Ecology, 2013, 65(2): 384-393.
[19]XIONG Xian-qiu, LIAO Hong-dong, MA Jiang-shan, et al.Isolation of a rice endophytic bacterium, Pantoea sp. Sd-1, with ligninolytic activity and characterization of its rice straw degradation ability[ J]. Letters in Applied Microbiology, 2014, 58(2): 123-129.
[20]SHIRLING E B, GOTTLIEB D. Methods for characterization of Streptomyces species[ J]. International Journal of Systematic Bacteriology, 1966, 16(3): 313-340.
[21]宋尚直. 关于白色链霉菌的筛选与鉴定[ J]. 微生物学通报, 1979,5(1): 49-52.
SONG Shang-zhi. Screening and indentification of Streptomyces albus[ J]. Microbiology Bulletin, 1979,5(1):49-52. (In Chinese)
[22]FELSENSTEIN J. Confidence limits on phylogenies: an approach using the bootstrap[ J]. Evolution, 1985, 39(4): 783-791.
