梅毒血清固定患者细胞免疫功能及DNA甲基化转移酶表达水平分析
2016-03-04袁军杨祖庆田丽闪罗珍胄
袁军 杨祖庆 田丽闪 罗珍胄
梅毒血清固定患者细胞免疫功能及DNA甲基化转移酶表达水平分析
袁军 杨祖庆 田丽闪 罗珍胄
目的检测梅毒血清固定患者细胞免疫功能, 分析其外周血单个核细胞中的DNA甲基化和DNA甲基化转移酶(DNMT)水平。方法67例梅毒患者, 其中一期梅毒26例(一期梅毒组), 二期梅毒22例(二期梅毒组), 梅毒血清固定19例(梅毒血清固定组), 选取同期健康人25例作为对照组。比较各组Th1/Th2细胞因子、DNA甲基化及DNMT表达水平。结果四组干扰素-γ(TFN-γ) 、白细胞介素-2(IL-2)、肿瘤坏死因子-α(TNF-α)、白细胞介素-4(IL-4)及白细胞介素-10(IL-10)水平比较差异具有统计学意义 (F=7.435、8.577、5.688、5.578、7.658, P<0.05)。四组DNA甲基化及DNMT表达水平比较差异具有统计学意义 (F=16.456、9.467, P<0.05)。结论Th1 /Th2 细胞免疫平衡失调在梅毒血清固定患者中发挥了重要的作用, 其机制可能与DNA甲基化具有密切关系。
梅毒血清固定;Th1/Th2;DNA甲基化
梅毒是一种由苍白螺旋体感染所导致的, 可以侵犯全身多个系统、器官的慢性性传播疾病, 流行病学研究显示, 近年来, 我国梅毒的发病率正呈现逐年上升的趋势, 严重影响了人类健康。一般认为梅毒患者在通过多个疗程的正规驱梅治疗后, 由于药物和机体之间的相互作用, 可能会使患者外周血在2年内基本阴转, 而部分梅毒患者即使进行了多个疗程正规驱梅治疗, 但梅毒快速血浆反应素试验(RPR)仍然持续阳性, 很长时间不能转阴, 形成血清固定[1]。有研究表明,血清固定的原因与T细胞亚群分化失调导致的细胞免疫功能异常密切相关, 而T细胞亚群在分化过程中, 有多种细胞因子伴有DNMT位点的变化及基因表达水平的变化[2]。因此,本研究对梅毒血清固定患者细胞免疫功能进行了检测, 并对DNMT表达水平进行探究, 具体结果报告如下。
1 资料与方法
1.1 一般资料 选取2014年4月~2016年4月本院梅毒患者67例, 其中一期梅毒26例(一期梅毒组), 男15例, 女11例, 年龄27~57岁, 平均年龄(42.14±8.37)岁;二期梅毒22例(二期梅毒组), 男13例, 女9例, 年龄27~56岁, 平均年龄(43.31±9.62)岁;梅毒血清固定19例(梅毒血清固定组),男11例, 女8例, 年龄27~58岁, 平均年龄(43.17±8.81)岁;选取同期本院体检健康人25例作为对照组, 男13例, 女12例, 年龄22~59岁, 平均年龄(42.91±7.62)岁。四组年龄、性别等一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。
1.2 研究方法
1.2.1 细胞因子检测 所有研究对象均在清晨空腹状态下抽取静脉血5 ml, 离心处理后采用双抗体夹心酶联免疫吸附试验测定TFN-γ 、 IL-2、 TNF-α、 IL-4及 IL-10水平。
1.2.2 DNA甲基化以及DNMT表达水平 抽取静脉血20 ml,进行单个细胞分离处理, 提取RNA和DNA, 甲基化定量试剂盒检测外周血单个核细胞中基因组DNA甲基化水平, 利用实时定量聚合酶链式反应(PCR)法测定DNMT表达水平。
1.3 统计学方法 采用SPSS20.0统计学软件对数据进行统计分析。计量资料以均数±标准差(±s)表示, 采用t检验,多组间比较采用方差分析;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 Th1/Th2细胞因子比较 四组TFN-γ、IL-2、TNF-α、IL-4及IL-10水平比较差异具有统计学意义 (P<0.05)。在Th1因子中, TFN-γ、IL-2及TNF-α在对照组中最高, 在梅毒血清固定组中最低;在Th2因子中, IL-4及IL-10在对照组中最低, 在梅毒血清固定组中最高。见表1。
2.2 DNA甲基化及DNMT表达水平比较 四组DNA甲基化及DNMT表达水平比较差异具有统计学意义 (P<0.05)。对照组DNA甲基化及DNMT表达水平最高, 梅毒血清固定组最低。见表2。
表1 四组Th1/Th2细胞因子比较(±s)

表1 四组Th1/Th2细胞因子比较(±s)
注:四组比较, P<0.05
组别 例数 Th1因子 Th2因子TFN-γ(pg/ml) IL-2(ng/L) TNF-α(pg/ml) IL-4(ng/L) IL-10(pg/ml)一期梅毒组 26 3.56±0.34 482.12±32.27 4.09±1.21 309.24±41.31 14.66±1.33二期梅毒组 22 3.01±0.19 452.12±29.29 3.67±0.88 334.12±42.98 15.82±1.09梅毒血清固定组 19 2.12±0.27 308.14±18.23 2.27±0.76 427.17±36.26 16.25±1.21对照组 25 4.33±0.26 514.22±34.87 5.67±1.17 265.45±18.93 9.54±0.34 F 7.435 8.577 5.688 5.578 7.658 P 0.000 0.000 0.000 0.000 0.000
表2 四组DNA甲基化及DNMT表达水平比较(±s)
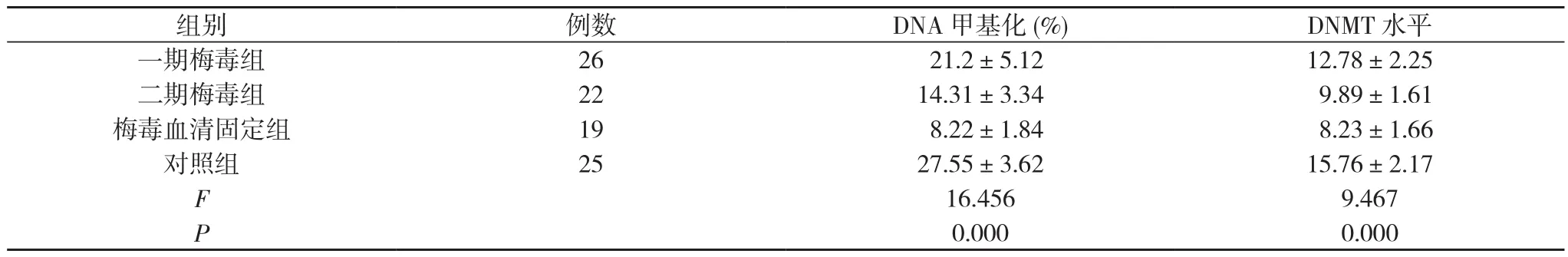
表2 四组DNA甲基化及DNMT表达水平比较(±s)
注:四组比较, P<0.05
组别 例数 DNA甲基化(%) DNMT水平一期梅毒组 26 21.2±5.12 12.78±2.25二期梅毒组 22 14.31±3.34 9.89±1.61梅毒血清固定组 19 8.22±1.84 8.23±1.66对照组 25 27.55±3.62 15.76±2.17 F 16.456 9.467 P 0.000 0.000
3 讨论
大量的研究已经证实, 人体在抵抗梅毒治病以及保护机体免遭梅毒感染过程中, 细胞免疫在机体免疫系统中发挥着重要的作用, 并被认为是是清除体梅毒的主要方式[3]。目前, 临床中驱梅治疗的效果在很大程度上是与T细胞分泌的细胞因子有关系。胸腺内分化成熟的 T 细胞, 根据体内细胞表面抗原 CD 分子表达的不同分为 CD4+和 CD8+T 细胞,根据以往的研究, 梅毒固定患者外周血中CD4 +/ CD8 +的失衡导致免疫应答, Th细胞分化在梅毒清除过程中发挥着重要的作用[4]。
本研究的结果发现, TFN-γ、IL-2、TNF-α在对照组中最高, 在梅毒血清固定组中最低, TFN-γ、IL-2、TNF-α是由Th1 细胞分泌, 并在机体中发挥各自的作用, Th1细胞因子的降低表明体内中的NK细胞、 中性粒细胞的吞噬杀伤能力低下, 不能有效清除梅毒螺旋体;IL-4及IL-10因子对照组中最低, 在梅毒血清固定组中最高, IL-4及IL-10因子是由Th2分泌的, 其可以在介导体液免疫反应, 又可以在一定程度上抑制Th1的增殖, Th2因子的升高可以从侧面反映病情的加重。大量研究发现, 梅毒患者早期的免疫应答主要以Th1细胞因子为主, 但随着病程加重, Th2 型免疫应答会被逐渐的激活, 进一步抑制 Th1 型免疫反应。当Th1 /Th2平衡向 Th2 型转向时, 表明机体细胞免疫防御能力降低, 转阴能力变弱[5]。梅毒血清固定的细胞免疫功能异常可能与DNA低甲基化具有密切的关系。
综上所述, Th1 /Th2 细胞免疫平衡失调在梅毒血清固定患者中发挥了重要的作用, 其机制可能与DNA甲基化具有密切关系。
[1]包图雅, 于娜沙, 曾抗, 等.梅毒血清固定患者细胞免疫功能研究.实用预防医学, 2006, 13(2):254-255.
[2]谢海莉, 赵进, 李伟, 等.梅毒血清固定患者细胞免疫功能检测分析.中国皮肤性病学杂志, 2013, 27(1):49-51.
[3]关杨, 杨帆, 莫衍石, 等.54例梅毒血清固定患者临床分析及细胞免疫功能检测.中国热带医学, 2013, 13(10):1266-1268.
[4]何大保, 袁军, 李真, 等.梅毒患者外周血T淋巴细胞表观遗传学DNA甲基化及组蛋白修饰的研究.海南医学院学报, 2012, 18(11):1533-1536.
[5]任悦, 付蓉, 王化泉, 等.免疫相关性血细胞减少症患者外周血CD4+T细胞DNA甲基化异常的分析.中华医学杂志, 2014, 94(28):2165-2168.
10.14164/j.cnki.cn11-5581/r.2016.15.009
2016-05-18]
518054 深圳市南山区慢性病防治院
