小麦–黑麦易位系T1BL.1RS在小麦品种中的分布及其与小麦赤霉病抗性的关联
2016-03-03秦胜男顾世梁
李 韬 郑 飞 秦胜男 李 磊 顾世梁
扬州大学江苏省作物遗传生理重点实验室 / 粮食作物现代产业技术协同创新中心 / 教育部植物功能基因组学重点实验室 / 小麦研究中心, 江苏扬州 225009
小麦–黑麦易位系T1BL.1RS在小麦品种中的分布及其与小麦赤霉病抗性的关联
李韬*郑飞秦胜男李磊顾世梁
扬州大学江苏省作物遗传生理重点实验室 / 粮食作物现代产业技术协同创新中心 / 教育部植物功能基因组学重点实验室 / 小麦研究中心, 江苏扬州 225009
摘要:黑麦1R染色体短臂(1RS)携带条锈病、叶锈病、秆锈病、白粉病和蚜虫等抗性基因。为了检测1RS上是否携带与赤霉病抗性相关的基因, 本研究采用1RS特异标记Xscm9对192个来自不同国家的品种/系构成的小麦自然群体和1个重组自交系(RIL)群体(宁7840与Chokwang杂交的F7群体, 共184个系)进行了分子检测, 并在2011—2013年采用单花滴注法于温室中进行赤霉病抗性鉴定。结果发现, 自然群体中22个品种携带1RS, 携带1RS的株系三季赤霉病平均病小穗率(PSS)均显著低于不携带1RS株系的PSS (P<0.01), 表明1RS对降低病小穗率有显著作用。分子标记和基因组原位杂交(GISH)检测结果表明, 宁7840携带1RS。通过对宁7840/Chokwang衍生的RIL群体进行赤霉病抗性鉴定和基因型分析, 发现不论主效赤霉病抗性基因Fhb1 (标记Xsts142)存在与否, 携带1RS株系的PSS显著低于不携带1RS株系的PSS (P<0.01); 方差分析表明, 宁7840携带的Fhb1与1RS在赤霉病抗扩展性上无显著互作(P>0.05)。因此认为, 黑麦1RS染色体很可能携带赤霉病扩展抗性相关基因, 与Fhb1基因有累加效应。
关键词:小麦; 黑麦; T1BL.1RS易位系; 赤霉病
本研究由国家转基因生物新品种培育科技重大专项(2012ZX08009003-004), 国家自然科学基金项目(31171537)和江苏省高校优势学科建设工程项目(PAPD)资助。
This study was supported by the National Major Project of Breeding for New Transgenic Organisms (2012ZX08009003-004), the National Natural Science Foundation of China (31171537), and the Project Funded by the Priority Academic Program Development of Jiangsu Higher Education Institutions (PAPD).
在小麦遗传改良中, 来自小麦近缘种黑麦的基因发挥了重要作用, 尤其以黑麦1R染色体短臂(1RS)应用最为广泛[1]。该短臂上携带抗条锈病基因Yr9、抗叶锈病基因Lr26、抗秆锈病基因Sr31以及抗白粉病基因Pm8和Pm17, 目前已经将这些抗病基因转移到小麦栽培品种中[2-3]。1RS携带俄罗斯蚜虫[4-5]和麦二叉蚜[6-7]的抗性基因。1RS对增加小麦根系生物量[8]、提高小麦产量[9]、促进小麦适应性[10]也有作用。一般认为, T1BL.1RS易位系对小麦加工品质有负向影响[12], 1RS携带的部分抗病基因已被病原菌毒性生理小种克服[11], 但据肖永贵等[12]报道, T1BL.1RS易位系白粉病抗性和千粒重显著高于非易位系[13]。因此, T1BL.1RS易位系在小麦育种中的利用价值仍值得深入研究。目前, 利用1RS特异鉴别标记Xscm9可以快速鉴别和有效区分来源不同的T1AL.1RS和T1BL.1RS易位系[14-16]。
小麦赤霉病是由禾谷镰刀菌(Fusarium graminearum)引起的一种破坏性病害, 在湿润和半湿润地区广泛发生[17]。在我国, 赤霉病一直是淮河以南及长江中下游麦区发生最严重的病害之一。东北春麦区、黄淮海平原麦区和西北麦区也曾多次发生大流行, 造成严重损失。自2000年以来, 我国先后9次发生小麦赤霉病大流行, 尤以2012年最为严重, 估计受害小麦面积达1000万公顷, 部分田块产量损失高达100%。近年来, 随着玉米种植面积不断扩大及秸秆还田技术的推广, 留在田间的作物残茬成为赤霉病菌繁殖的良好寄主, 致使小麦赤霉病有逐渐加重的趋势[18], 不仅造成产量损失, 而且使食品安全面临巨大挑战。目前, 研究人员已经在普通小麦或其近缘种中定位了超过100多个抗性QTL[19], 但只对其中极少数主效QTL进行了比较精细的定位, 并用于抗病育种, 如3BS染色体上的Fhb1位点、6B染色体上Fhb2位点和7A染色体上的QTL等, 其中以苏麦3号携带的Fhb1应用最为广泛[20-23]。据报道,偃麦草、披碱草等小麦近缘种属中也携带赤霉病抗性基因[24-26], 但黑麦1RS染色体与小麦赤霉病抗性的关系, 国内外至今未见报道。本研究主要通过小麦单花滴注鉴定和1RS特异标记分析, 在小麦自然群体和重组近交系群体(RIL)中分别解析1RS与赤霉病抗性的关系, 进一步拓展对T1BL.1RS功能的认识。
1 材料与方法
1.1供试材料
自然群体由192份小麦品种(系)组成, 包括中国小麦地方品种48个、育成品种74个, 日本品种27个,美国品种26个, 其他国家或机构的引进品种16个(见附表)。重组近交系群体为宁7840/Chokwang经单籽粒传法衍生的F7代, 由184个系构成。宁7840是我国抗赤霉病小麦品种, 其系谱为Aurora/安徽11//苏麦3号; Chokwang是韩国小麦品种, 对赤霉病表现中抗。
2011—2013年连续3季, 将自然群体、RIL群体及其亲本种植于美国堪萨斯州立大学温室, 所有材料先在4。C下春化处理7周, 然后移栽到4 cm × 4 cm塑料盆钵中, 于温室(昼22±5℃/夜17±2℃)随机区组排列, 每系2个重复(2盆), 每重复5株。
1.2赤霉病菌接种和抗性鉴定方法
参照Yu等[27]描述的方法准备赤霉菌孢子悬浮液(5000孢子 mL-1), 采用单花滴注法接种。于小麦始花期, 用注射器吸取10 µL孢子液注射入麦穗中间小穗的一个小花中, 每盆接种6~10穗。单花接种后立即置22~26。C迷雾室保湿48~72 h, 出现症状后从迷雾室移至温室。接种21 d后调查病小穗数, 计算病小穗率。病小穗率(%) = (病小穗数/总小穗数) × 100。用Matlab软件(MathWorks Inc., Natick, MA, USA)进行表型数据的相关分析及方差分析。
1.31RS特异引物扩增与分析
取小麦幼苗, 采用CTAB法提取基因组DNA[28]。参照Yu等[27]报道的PCR体系和Touch-down PCR扩增程序, 扩增引物Xscm9是1RS的特异鉴别标记,能够扩增出207 bp的特异片段[15-16]。用ABI 3730 DNA分析仪(Applied Biosystems, FosterCity, CA, USA)分离PCR扩增产物, 用GeneMarker 1.6 (Softgenetics Inc. LLC, State College, PA)分析分子标记数据。
1.4基因组原位杂交(GISH)分析
以黑麦DNA片段作为探针, 以宁7840及其亲本的DNA作为模板, 进行荧光原位杂交。参照Gustafson[29]描述的方法进行探针标记、杂交和洗涤,以CCD摄像机(Olympus, Japan)捕获图像。
2 结果与分析
2.1T1BL.1RS易位系在自然群体中分布及与赤霉病抗性的关系
用T1BL.1RS特异分子标记Xscm9对自然群体192份材料进行检测, 在22个品种(系)中扩增出预期的207 bp特异带(见附表), 占品种总数的11.5%, 包
括12个我国小麦育成品种(系), 1个我国小麦地方品种, 6个美国品种, 2个阿根廷品种和1个俄罗斯品种。在日本品种中, 未检测到Xscm9标记阳性品种。
2011—2013年连续3季进行赤霉病菌人工接种的抗性调查, 其平均PSS分别为0.25 (0.03~1.00)、0.40 (0.05~1.00)和0.52 (0.06~1.00)。PSS在品种间和年度间差异显著(P<0.001), 而且存在品种×年度互作(P<0.001), 但年度间PSS表现显著正相关(P<0.001),相关系数分别为0.75、0.60和0.68。
对比分子标记检测和抗病性鉴定结果, 发现2011、2012和2013年携带1RS材料的PSS平均值分别为0.34、0.35和0.42, 而不携带1RS材料的平均值分别为0.42、0.48和0.46 (图1)。t测验结果显示, 携带1RS材料的PSS显著低于不携带1RS材料的PSS (t=10.249, t0.05=3.84)。

图1 自然群体中Xscm9阳性和阴性品种间病小穗率Fig. 1 Percentage of symptomatic spikelets of the two groups contrasting in 1RS*表示两类品种间有显著差异(P<0.05)。* indicates significant difference between the Xscm9 positive and negative groups at P<0.05.
2.2RIL群体中1RS与赤霉病抗性的关系
在宁7840及其亲本之一Aurora中都检测到Xscm9的特异扩增产物, 但在宁7840另两个亲本苏麦3号和安徽11中未检测到该扩增产物(见附表)。结合系谱分析, 初步推定宁7840中1RS的易位片段来自Aurora。该推断被以黑麦DNA为探针的GISH实验证实, GISH图像显示Aurora和宁7840的染色体上带有荧光标记, 而安徽11和苏麦3号染色体上没有荧光信号(图2)。
宁7840高抗赤霉病, 携带主效抗性 QTL Fhb1和易位染色体T1BL.1RS; Chokwang中抗赤霉病, Xscm9扩增为阴性, 不携带1RS (见附表)。由这两个品种衍生的RIL群体各系的PSS在基因型间和年度间存在显著差异(P<0.001), 并且二者互作显著(P< 0.001); 3年鉴定结果一致(P<0.001), 相关系数分别为0.55、0.60和0.56。2011、2012和2013年平均PSS分别为0.47、0.34和0.49, 变异幅度分别为0.06~1.00、0.06~0.83和0.06~1.00; 2011年与2013年赤霉病发病情况相似, 2012年病情明显较轻。

图2 宁7840及其亲本的GISH图像Fig. 2 GISH for Ning7840 and its parentsA: 宁7840; B: 安徽11; C: 苏麦3号; D: Aurora。箭头示黑麦1RS染色体臂。A: Ning 7840; B: Anhui 11; C: Sumai 3; D: Aurora.Arrows show the chromatin from rye.
宁7840的3BS上存在一个主效赤霉病抗性QTL Fhb1, 能够解释16.7%~28.6%的PSS表型变异[19]。STS标记Xsts142与Fhb1位点紧密连锁[30], 且在双亲间有多态性。由表1可见, Fhb1和1RS均与抗扩展性显著关联(P<0.001), 但两者之间没有显著互作(P=0.48)。
从RIL群体的Xsts142阳性株系(携带Fhb1)看,同时还携带1RS株系的平均PSS为0.25, 只携带Fhb1株系的平均PSS为0.35 (表2), 二者差值(0.10) 为1RS的估计贡献率(P<0.01)。同理, 从Xsts142阴性株系估计, 1RS的贡献率为0.07 (P<0.05); 从Xscm9阳性株系估计, Fhb1的贡献率为0.26 (P<0.001); 从Xscm9阴性株系估计, Fhb1的贡献率为0.230 (P<0.001)。可见, 不论T1BL.1RS存在与否, Fhb1株系的PSS均显著小于非Fhb1株系; 不论Fhb1存在与否, 1RS株系的PSS始终显著小于非1RS的株系(图3)。1RS的估计贡献率平均值为0.08, Fhb1的估计贡献率平均值为0.24, 说明Fhb1和1RS对赤霉病的贡献率大约分别为0.24和0.08, 1RS虽然可增强赤霉病抗性, 但其效应小于Fhb1。

表1 Fhb1和1RS组合的赤霉病扩展抗性Table 1 Analysis of variance of 1RS and Fhb1 to type 2 resistance to Fusarium head blight

表2 Fhb1、1RS不同组合型品种的赤霉病病小穗率Table 2 Rate of symptomatic spikelets of combinations contrasting in Fhb1 and 1RS
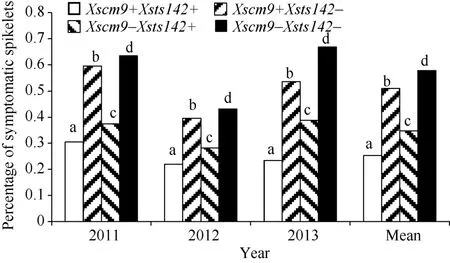
图3 Fhb1与1RS不同组合型品种的赤霉病扩展抗性Fig. 3 Type 2 resistance for groups of different Fhb1 and 1RS combinations不同字母表示两类品种间有显著差异(P<0.05)。Bars superscripted by different letters are significantly different between the Xscm9 positive and negative groups at P<0.05.
3 讨论
由于1RS携带抗白粉, 抗条锈、叶锈、秆锈, 以及抗蚜虫等基因, T1BL.1RS易位系曾在生产上广泛应用[31], 但部分抗病基因被新出现的毒性小种所克服, 因此目前育种中锈病和白粉病防治很少依赖T1BL.1RS携带的抗病基因。1RS上携带的赤霉病抗性基因与白粉病、锈病及蚜虫等抗性位点的遗传关系是一因多效还是紧密连锁还需要进一步的研究。本研究在192个小麦品种(系)中, 通过1RS特异标记Xscm9鉴定到携带T1BL.1RS的22个品种, 通过对Xscm9阳性品种宁7840及其亲本Aurora的GISH实验, 验证了Xscm9用于鉴定1RS易位系的可靠性。T1BL.1RS在自然群体中的频率约为11.5%, 包括21个小麦育成品种(系)和一个中国地方品种火烧麦。育成品种中1RS可能是育种过程中通过亲本组配和杂交实现了T1BL.1RS定向导入, 而火烧麦中的1RS易位系可能与异交有关, 具体原因有待进一步分析。在自然群体中, 1RS与非1RS的赤霉病病小穗率平均相差0.084, 估计1RS贡献率为8.4%; 而在RIL群体中, 1RS与非1RS病小穗率平均相差0.081, 估计贡献率为8.1%, 二者非常接近, 因此推断1RS可能携带一个微效赤霉病抗性基因, 其效应显著小于Fhb1位点。在本研究中, 宁7840/Chokwang衍生的RIL群体中Fhb1的估计贡献率为24.3%, 介于文献中报道的Fhb1贡献率16.7%~28.6%[19]。这一结果表明, 1RS对降低病小穗率和提高赤霉病抗性有正向效应, 1RS与Fhb1没有显著的互作效应(表1), 二者效应可以累加(表2和 图3), 因此更有利于育种实践中同时或单独利用Fhb1和T1BL.1RS易位系。
4 结论
1RS对增强赤霉病抗性有正向效应。本文192
份国内外种质资源T1BL.1RS的鉴定结果, 对育种家选配杂交亲本提供了有益的信息。
致谢: 自然群体赤霉病鉴定由张大栋博士(美国堪萨斯州立大学)协助完成, 本实验材料由Bai Guihua博士(美国堪萨斯州立大学)提供, 荧光原位杂交实验由Bernd Friebe博士(美国堪萨斯州立大学)协助完成, 谨致谢意。
References
[1] Rabinovich S. Importance of wheat-rye translocations for breeding modern cultivar of Triticum aestivum L. Euphytica, 1998, 100: 323–340
[2] Mago R, Miah H, Lawrence G J, Wellings C R, Spielmeyer W, Bariana H S, McIntosh R A, Pryor A J, Ellis J G. High-resolution mapping and mutation analysis separate the rust resistance genes Sr31, Lr26 and Yr9 on the short arm of rye chromosome 1. Theor Appl Genet, 2005, 112: 41–50
[3] Singh N, Shepherd K, McIntosh R. Linkage mapping of genes for resistance to leaf, stem and stripe rusts and ω-secalins on the short arm of rye chromosome 1R. Theor Appl Genet, 1990, 80: 609–616
[4] Anderson G R, Papa D, Peng J, Tahir M, Lapitan N L. Genetic mapping of Dn7, a rye gene conferring resistance to the Russian wheat aphid in wheat. Theor Appl Genet, 2003, 107: 1297–1303
[5] Peng J, Wang H, Haley S D, Peairs F B, Lapitan N L V. Molecular mapping of the Russian wheat aphid resistance gene Dn2414 in wheat. Crop Sci, 2007, 47: 2418–2429
[6] Lu H, Rudd J C, Burd J D, Weng Y. Molecular mapping of greenbug resistance genes Gb2 and Gb6 in T1AL.1RS wheat–rye translocations. Plant Breed, 2010, 129: 472–476
[7] Mater Y, Baenziger S, Gill K, Graybosch R, Whitcher L, Baker C, Specht J, Dweikat I. Linkage mapping of powdery mildew and greenbug resistance genes on recombinant 1RS from ‘Amigo’ and ‘Kavkaz’ wheat–rye translocations of chromosome 1RS.1AL. Genome, 2004, 47: 292–298
[8] Maheepala D C, Ehdaie B, Waines J G. Yield performance of wheat isolines with different dosages of the short arm of rye chromosome 1. J Agron Crop Sci, 2015, 201: 152–160
[9] Howell T, Hale I, Jankuloski L, Bonafede M, Gilbert M, Dubcovsky J. Mapping a region within the 1RS.1BL translocation in common wheat affecting grain yield and canopy water status. Theor Appl Genet, 2014, 127: 2695–2709
[10] Ehdaie B, Whitkus R W, Waines J G. Root biomass, water-use efficiency, and performance of wheat-rye translocations of chromosomes 1 and 2 in spring bread wheat ‘Pavon’. Crop Sci, 2003, 43: 710–717
[11] Yang M Y, Ren T H, Yan B J, Li Z, Ren Z L. Diversity resistance to Puccinia striiformis f. sp. tritici in rye chromosome arm 1RS expressed in wheat. Genet Mol Res, 2014, 13: 8783–8793
[12] 刘建军, 肖永贵, 程敦公, 李豪圣, 刘丽, 宋健民, 刘爱峰, 赵振东, 何中虎. 利用揉面特性鉴定小麦1BL/1RS易位系. 作物学报, 2009, 35: 79–86
Liu J J, Xiao Y G, Cheng D G, Li H S, Liu L, Song J M, Liu A F, Zhao Z D, He Z H. Identification of 1BL/1RS translocation based on Mixograph parameters in common wheat. Acta Agron Sin, 2009, 35: 79–86 (in Chinese with English abstract)
[13] 肖永贵, 阎俊, 何中虎, 张勇, 张晓科, 刘丽, 李天富, 曲延英,夏先春. 1BL/1RS易位对小麦产量性状和白粉病抗性的影响及其QTL分析. 作物学报, 2006, 32: 1636–1641
Xiao Y G, Yan J, He Z H, Zhang Y, Zhang X K, Liu L, Li T F, Qu Y Y, Xia X C. Effect of 1BL.1RS translocation on yield traits and powdery mildew resistance in common wheat and QTL analysis. Acta Agron Sin, 2006, 32: 1636–1641 (in Chinese with English abstract)
[14] 余利, 何方, 陈桂玲, 崔法, 亓晓蕾, 王洪钢, 李兴锋. 利用1RS特异标记和染色体原位杂交技术鉴定小麦1BL·1RS 易位系. 作物学报, 2011, 37: 563–569
Yu L, He F, Chen G L, Cui F, Qi X L, Wang H G, Li X F. Identification of 1BL·1RS wheat–rye chromosome translocations via 1RS specific molecular markers and genomic in situ hybridization. Acta Agron Sin, 2011, 37: 563–569 (in Chinese with English abstract)
[15] Saal B, Wricke G. Development of simple sequence repeat markers in rye (Secale cereale L.). Genome, 1999, 42: 964–972
[16] Weng Y, Azhaguvel P, Devkota R N, Rudd J C. PCR-based markers for detection of different sources of 1AL.1RS and 1BL.1RS wheat–rye translocations in wheat background. Plant Breed, 2007, 126: 482–486
[17] Bai G, Shaner G. Management and resistance in wheat and barley to Fusarium head blight. Annu Rev Phytopathol, 2004, 42: 135–161
[18] 曾娟, 姜玉英. 2012年我国小麦赤霉病暴发原因分析及持续监控与治理对策. 中国植保导刊, 2013, 33(4): 38–41
Zeng J, Jiang Y Y. The causal factors for the epidemics of wheat Fusarium head blight in the year of 2012 in China and the strategies for continuous monitoring and prevention. China Plant Prot, 2013, 33(4): 38–41 (in Chinese)
[19] Buerstmayr H, Ban T, Anderson J A. QTL mapping and marker-assisted selection for Fusarium head blight resistance in wheat: a review. Plant Breed, 2009, 128: 1–26
[20] Draeger R, Gosman N, Steed A, Chandler E, Thomsett M, Schondelmaier J, Buerstmayr H, Lemmens M, Schmolke M, Mesterhazy A. Identification of QTLs for resistance to Fusarium head blight, DON accumulation and associated traits in the winter wheat variety Arina. Theor Appl Genet, 2007, 115: 617–625
[21] Cuthbert P A, Somers D J, Brulé-Babel A. Mapping of Fhb2 on chromosome 6BS: a gene controlling Fusarium head blight field resistance in bread wheat (Triticum aestivum L.). Theor Appl Genet, 2007, 114: 429–437
[22] Liu S, Zhang X, Pumphrey M O, Stack R W, Gill B S, Anderson J A. Complex microcolinearity among wheat, rice, and barley revealed by fine mapping of the genomic region harboring a major QTL for resistance to Fusarium head blight in wheat. Funct Integr Genomic, 2006, 6: 83–89
[23] Ma H, Zhang K, Gao L, Bai G, Chen H, Cai Z, Lu W. Quantitative trait loci for resistance to Fusarium head blight and deoxynivalenol accumulation in Wangshuibai wheat under field conditions. Plant Pathol, 2006, 55: 739–745
[24] Zeng J, Cao W, Hucl P, Yang Y, Xue A, Chi D, Fedak G. Molecular cytogenetic analysis of wheat–Elymus repens
introgression lines with resistance to Fusarium head blight. Genome, 2013, 56: 75–82
[25] Turner M K, DeHaan L R, Jin Y, Anderson J A. Wheatgrass–wheat partial amphiploids as a novel source of stem rust and Fusarium head blight resistance. Crop Sci, 2013, 53: 1994–2005 [26] Zhang X, Shen X, Hao Y, Cai J, Ohm H W, Kong L. A genetic map of Lophopyrum ponticum chromosome 7E, harboring resistance genes to Fusarium head blight and leaf rust. Theor Appl Genet, 2011, 122: 263–270
[27] Yu J B, Bai G H, Cai S B, Ban T. Marker-assisted characterization of Asian wheat lines for resistance to Fusarium head blight. Theor Appl Genet, 2006, 113: 308–320
[28] Porebski S, Bailey L G, Baum B R. Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components. Plant Mol Biol Rep, 1997, 15: 8–15
[29] Gustafson J, Dille J. Chromosome location of Oryza sativa recombination linkage groups. Proc Natl Acad Sci USA, 1992, 89: 8646–8650
[30] Liu S, Zhang X, Pumphrey M O, Stack R W, Gill B S, Anderson J A. Complex microcolinearity among wheat, rice, and barley revealed by fine mapping of the genomic region harboring a major QTL for resistance to Fusarium head blight in wheat. Funct Integr Genomic, 2006, 6: 83–89
[31] Kim W, Johnson J W, Baenziger P S, Lukaszewski A J, Gaines C S. Agronomic effect of wheat–rye translocation carrying rye chromatin (1R) from different sources. Crop Sci, 2004, 44: 1254–1258

附表 1RS特异标记Xscm9在供试群体中的分布Supplementary table Distribution of the 1RS-specific marker Xscm9 in the wheat population tested

(续附表)

(续附表)

(续附表)

(续附表)
URL: http://www.cnki.net/kcms/detail/11.1809.S.20151218.0915.018.html
Distribution of Wheat–Rye Translocation Line T1BL.1RS in Wheat and Its Association with Fusarium Head Blight Resistance
LI Tao*, ZHENG Fei, QIN Sheng-Nan, LI Lei, and GU Shi-Liang
Jiangsu Provincial Key Laboratory of Crop Genetics and Physiology / Co-innovation Center for Modern Production Technology of Grain Crops / Key Laboratory of Plant Functional Genomics of Ministry of Education, Yangzhou University, Yangzhou 225009, China
Abstract:The short arm of 1R chromosome (1RS) of rye carries resistant genes to stripe rust, leaf rust, stem rust, powdery mildew and aphids. To understand if 1RS also mediates resistance to wheat Fusarium head blight (FHB), we genotyped a panel of 192 wheat accessions from diverse geographic regions and a population of recombinant inbred lines (RIL) consisting of 184 lines developed from the cross of Ning 7840 and Chokwang by 1RS-specific molecular marker Xscm9 and evaluated FHB severities in three consecutive seasons in greenhouses using single floret inoculation method. The results demonstrated that 22 of 192 accessions carried a T1BL.1RS translocation, and the mean FHB severity (PSS) of varieties carrying T1BL.1RS translocation was significantly lower than that of lines without the translocation across the three experiments (P < 0.05), indicating 1RS may have a positive effect on reducing FHB severity. 1RS-specific marker Xscm9 and Genome in situ hybridization (GISH) showed Ning 7840 carries T1BL.1RS translocation. In the population of RILs, irrespective of Fhb1 locus, the mean PSS of lines with T1BL.1RS translocation was significantly lower than that of those lines without T1BL.1RS. The effects of Fhb1 and 1RS on FHB resistance were additive and the interactions between them were not significant (P = 0.48). The results of this study suggested that 1RS of rye most likely carries the genes resistant to FHB.
Keywords:Wheat; Rye; T1BL.1RS translocation; Fusarium head blight
收稿日期Received(): 2015-09-11; Accepted(接受日期): 2015-11-20; Published online(网络出版日期): 2015-12-18.
通讯作者*(Corresponding author): 李韬, E-mail: taoli@yzu.edu.cn
DOI:10.3724/SP.J.1006.2016.00320
