萘酚电化学传感器的构建及其应用研究
2016-03-03任聚杰李柳佳于聪聪籍雪平
任聚杰,李柳佳,崔 敏,翟 淼,于聪聪,籍雪平
(1. 河北科技大学理学院,河北石家庄 050018;2. 河北医科大学基础医学院,河北石家庄 050017)
萘酚电化学传感器的构建及其应用研究
任聚杰1,李柳佳1,崔敏1,翟淼1,于聪聪1,籍雪平2
(1. 河北科技大学理学院,河北石家庄050018;2. 河北医科大学基础医学院,河北石家庄050017)
摘要:构建了一种基于聚L-半胱氨酸/氧化石墨烯复合材料修饰玻碳电极的萘酚电化学传感器,并用于1-萘酚(1-NAP)和2-萘酚(2-NAP)两种同分异构体的同时检测。采用循环伏安法(CV)及差分脉冲伏安法(DPV)考察了1-NAP和2-NAP在该复合膜修饰电极上的电化学行为,并对电极的修饰及萘酚同分异构体的检测条件进行了优化。结果显示,在pH值为7.5的0.1 mol/L PBS缓冲液中,复合膜修饰电极对萘酚的电化学氧化具有较强的催化活性,两者的峰电位差约为0.182 V,能基本达到萘酚同分异构体的氧化峰分离。在优化的实验条件下,采用差分脉冲伏安法(DPV)进行测定,发现1-NAP和2-NAP分别在2~40 μmol/L和1~40 μmol/L的浓度范围内,与其对应氧化峰电流呈良好线性关系,其中1-NAP检出限为0.19 μmol/L(S/N= 3),2-NAP检出限为0.12 μmol/L(S/N=3)。另外,此修饰电极在检测中还表现出良好的稳定性和重现性,具有较强的抗干扰能力。将修饰电极用于实际水样品中1-NAP 和2-NAP 的测定,其加标回收率分别为98.9%~101.7%和97.7%~102.1%。
关键词:电化学分析;萘酚;电化学传感器;聚L-半胱氨酸;氧化石墨烯
E-mail:jujieren@126.com
任聚杰,李柳佳,崔敏,等.萘酚电化学传感器的构建及其应用研究[J].河北科技大学学报,2016,37(1):39-46.
萘酚是重要的工业原料。常常作为有机原料和中间体用于油脂、染料、香料、医药、农药的合成与生产中。萘酚有2种同分异构体,即1-萘酚(1-NAP)和2-萘酚(2-NAP)。虽然萘酚在工业生产中具有重要的作用,但它对人体和环境的危害也不容忽视。例如:1-萘酚具有潜在毒性,会使细胞癌变、畸变、突变等,当人体大量吸收时,还会出现皮炎、头痛、呕吐、腹泻等不良症状[1-2];2-NAP的毒性比1-NAP强,不仅可以通过接触引起皮炎,还可以通过呼吸道、消化道等途径引起全身系统中毒,导致腹痛、肾损伤、循环系统病变等[3-5]。随着化学工业的飞速发展,酚类化合物作为环境中的主要有害物质,给生物体带来了极大的危害。1-萘酚和2-萘酚2种同分异构体的结构相似、性质相近,其氧化电位相近,而且它们还经常共存于同一个产品中互相干扰,难以分离定量检测。因此,建立一种可靠、实用且能同步检测2种物质的分析方法对控制环境污染有着重要意义。
目前测定萘酚异构体的方法主要有气相色谱-质谱分析法[6]、高效液相色谱法[7-8]、毛细管电泳法[9]、液相色谱法-质谱联用技术[10]、荧光光度法[11-12]和免疫学方法[13]等。然而这些方法大多存在仪器设备昂贵、前期预处理复杂、试剂用量大等不足,严重限制了其实际应用。相对于这些分析方法,电化学分析法因准确度高、响应灵敏、操作简便、成本低廉、抗干扰能力强、仪器便携等优势,在环境污染物和生物分子的检测方面越来越受到关注。目前,关于1-NAP和2-NAP同步检测的电化学方法还较少[14-20]。这主要是因为1-NAP和2-NAP为同分异构体,性质和结构相似,两者的氧化电位相近,所以形成的氧化电流峰往往会部分重叠,相互干扰,导致电流响应与物质的浓度不呈现线性关系而无法准确测定。而萘酚又具有较强的吸附能力,在电化学氧化过程中易在电极表面聚合,使电极的表面积减小,活性变差。
近年来,在电化学传感器构建方面,有机物聚合薄膜由于具有良好的稳定性、重现性、较多活性位点、成膜均匀及修饰膜在电极表面吸附性强等优点而受到广泛应用[21]。ZHANG等[14]制备了一种聚吖啶橙膜修饰玻碳电极用于萘酚的检测,可以在2-NAP存在下实现对1-NAP的定量分析,且两者的氧化电位相差170 mV。另外,纳米材料具有比表面积大、导电性好且表面富含功能基团等优点,在构建电化学传感器方面受到了广泛应用。例如:卫应亮等[17]制备了一种纳米TiO2-碳纳米管复合膜修饰玻碳电极,采用差分脉冲伏安法同时测定1-NAP和2-NAP,其氧化峰电位相差154 mV,检出限分别为3.5×10-7mol/L和2.3×10-7mol/L。LI等[22]采用一步法制备了铜纳米粒子/氧化石墨烯复合材料修饰电极,并用于2-NAP的检测,最低检测限为5.0 nmol/L。
碳纳米材料具有优异的导电性和电催化性能且价格低廉,然而修饰到电极表面容易发生团聚或者脱落,会使稳定性变差。若采用聚合物覆盖在纳米碳材料表面,可防止脱落,提高稳定性。L-半胱氨酸分子中含有氮原子,可与萘酚中酚羟基的氢形成氢键,能更好地吸附萘酚小分子。另外,L-半胱氨酸分子结构中含有氨基、羧基等多种活性基团,采用电化学聚合法制得的修饰电极具有三维立体的空间结构,为多分子层电极,可以为电极表面提供更多的活性位点,电化学响应信号也就更大。此外,采用电化学法制得的聚合膜修饰电极在实际应用中还表现出较好的稳定性和重现性以及较强的抗干扰和抗污染能力。
基于这种考虑,本工作采用滴涂法,将具有良好电化学性能的氧化石墨烯(GO)修饰于玻碳电极(GCE)表面,形成GO/GCE界面,然后再用电化学聚合法将L-半胱氨酸(L-Cys)聚合固定于GO/GCE表面,制得聚L-半胱氨酸/氧化石墨烯修饰电极(PL-Cys/GO/GCE),采用循环伏安法(CV)和差分脉冲伏安法(DPV)研究了萘酚同分异构体在该修饰电极上的电化学行为。该电化学传感器对萘酚同分异构体的检测表现出了良好的选择性和抗干扰性,并成功应用于实际水样中萘酚的检测。
1实验部分
1.1 主要仪器与试剂
CHI660D电化学工作站(上海辰华仪器有限公司提供);101-2A型电热鼓风干燥箱(天津泰斯特仪器有限公司提供);电子天平(北京赛多利斯科学仪器有限公司提供);KH2200B型超声波清洗器(昆山禾创超声仪器有限公司提供)。
氧化石墨烯(GO),南京吉仓纳米科技有限公司提供;L-半胱氨酸(L-Cys),西格玛化工有限公司提供;1-萘酚(1-NAP)、2-萘酚(2-NAP)、铁氰化钾(K3[Fe(CN)6])、亚铁氰化钾(K4[Fe(CN)6])、氯化钾(KCl)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)和盐酸(HCl),国药集团化学试剂有限公司提供;四溴双酚A、双酚A、邻苯二酚、对苯二酚、间苯二酚和苯酚,阿拉丁公司提供。实验所用试剂均为分析纯或以上,实验过程中所用水都是超纯水。
称取1.0mg氧化石墨烯,加入1.0mL蒸馏水,超声分散30min,得到均匀分散的氧化石墨烯悬浮液。萘酚同分异构体储备液(浓度均为10mmol/L)由无水乙醇配制而成,避光保存待用。不同pH值(6.0,6.5,7.0,7.5,8.0)的0.1mol/LPBS均由0.1mol/L的NaH2PO4溶液和0.1mol/L的Na2HPO4溶液按照所需计算量混合配制而成。整个实验过程均在室温下进行。
1.2 修饰电极制备
将玻碳电极依次用粒径为1.0,0.3,0.05μm的α-Al2O3抛光粉抛光成镜面,并依此用蒸馏水、无水乙醇、蒸馏水超声清洗2min,高纯氮吹干备用。用移液枪准确移取6μL氧化石墨烯悬浮液,滴涂在预处理好的裸玻碳电极上,自然晾干,记作GO/GCE。再将GO/GCE置于含5mmol/LL-Cys单体的0.1mol/L的HCl溶液中,以50mV/s的扫描速率在-0.8~+1.6V电位区间循环伏安扫描10圈。取出后用大量水冲洗修饰电极,去除电极表面未聚合的L-半胱氨酸,于室温下晾干备用,记作PL-Cys/GO/GCE。作为比较,实验还采用如上方法制得PL-Cys/GCE修饰电极。
1.3 电化学测量
实验采用传统的三电极体系,以裸玻碳电极(GCE)或已修饰玻碳电极为工作电极,铂片电极为辅助电极,银-氯化银(Ag/AgCl)电极为参比电极。
在测定过程中,选择pH值为7.5、浓度为0.1mol/L的磷酸缓冲溶液(PBS)作为底液。在每次测定之前,将修饰电极置于空白底液中,扫描范围为0~1.0V,扫描速率为100mV/s,进行循环伏安扫描多圈,直至测量曲线稳定。然后采用循环伏安法(CV)和差分脉冲伏安法(DPV)进行萘酚同分异构体的条件优化或测定,并记录峰电位和峰电流值。差分脉冲伏安法(DPV)电位区间为0~0.8V,静置时间为20s。

图1 20 μmol/L 1-NAP和20 μmol/L 2-NAP的CV曲线Fig.1 CV curves of 20 μmol/L 1-NAP and 20 μmol/L 2-NAP
每次测定后,还要将修饰电极置于空白底液中,循环伏安扫描至无峰,并用水冲洗,以除去电极表面吸附物,更新电极表面,从而保证修饰电极具有良好的重现性。
2结果与讨论
2.1 萘酚同分异构体在修饰电极上的电化学行为研究
图1为1-NAP和2-NAP的混合溶液(浓度均为20μmol/L)分别在GCE,PL-Cys/GCE和PL-Cys/GO/GCE电极上的循环伏安曲线。CV曲线中只显示出了氧化峰而无还原峰出现,说明萘酚在修饰电极上的电化学行为是非可逆的。在裸电极上(见曲线a),1-NAP和2-NAP的出峰电位为0.453V和0.607V,峰电位差为154mV,2个氧化峰宽而弱且峰电流也较小。而在PL-Cys/GCE修饰电极上(见曲线b),1-NAP和2-NAP的氧化峰电位负移且峰电流较裸电极增大,说明聚L-半胱氨酸膜有效促进了1-NAP和2-NAP的电化学氧化过程,促进了电子传递速率。在PL-Cys/GO复合膜修饰电极上(见曲线c),得到2个峰形良好的尖锐强峰,峰电流与裸电极相比增大了约4倍,与PL-Cys/GCE相比增大了1倍。1-NAP和2-NAP的氧化峰电位分别为0.411 V和0.593 V,峰电位差为0.182 V,表明PL-Cys/GO复合膜修饰电极具有良好的电催化作用。主要原因有以下2个方面:1)GO由于比表面积大、电子传递能力优良等优点[23],加速了电极-溶液界面的电子传递速率;2)电聚合形成的氨基酸薄膜PL-Cys稳定,一方面可将GO嵌在电极表面,防止脱落;另一方面聚L-半胱氨酸中含有氨基、羧基等活性基团,修饰到电极表面后可使其活性位点增多,有利于萘酚的吸附和电子转移。通过两者的协同增效作用,使得修饰电极具有优良的导电性,增大了电极表面的有效面积,能基本达到萘酚同分异构体氧化峰的分离。
根据文献[24],笔者认为催化机理如下:聚L-半胱氨酸三维立体的空间结构使电极表面含有较多的反应位点,可与萘酚中酚羟基的氢形成N…H—O氢键,能更好地吸附萘酚小分子,从而破坏了部分萘酚的分子间氢键,使羟基失活,削弱O—H的键能,使得萘酚更易被氧化,氧化电位负移。萘酚异构体中酚羟基位置不同会引起整体分子电荷分布不同,其氧化难易程度就不同,从而导致电子通过N…H—O键的传递速率有所差异。其中1-NAP的电子云密度大于2-NAP,而电子云密度越大的越易氧化。因此,当用修饰电极进行同时扫描时会出现2个电位不同的氧化峰,其中氧化难度较小的1-NAP先被氧化出峰,2-NAP后被氧化出峰,从而使两者的峰电位分离。
2.2 修饰剂用量的影响
实验采用循环伏安法,研究了修饰剂GO滴涂量对1-NAP和2-NAP在复合膜修饰电极上电化学行为的影响。实验表明,随着修饰剂GO用量的增加,二者的氧化峰电流变化趋势一致,均表现为先增大后减小,且峰电位几乎不变,如图2所示。当GO的滴涂量少于6μL时,氧化峰电流随着GO滴涂量的增加而增大。这是因为随着电极表面GO量的增加,电极电阻变小,电子传递速率较快,因此氧化峰电流逐渐增大;而当GO滴涂量大于6μL后,电极表面的GO修饰膜过厚,反而阻碍了电子迁移,导致氧化峰电流逐步减小,GO滴涂量的增多也会使GO发生团聚的概率提高,影响电极的修饰效果。综上所述,实验过程中GO的滴涂量选用6μL。
2.3 L-半胱氨酸聚合圈数的影响
采用循环伏安法,研究了1-NAP和2-NAP氧化峰电流与L-半胱氨酸聚合圈数的关系,如图3所示。当聚合圈数为10圈时,响应峰电流值最大;而当聚合圈数减少或者增多时,其氧化峰电流均降低。这可能是因为:当聚合圈数较少时,电极表面电聚合的L-半胱氨酸膜较薄,从而降低了修饰电极吸附萘酚的能力,进而峰电流值下降;而当扫描圈数过多时,又会使聚L-半胱氨酸在电极表面堆积,导致电极表面的电子传递速度下降,电流响应也会随之降低。由实验可知,当电极在修饰液中循环扫描10圈时,可得到性能良好的聚合物修饰膜。

图2 不同GO滴涂量对20μmol/L1-NAP和20μmol/LNAP在PL-Cys/GO/GCE电极上的影响Fig.2 Effects of the amount of GO on the CV response currents of 20μmol/L 1-NAP and 20μmol/L2-NAP on the PL-Cys/GO/GCE electrode

图3 不同L-半胱氨酸聚合圈数对20μmol/L1-NAP和20μmol/L2-NAP在PL-Cys/GO/GCE电极上的影响Fig.3 Effects of the different cycles of L-cys on the CV response currents of 20μmol/L 1-NAP and 20μmol/L 2-NAP on the PL-Cys/GO/GCE electrode
2.4 支持电解质和 pH值的影响
在1-NAP和2-NAP同时存在条件下,用这种修饰电极分别在柠檬酸-柠檬酸钠、醋酸-醋酸钠、氯化钾以及不同 pH 值的磷酸盐缓冲溶液(0.1 mol/L PBS)中进行CV和DPV扫描。实验结果表明:1-NAP和2-NAP在磷酸盐缓冲溶液(0.1 mol/L PBS,pH值为7.5)中得到的电流响应较灵敏、氧化峰的峰形较好且2个峰基本分离。因此,本实验选用0.1 mol/L,pH 值为7.5的磷酸盐缓冲溶液作为支持电解质溶液。
由于质子参与了萘酚同分异构体的的电化学氧化过程,因此电解质溶液的酸度会对萘酚的电化学行为产生直接影响。实验考察了pH值对1-NAP和2-NAP在修饰电极上的电化学响应变化,见图4。从图4 a)可以看出,1-NAP和2-NAP的氧化峰电流随pH值(6.0,6.5,7.0,7.5,8.0)的变化而变化,且峰电位不断负移。这可能是由于萘酚同分异构体的电化学氧化过程中涉及质子传递,质子的浓度会影响其氧化反应的速率;从图4 b)可以看出,1-NAP和2-NAP的氧化峰电位(E)与pH值(Y)之间还呈现良好线性关系,其线性回归方程式分别为E1=0.832-0.059 8Y,相关系数为0.991;E2=1.02-0.061 6Y,相关系数为0.999。
通过计算可得曲线斜率分别为-0.059 8和-0.061 6,接近于能斯特方程[25]的斜率,说明1-NAP和2-NAP在修饰电极上参与电极反应的质子数等于电子转移数[22]。
综合考虑氧化峰电流的响应和峰电位值,实验选用pH值为7.5作为检测萘酚同分异构体的最佳pH值。
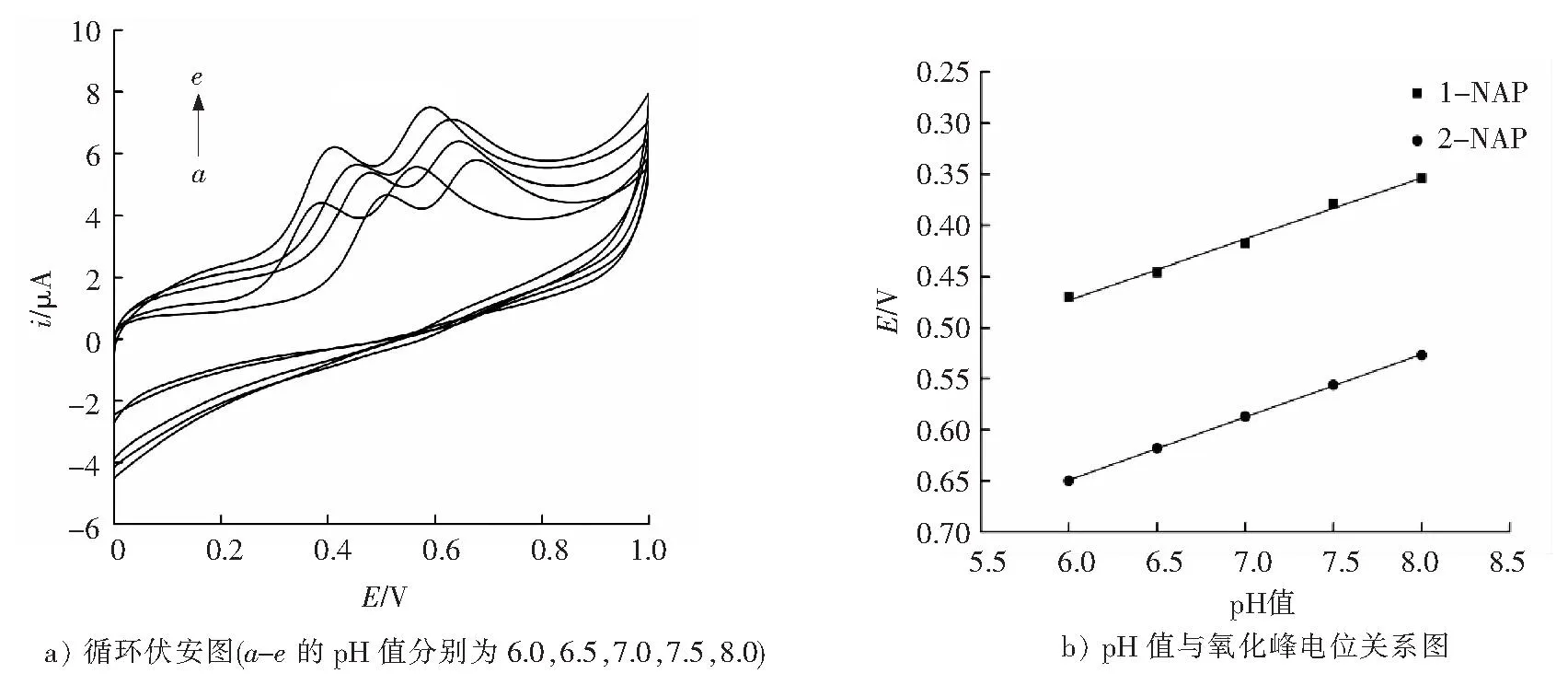
图4 PL-Cys/GO/GCE电极在含20 μmol/L 1-NAP和20 μmol/L 2-NAP的不同pH值的PBS缓冲溶液中的循环伏安图及pH值与氧化峰电位关系图Fig.4 Effects of the pH value of the PBS on the CV response currents of 20 μmol/L 1-NAPand 20 μmol/L 2-NAP on the PL-Cys/GO/GCE electrode and the E-pH plots
2.5 扫描速率的影响
为进一步探讨萘酚的反应机理,还研究了扫描速率与峰电流之间的关系。随着扫描速率的增加,1-NAP和2-NAP的氧化峰电流增加,且峰电位正移。在20~160 mV/s范围内,1-NAP和2-NAP氧化峰电流与扫描速率的平方根成正比,且呈现良好的线性关系。回归方程如下:I1=13.6v1/2-0.719,相关系数为 0.999;I2= 9.73v1/2+0.886,相关系数为0.996。表明二者在修饰电极表面的电化学过程为扩散控制过程。
2.6 线性范围和检测限
基于PL-Cys/GO/GCE修饰电极对1-NAP和2-NAP电化学氧化有较好的电化学性能,且分离效果较好,可基本实现同一体系中萘酚同分异构体的同时测定。在优化的实验条件下,保持1-NAP和2-NAP混合液中一种物质的浓度不变,改变另一种物质的浓度,对其进行DPV测量,结果如图5所示。

图5 DPV响应图Fig.5 DPV responses
如图5 a)所示,在0.1 mol/L PBS(pH 值为7.5)中,保持10 μmol/L的2-NAP恒定不变,改变1-NAP浓度。1-NAP浓度在2~40 μmol/L范围内与其氧化峰电流呈线性关系,线性回归方程为I1=0.029 5c+0.007 68,线性相关系数为0.997。由图5b)可知,当混合液中1-NAP浓度恒定为10μmol/L时,2-NAP浓度在1~40μmol/L范围内与其氧化峰电流呈线性关系,线性回归方程为I2= 0.042 1c-0.008 62,线性相关系数为0.996。经计算1-NAP和2-NAP的检测限分别为1.9×10-7mol/L和1.2×10-7mol/L。
表1为本实验制备的PL-Cys/GO/GCE修饰电极与其他文献中测定萘酚异构体的结果比较分析。由表1可知,本法用于测定萘酚异构体时,虽然检测范围不大,但对萘酚同分异构体的分离效果良好,检测限较低,更有利于2种异构体物质的同时检测。

表1 各种修饰电极检测1-NAP和2-NAP的比较
注:PAO为聚吖啶橙;β-CD为β-环糊精;PtNPs为铂纳米粒子;GNs为石墨烯;TiO2为二氧化钛;MWCNTs为多壁碳纳米管;CTAB为表面活性剂十六烷基三甲基溴化铵。
2.7 修饰电极的重现性和稳定性
考察了PL-Cys/GO/GCE电极的稳定性,将测试完后的修饰电极于4 ℃保存。3天后,在同样的测试条件下,使用该修饰电极对同样浓度的1-NAP和2-NAP进行检测,其电流响应几乎保持不变。存放1周后,再次进行DPV检测,结果显示该电极对1-NAP和2-NAP的氧化峰电流较初次测定值分别下降了2.2%和2.0%,而氧化峰电位基本不变。放置2周后进行检测,该修饰电极对1-NAP和2-NAP的氧化峰电流衰减3.7%和3.1%。
通过组间、组内试验,还考察了PL-Cys/GO/GCE电极的重现性。同一支修饰电极在含同样浓度的1-NAP和2-NAP(均20 μmol/L)的混合溶液中平行测定5次,其氧化峰电流的RSD值分别为1.2%和1.3%。利用上述修饰方法,同时制备5支PL-Cys/GO/GCE电极,并对上述混合溶液进行平行测定,其氧化峰电流的RSD值分别为2.6%和2.7%。综上所述,该PL-Cys/GO复合膜修饰电极对于萘酚同分异构体的检测具有良好的稳定性和重现性。
2.8 干扰试验

3实际水样测试
为了考察所构建的电化学传感器潜在的适用性,本实验还将其用于实际水样(取自湖水)中对萘酚含量的测定,并进行加标回收实验,结果见表2。由表2可以看出,1-NAP和2-NAP的加标回收率分别为98.9%~101.7%和97.7%~102.1%,表明PL-Cys/GO/GCE修饰电极有望应用于实际水样中1-NAP和2-NAP的同时检测。

表2 实际水样中萘酚的测定
4结语
制备了一种基于氧化石墨烯和聚L-半胱氨酸复合膜修饰电极,该修饰电极对萘酚同分异构体具有较好的电分离作用和电催化活性,为2种异构体的同时检测提供新的方法选择。实验结合DPV分析法,对不同浓度的1-NAP和2-NAP进行检测,通过计算得出1-NAP和2-NAP的检出限分别为1.9×10-7mol/L和1.2×10-7mol/L。与文献报道的用于萘酚同分异构体同时检测的修饰电极相比,该修饰电极具有较好的分离效果,且检测限较低。此外,该方法可用于1-NAP和2-NAP在实际水样中的检测。
参考文献/References:
[1]刘文生, 齐昕, 荣维君, 等. 1-萘酚对小鼠免疫功能的影响[J]. 中华劳动卫生职业病杂志, 2001, 19(6): 463.
LIUWensheng,QIXin,RONGWeijun,etal.Effectof1-naphtholontheimmuneresponsesinmice[J].ChinaAcademicJournalElectronicPublishingHouse, 2001, 19(6): 463.
[2]屈冬冬, 孙力平, 陈旭, 等. 1-萘酚在斑马鱼体内富集规律研究[J]. 安徽农业科学, 2012, 40(20): 10566-10568.
QU Dongdong, SUN Liping, CHEN Xu, et al. Study on the enrichment rules of 1-naphthol in Zebra Fish[J]. Journal of Anhui Agricultural Sciences, 2012,40(20): 10566-10568.
[3]ORTEGA-ALGAR S, RAMOS-MARTOS N, MOLINA-DIAZ A. A flow-through fluorimetric sensing device for determination ofα-naphthol andβ-naphthol mixtures using a partial least-squares multivariate calibration approach[J]. Talanta, 2003,60(2/3):313-323.
[4]SUN Hong, SHEN Ouxi, XU Xiaolin, et al. Carbaryl,1-naphthol and 2-naphthol inhibit the beta-1 thyroid hormone receptor-mediated transcription in vitro[J]. Toxicology, 2008,249(2/3):238-242.
[5]MEEKER J D, BARR D B, SERDAR B, et al. Utility of urinary 1-naphthol and 2-naphthol levels to assess environmental carbaryl and naphthalene exposure in an epidemiology study[J]. Journal of Exposure Science and Environmental Epidemiology, 2006,17(4):314-320.
[6]SMITH C J, WALCOTT C J, HUANG W, et al. Determination of selected monohydroxy metabolites of 2-, 3- and 4-ring polycyclic aromatic hydrocarbons in urine by solid-phase microextraction and isotope dilution gas chromatography-mass spectrometry[J]. Journal of Chromatography B, 2002, 778(1/2):157-164.
[7]KANAME O, NAOYO K, KENJI M, et al. Sensitive determination of 1- and 2-naphthol in human plasma by HPLC-fluorescence detection with 4-(4,5-diphenyl-1H-imidazol-2-yl) benzoyl chloride as a labeling reagent[J]. Journal of Separation Science, 2009,32(13):2218-2222.
[8]杨彤. 高效液相色谱法同时测定水中的α-萘酚和β-萘酚[J]. 广州化工, 2012, 40(7): 143-144.
YANG Tong.Detection ofα-naphthol andβ-naphthol in water simultaneously with HPLC[J]. Guangzhou Chemical Industry, 2012,40(7):143-144.
[9]王炎, 李宣东. 同时测定α-萘酚和β-萘酚的毛细管区带电泳法[J]. 分析测试学报, 2002,21(6):65-67.
WANG Yan, LI Xuandong. Simultaneous determination ofα-naphthol andβ-naphthol by capillary zone electrophoresis[J]. Journal of Instrumental Analysis, 2002,21(6):65-67.
[10]康明芹, 李爱军, 牟峻, 等. 高效液相色谱-串联质谱法同时测定染发剂中的1-萘酚和2-萘酚[J]. 理化检验(化学分册), 2014, 50(2): 187-190.
KANG Mingqin, LI Aijun, MOU Jun, et al. Simultaneous determination of 1-naphthol and 2-naphthol in hair dye by HPLC-MS/MS[J]. Physical Testing and Chemical Analysis (Chemical Analgsis), 2014,50(2):187-190.
[11]ZHOU Chun, WANG Qionge, ZHUANG Huisheng, et al. Simultaneous determination of 1-naphthol and 2-naphthol in water by spectrofluorimetry[J]. Spectroscopy and Spectral Analysis, 2008,28(11): 2628-2630.
[12]LI Xiaokun, LIU Dianjun, WANG Zhenxin. Highly selective recognition of naphthol isomers based on the fluorescence dye-incorporated SH-β-cyclodextrin functionalized gold nanoparticles[J]. Biosensors and Bioelectronics, 2011, 26(5): 2329-2333.
[13]PENALVA J,PUCHADES R, MAQUIEIRA A, et al. Development of immunosensors for the analysis of 1-naphthol in organic media[J]. Biosensors and Bioelectronics, 2000,15(3/4):99-106.
[14]ZHANG Yan, ZHUANG Huisheng. Poly (acridine orange) film modified electrode for the determination 1-naphthol in the presence of 2-naphthol[J]. Electrochimica Acta, 2009,54 :7364-7369.
[15]ZHU Gangbing, GAI Pengbo, WU Liang, et al.β-cyclodextrin-platinum nanoparticles/graphene nanohybrids: enhanced sensitivity for electrochemical detection of naphthol isomers[J]. Chemistry Asian Journal, 2012, 7(4):732-737.
[16]ZHU Gangbing, GAI Pengbo, YANG Yan, et al. Electrochemical sensor for naphthols based on gold nanoparticles/hollow nitrogen-doped carbon microsphere hybrids functionalized with SH-β-cyclodextrin[J]. Analytica Chimica Acta, 2012, 723:33-38.
[17]卫应亮, 邵晨, 韩华峰, 等. 纳米TiO2-碳纳米管复合膜修饰电极伏安法测定水中α-萘酚和β-萘酚[J]. 环境监测管理与术, 2009, 21(4): 36-39.
WEI Yingliang, SHAO Chen, HAN Huafeng, et al. Voltammetric determination ofα-naphthol andβ-naphthol by a nano-TiO2/MWCNTs composite film modified glassy carbon electrode[J].The Administration and Technique of Environmental Monitoring, 2009,21(4):36-39.
[18]王晓岗, 吴庆生, 丁亚平, 等. Pt/MWCNT/GC修饰电极对萘酚体系的测定应用[J]. 同济大学学报(自然科学版), 2008, 36(2): 207-211.
WANG Xiaogang, WU Qingsheng, DING Yaping, et al. Pt/MWCNT/GC modified electrode and its application to determination of naphthol isomers[J]. Journal of Tongji University(Natural Science), 2008, 36(2):207-211.
[19]张建辉, 王艺娟, 刘玉玲, 等. 基于聚硫堇/碳纳米管修饰萘酚电化学传感器的研究[J]. 化学与生物工程, 2014, 31(10): 54-57.
ZHANG Jianhui, WANG Yijuan, LIU Yuling, et al. Study on naphthol electrochemical sensor modified by polythionine/carbon nanotubes[J]. Chemistry & Bioengineering, 2014, 31(10): 54-57.
[20]王晓岗, 刘往专, 吴庆生,等. 表面活性剂增强下萘酚异构体的电化学快速测定[J].应用化学, 2007, 24(9): 996-999.
WANG Xiaogang, LIU Wangzhuan, WU Qingsheng, et al. Simultaneous determination of naphthol isomers under the enhancement of surfactant with electrochemical method[J]. Chinese Journal of Applied Chemistry, 2007,24(9):996-999.
[21]潘林娜, 崔皓, 安浩, 等. 导电高聚物/纳米金属复合电极对水中硝酸盐类污染物的去除研究[J]. 广东化工, 2013, 40(10): 60-61.
PAN Linna, CUI Hao, AN Hao, et al. Preparation of conducting polymer/nanometal electrode for the electrochemical removal of nitrate[J]. Guangdong Chemical Industry,2013, 40(10):60-61.
[22]LI Junhua, LI Jun, FENG Haibo, et al. A facile one-step in situ synthesis of copper nanostructures/grapheme oxide as an efficient electrocatalyst for 2-naphthol sensing application[J]. Electrochimica Acta, 2015,153:352-360.
[23]赵海艳, 王贝贝, 李敏锐, 等. 基于还原氧化石墨烯/普鲁士蓝-壳聚糖纳米复合物的高灵敏葡萄糖生物传感器研究[J]. 河北科技大学学报, 2014,35(3):237-241.
ZHAO Haiyan, WANG Beibei, LI Minrui, et al. Study of high sensitive glucose biosensor based on reduced graphene oxide/Prussian blue-chitosan nanocomposite[J]. Journal of Hebei University of Science and Technology, 2014,35(3):237-241.
[24]赵国华, 李宏旭, 李明芳,等. 酚类污染物与L-Cys间的作用机理和电子传递[J]. 同济大学学报(自然科学版), 2006, 34(8): 1111-1116.
ZHAO Guohua, LI Hongxu, LI Mingfang, et al. Mechanism of interaction and electron transfer between phenolic pollutants andL-cysteine[J].Journal of Tongji University (Natural Science),2006,34(8):1111-1116.
[25]BARD A J, FAULKNER L. Electrochemical Methods: Fundamentals and Applications [M]. New York: Wiley,1982.
REN Jujie, LI Liujia, CUI Min, et al.Construction and application of electrochemical sensors for the detection of naphthol[J].Journal of Hebei University of Science and Technology,2016,37(1):39-46.
Construction and application of electrochemical sensors for the detection of naphthol
REN Jujie1, LI Liujia1, CUI Min1, ZHAI Miao1, YU Congcong1, JI Xueping2
(1. School of Science, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2. Basic Medical College, Hebei Medical University, Shijiazhuang, Hebei 050017, China)
Abstract:A poly(L-cysteine)/graphene oxide composite modified glassy carbon naphthol electrode is constructed, which is used for simultaneous determination of 1-naphthol (1-NAP) and 2-naphthol (2-NAP). The electrochemical behavior of 1-NAP and 2-NAP on the modified electrode are investigated by cyclic voltammetry (CV) and differential pulse voltammetry (DPV), and the conditions to modify the electrode and to detect naphthol isomers are optimized. The results show that the modified electrode has an excellent electrocatalytic activity in the oxidation of the naphthol in phosphate buffered solution of 0.1 mol/L PBS (pH 7.5). The difference of oxidation peak potential between 1-naphthol and 2-naphthol could reach 0.182 V, which is almost large enough to achieve the simultaneous detection for 1-naphthol and 2-naphthol in a mixture solution. Under optimized experimental conditions, differential pulse voltammetry is adopted to detect naphthol isomer. It is found that the oxidation peak currents of 1-NAP and 2-NAP show a good linear relationship with the concentration in the range of 2~40 μmol/L and 1~40 μmol/L, respectively. The detection limits (S/N=3) for 1-NAP and 2-NAP are 0.19 μmol/L and 0.12 μmol/L, respectively. The modified electrode shows good stability and reproducibility and has strong anti-interference ability in the detection. The electrode is applied to determine 1-NAP and 2-NAP in real water samples, and the average recoveries are in the range of 98.9% to 101.7% and 97.7% to 102.1%, respectively.
Keywords:electroanalytical chemistry; naphthol; electrochemical sensor; poly(L-cysteine); graphene oxide
作者简介:任聚杰(1963—),男,河北石家庄人,教授,博士,主要从事电化学分析方面的研究。
基金项目:河北省教育厅科研项目(ZH2012078)
收稿日期:2015-08-06;修回日期:2015-09-25;责任编辑:张士莹
中图分类号:O657.1
文献标志码:A
doi:10.7535/hbkd.2016yx01007
文章编号:1008-1542(2016)01-0039-08
