柠檬酸对枸杞响应盐碱胁迫的影响
2016-03-02刘阳阳李玉龙罗桂花王慧春刘小京徐进
刘阳阳,李玉龙,罗桂花,王慧春,刘小京,徐进*
(1.青海师范大学生命与地理科学学院, 青海 西宁810008; 2.中国科学院西双版纳热带植物园, 云南 西双版纳 666100;
3.中国科学院遗传与发育生物学研究所农业资源研究中心, 河北 石家庄 050000)
柠檬酸对枸杞响应盐碱胁迫的影响
刘阳阳1,2,李玉龙3,罗桂花1*,王慧春1,刘小京3,徐进1,2*
(1.青海师范大学生命与地理科学学院, 青海 西宁810008; 2.中国科学院西双版纳热带植物园, 云南 西双版纳 666100;
3.中国科学院遗传与发育生物学研究所农业资源研究中心, 河北 石家庄 050000)
摘要:研究选用枸杞品种海杞为材料,旨在分析柠檬酸浸泡后枸杞在盐、碱胁迫下的抗氧化特征。本实验通过提前浸泡柠檬酸后检测盐碱胁迫下SOD、CAT、POD、APX的活性,MDA、可溶性糖类、可溶性蛋白的含量,得到以下结果:柠檬酸浸泡缓解了盐胁迫对枸杞造成的膜伤害,同时提高了SOD、CAT、POD酶的活性,使枸杞保持较高的活性氧清除能力;但是,柠檬酸浸泡并没有缓解碱胁迫对枸杞造成的膜伤害,对MDA含量无显著影响,但显著降低了枸杞SOD活性(1d)和CAT活性(3d)、提高了枸杞可溶性蛋白和可溶性糖含量,有利于调节枸杞渗透势平衡。实验表明,外源施加柠檬酸可帮助枸杞缓解盐碱胁迫,提高耐受能力。
关键词:枸杞;柠檬酸;盐胁迫;碱胁迫;酶活性;渗透调节
土壤盐碱化是影响全球农业生产和生态环境的严重问题,也是影响植物生长发育较为严重的环境胁迫之一。全球盐碱化土壤面积约9.54亿hm2,约占全球可耕地面积的10% 。其中中国就有0.2亿hm2之多,主要分布于东北、华北、西北内陆地区以及长江以北沿海地带[1]。枸杞属于盐生植物,具有抗旱耐盐碱、耐寒耐瘠薄等特点。并且经过多年种植后耐盐性提高,有其自身的特殊机制[2]。其主要分布于西北地区的宁夏、内蒙古、新疆等地。这些地区由于大面积的盐荒地和近些年土壤次生盐碱化的日益严重,使枸杞成为改良当地盐碱地的主要经济林木。然而,多年来人们对枸杞的研究主要集中在栽培、育种、中药成分分析及临床应用方面[3]。但目前对其响应盐、碱胁迫的生理和分子机制的研究,罕见报道。据研究,盐胁迫下,植物的离子吸收、相容性物质、抗氧化酶、植物激素、光合作用[4]、可溶性物质含量都有变化[5];枸杞光合作用也会被抑制[6](外源施加甜菜碱后会改善这一情况[7]);除此之外, SOD 会活性下降,脂质过氧化作用加强,膜透性增加,细胞内的电解质和紫外吸收物质大量外渗,细胞器破坏,甚至整个细胞结构崩溃[8]。碱胁迫下,植物幼苗的生长以及光合作用和抗氧化作用也发生了变化[9];植物会产生各种次生代谢产物使植物适应逆境环境,保护植物中群的延续性,例如多酚[10]。然而,对枸杞抗逆性的研究相对较少。本实验以枸杞为材料,研究柠檬酸对枸杞应对盐碱胁迫时的影响,进一步研究植物对盐碱胁迫的机理,并为植物修复技术的实际应用提供理论基础。
1材料与方法
1.1 实验材料
本研究以海杞为实验材料,由中科院南皮农业生态试验站提供。海杞是中科院南皮农业生态试验站经过6年选育出的枸杞优良品种,在滨海重盐碱地生长和结果良好,并可丰产稳产。二年生株产鲜果1.03 kg,每公顷产5 129.4 kg,三年生株产鲜果1.86 kg,每公顷产9 294 kg。 该品种果个较大,整齐度高,品质优良,枸杞多糖含量高,药用价值高,连续结果能力强,抗裂果,丰产稳产,且抗逆性强,耐盐碱,耐旱涝,且抗逆性强,适宜滨海盐碱区和近滨海低平原区生长。
1.2 实验设计
从中科院南皮农业生态试验站挑选生长状况相近的海杞枝条,挑选粗细相近的枝段(直径3.5~5 mm)剪裁成15 cm长的枝条,据顶端1 cm处留一个完整的侧芽。然后放入自来水中,21 d后开始长新芽,取生长状况相近的新芽,剪下放入IAA浓度为0.5 mg·L-1的自来水中催根,待生根后进入盐浓度梯度和时间梯度的处理。盐处理设4个浓度梯度[11](0、50、100和150 mmol·L-1NaCl)处理5 d取样(分别取根和叶)。盐处理设4个时间梯度(0、1、5和10 d,100 mmol·L-1NaCl),以上每个处理重复3次。测定株高,根长,叶绿素含量,SOD,POD,CAT,APX,等酶活指标[12]。碱处理设4个浓度梯度[13](0、30、60和90 mmol·L-1NaHCO3)处理5 d取样;碱处理设4个时间梯度(0、1、5 d和10 d,60 mmol·L-1NaHCO3)。以上每个处理重复3次。取样后分别测定根和叶中的抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、丙二醛(MDA)、可溶性糖(soluble sugar)及脯氨酸(pro)的含量[14]。
1.3 测量指标
1.3.1柠檬酸浸泡对枸杞对盐碱胁迫响应的影响
准备的枸杞材料分为两部分,一部分不做任何处理作为对照,另一部分根部浸泡在0.5 mmol·L-1柠檬酸溶液中2 h后,用蒸馏水冲洗3遍,然后分别进行盐胁迫处理。实验浓度选定为NaCl 100 mmol·L-1、NaHCO360 mmol·L-1,处理1 d、3 d收苗。每个处理重复3次。取样后分别测定根和叶中的抗坏血酸过氧化物酶(APX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、丙二醛(MDA)、可溶性糖(soluble sugar)及可溶性蛋白(soluble protein)的含量。
1.3.2测量方法
SOD活性测定方法:超氧化物歧化酶(superoxidedismutase,SOD)测定方法依据超氧化物歧化酶抑制氮蓝四唑(NBT)光氧化还原的50%酶量为1个活力单位,采用王爱国等的方法[15]。
CAT活性测定方法:H2O2在240 nm波长下有强烈吸收,过氧化氢酶(CAT)能分解过氧化氢,使反应溶液吸光度(A240)随反应时间而降低。根据测量吸光率的变化速度即可测出过氧化氢酶的活性[16]。
APX活性测定方法:利用APX在H2O2存在的条件下使抗坏血酸量减少的原理测定酶活性[17,18]。
POD活性测定方法:在有过氧化氢的存在下,POD能使愈创木酚氧化,生成茶褐色物质,该物质在470 nm处有最大吸收,可用分光光度计测量470 nm的吸光度变化测定POD酶活性。
MDA含量的测定:MDA是常用的膜脂过氧化指标[19],在酸性和高温条件下,可以与硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3,5,5-三甲基恶唑2,4-二酮),其最大吸收波长在532 nm。
可溶性糖含量测定方法是在485 nm波长下进行比色测量。
可溶性蛋白含量测定方法:考马斯亮蓝G-250测定蛋白质含量。
数据整理和分析: 采用SPSS16.0统计软件进行分析处理,显著性分析采用LSD检验法(P<0.05),采用Microsoft Excel 2003 软件作图。
2结果与分析
2.1 柠檬酸对盐胁迫条件下枸杞生理生化的影响
2.1.1柠檬酸对盐胁迫条件下枸杞生理生化的影响
盐处理会使枸杞MDA的含量呈上升趋势。盐处理1 d时,是否进行柠檬酸浸泡对枸杞MDA含量影响不大(前者为后者的98.8%);盐处理(s)3 d时,经柠檬酸浸泡(c)的枸杞MDA含量要显著少于未经柠檬酸浸泡的枸杞(为后者的81.3%)(图1)。说明在盐处理1 d时,两组枸杞都受到几乎相同水平的膜伤害,但在盐处理3 d时,柠檬酸浸泡的枸杞膜伤害水平明显低于未经柠檬酸浸泡的枸杞,表明柠檬酸对盐胁迫有一定的缓解作用。
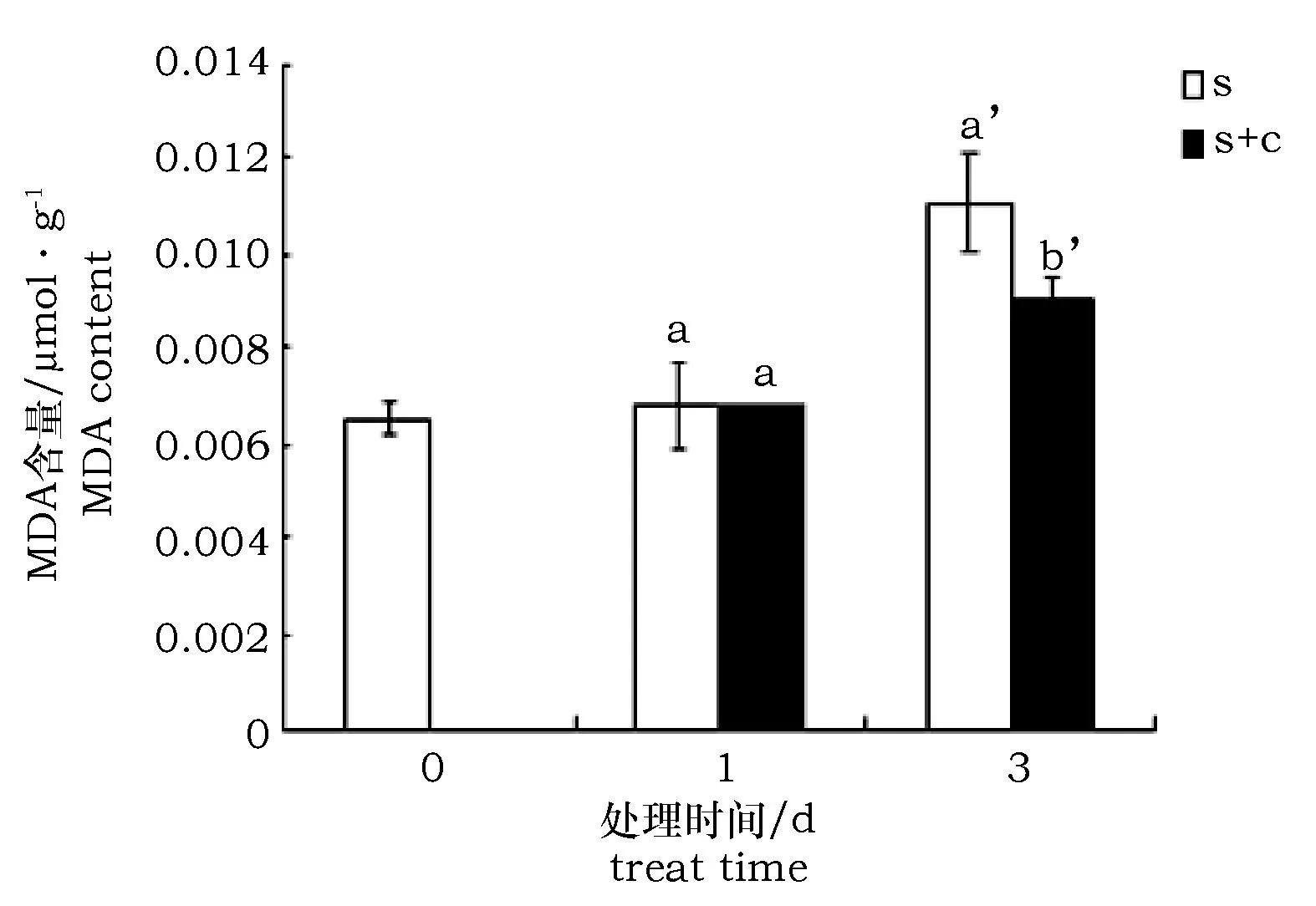
图1 柠檬酸对盐胁迫条件下枸杞MDA含量变化的影响Fig.1 MDA content under salt stress with citric acid treatment
2.1.2柠檬酸对盐胁迫条件下枸杞抗氧化酶系统响应的影响
盐处理后,SOD活性呈现先上升后下降的趋势(1天时明显上调,3天时有恢复)。但经过柠檬酸浸泡后,虽然在1天时,SOD活性有所下降(约为后者的81.2%),但3天时,经柠檬酸浸泡的枸杞相对于未经柠檬酸浸泡的枸杞其活性显著上升(约为后者的129.7%)(图2a),说明柠檬酸浸泡会使SOD持续上调。盐处理后,枸杞CAT活性呈先升高后下降趋势,而无论在盐处理1天还是3天时,经柠檬酸浸泡的枸杞CAT活性都显著高于未经柠檬酸浸泡的枸杞(分别约为后者的184.8%,247.5%)(图2b)。
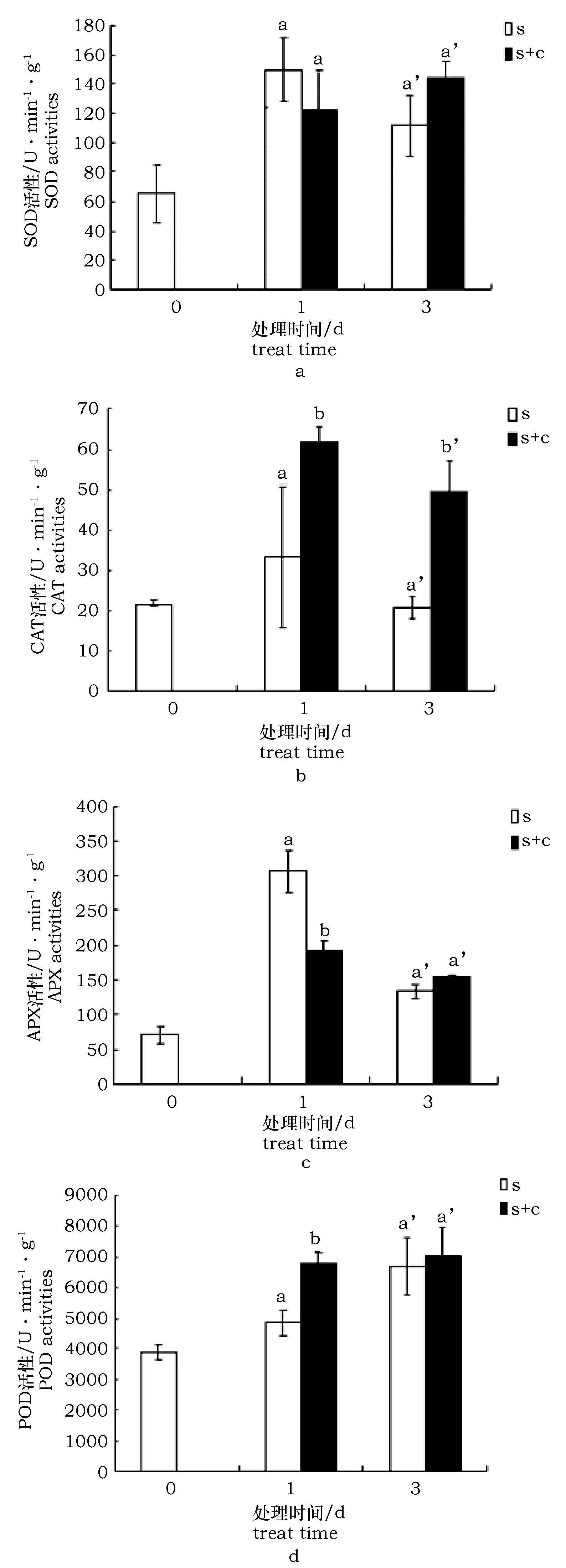
图2 柠檬酸对盐胁迫条件下枸杞抗氧化酶活性变化的影响Fig.2 Antioxidant enzyme activities under salt stress with citric acid treatme
盐处理后,枸杞APX活性也呈现先升高后下降趋势,1 d时,经柠檬酸浸泡的枸杞APX活性显著低于未经柠檬酸浸泡的枸杞(约为后者的62.5%),而在盐处理3 d时,无显著差异(约为后者的114.3%)(图2c)。
盐处理后,枸杞POD活性呈上升趋势,而在盐处理1 d时,经柠檬酸浸泡的枸杞POD活性显著高于未经柠檬酸浸泡的枸杞(约为后者的140.0%),3 d时,虽然上调,但差异不明显(图2d)。
2.1.3柠檬酸对盐胁迫条件下枸杞可溶性蛋白含量变化的影响
盐处理下,枸杞中可溶性蛋白质的含量呈现先上升再下降的趋势,甚至在3 d时,其水平低于未经任何处理时的水平。1 d时,柠檬酸浸泡的枸杞可溶性蛋白含量显著少于未经柠檬酸浸泡的枸杞(约为后者的65.8%),但与未经任何处理时相比,差异不大;盐处理3 d时,柠檬酸浸泡的枸杞可溶性蛋白含量多于未经柠檬酸浸泡的枸杞,说明柠檬酸可以使枸杞在盐胁迫下的可溶性蛋白含量持续上升(图3)。
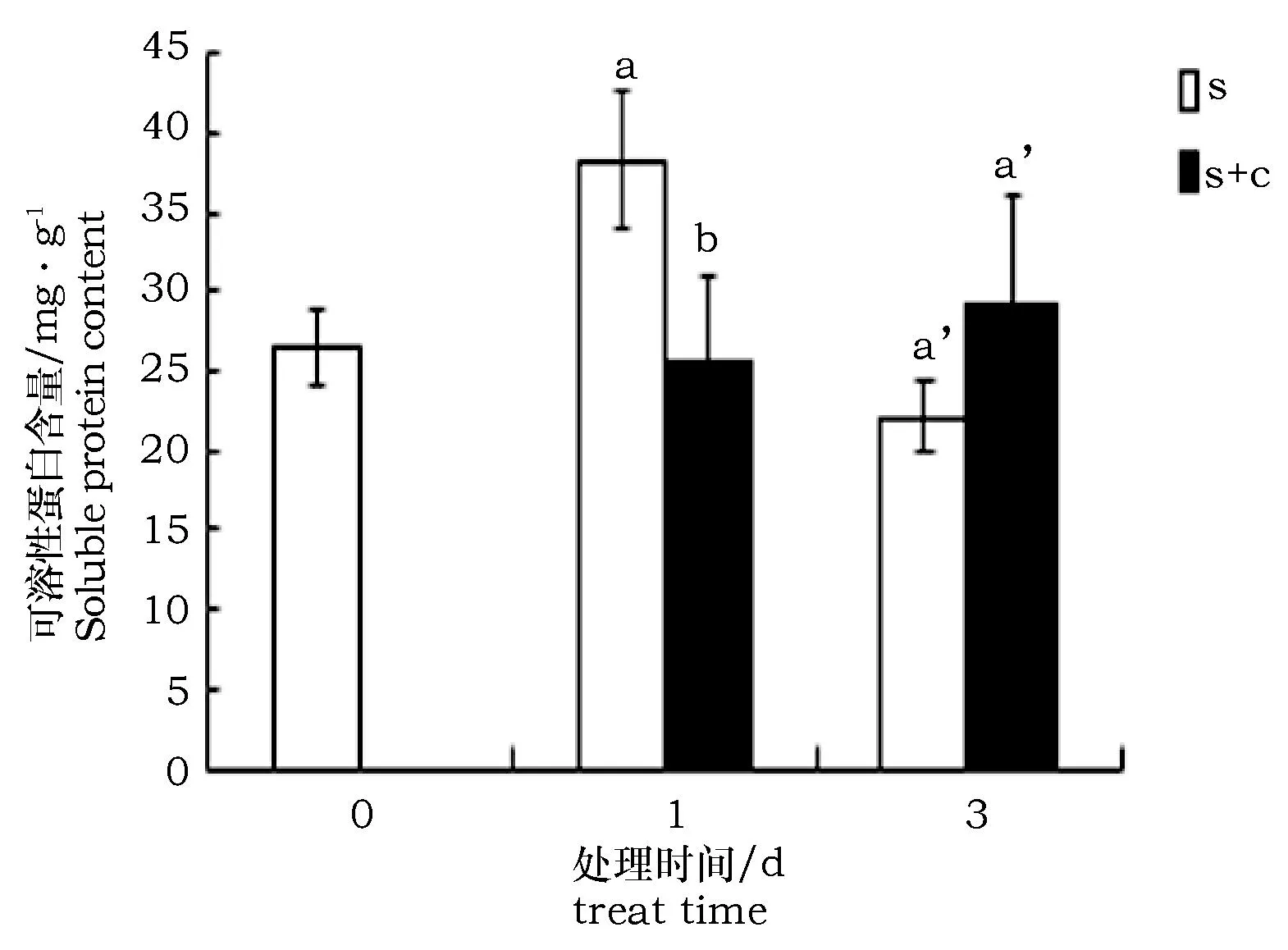
图3 柠檬酸对盐胁迫条件下枸杞可溶性蛋白含量变化的影响Fig.3 Soluble protein content under salt stress with citric acid treatment
2.1.4柠檬酸对盐胁迫条件下枸杞可溶性糖含量变化的影响
盐处理1 d时,柠檬酸浸泡的枸杞可溶性糖含量显著少于未经柠檬酸浸泡的枸杞(约为后者的66.3%);而在盐处理3 d时,两组无显著性差异(约为后者的111.0%)(图4)。
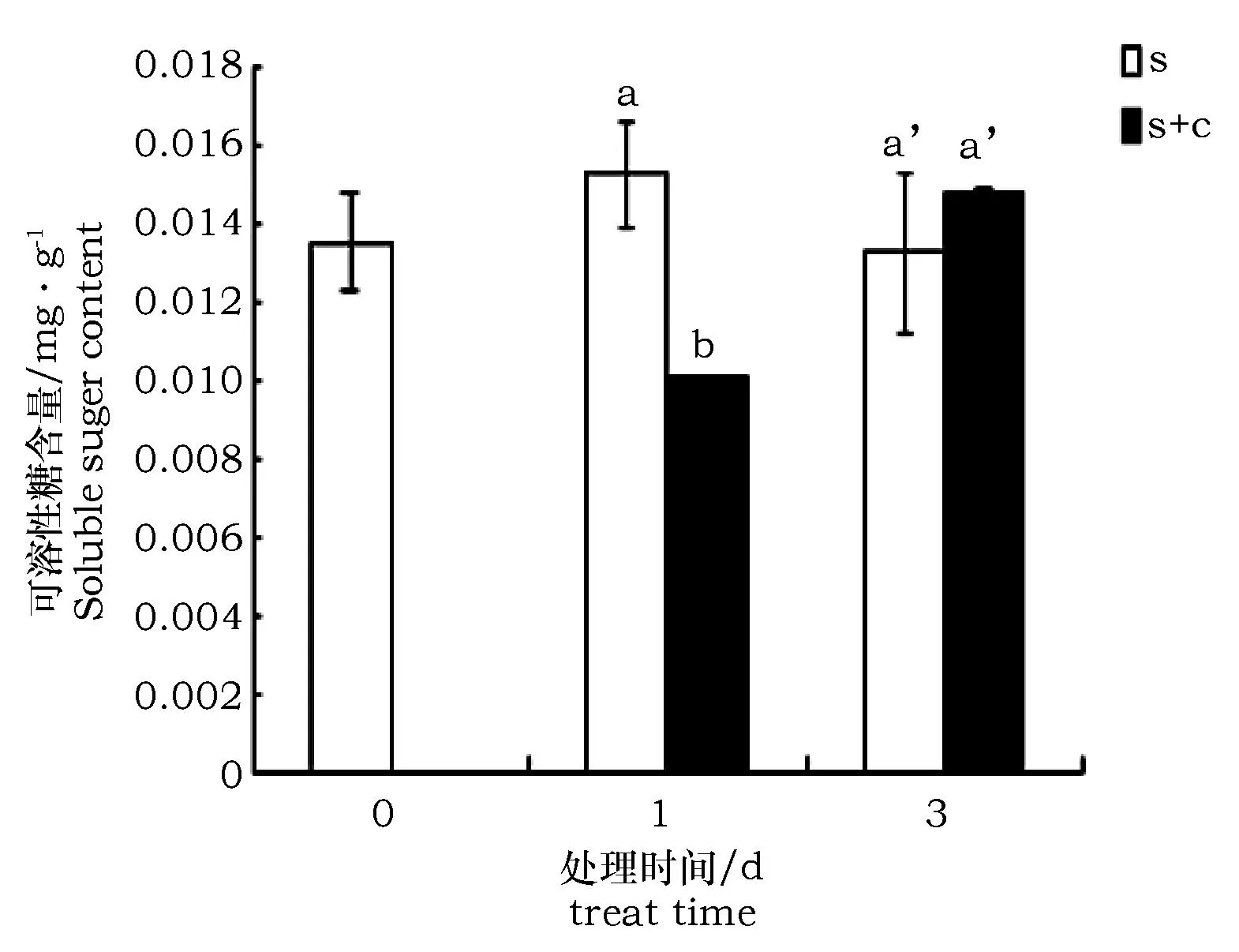
图4 柠檬酸对盐胁迫条件下枸杞可溶性糖含量变化的影响Fig.4 Soluble sugar content under salt stress with citric acid treatment
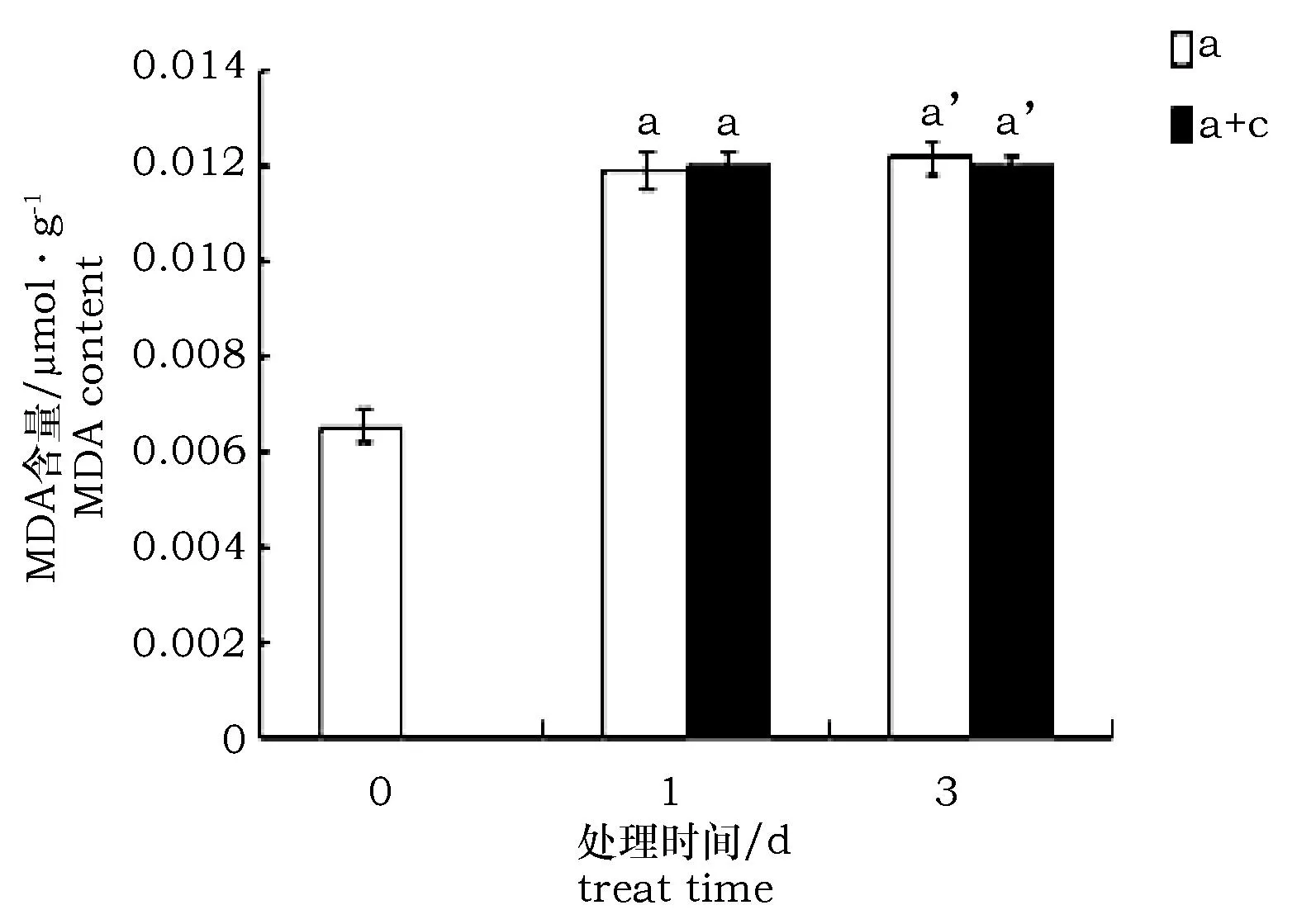
图5 柠檬酸对碱胁迫条件下枸杞MDA含量变化的影响Fig.5 MDA content under alkali stress with citric acid treatment
2.2 柠檬酸对碱胁迫条件下枸杞生理生化的影响
2.2.1柠檬酸对碱胁迫条件下枸杞氧化伤害的程度的影响
无论在碱处理1 d还是3 d情况下,柠檬酸浸泡的枸杞与未经柠檬酸浸泡的枸杞MDA含量无显著差异,且都显著高于对照(图5)。说明在碱胁迫条件下,枸杞受到了严重的膜伤害,而柠檬酸浸泡并没有缓解碱胁迫对枸杞造成的伤害。
2.2.2柠檬酸对碱胁迫条件下枸杞抗氧化酶系统响应的影响
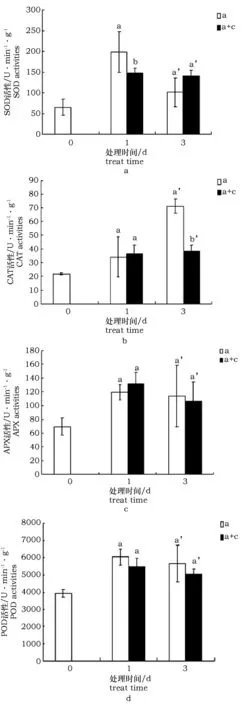
图6 柠檬酸对碱胁迫条件下枸杞抗氧化酶活性变化的影响Fig.5 Antioxidant enzyme activities under alkali stress with citric acid treatment
未经柠檬酸浸泡的枸杞SOD活性先显著上升后显著下降,在碱处理1 d时,柠檬酸浸泡的枸杞SOD活性显著低于未经柠檬酸浸泡的枸杞(约为后者的73.7%),碱处理3 d时,有上调,整体来看,柠檬酸浸泡的枸杞SOD活性变化比较平稳,无显著下降趋势(图6a)。两组枸杞CAT活性均随着碱处理的时间延长呈上升趋势,在碱处理3 d时,柠檬酸浸泡的枸杞CAT活性显著低于未经柠檬酸浸泡的枸杞(约为后者的53.5%),柠檬酸浸泡1 d时,两组无显著差异(约为后者的105.9%),甚至3 d时降低了CAT活性(图6b);两组枸杞APX活性均随着碱处理的时间延长呈上升趋势,柠檬酸浸泡后并无显著差异(图6c);两组枸杞POD活性均随着碱处理的时间延长呈上升趋势,柠檬酸浸泡后略微下降,但无显著差异(图6d)。
2.2.3柠檬酸对碱胁迫条件下枸杞可溶性蛋白含量变化的影响
柠檬酸浸泡和未浸泡的两组枸杞可溶性蛋白含量在碱处理3 d时均显著降低,但是柠檬酸浸泡的枸杞在碱处理3天时可溶性蛋白含量显著多于未经柠檬酸浸泡的枸杞(约为后者的266.2%)(图7)。
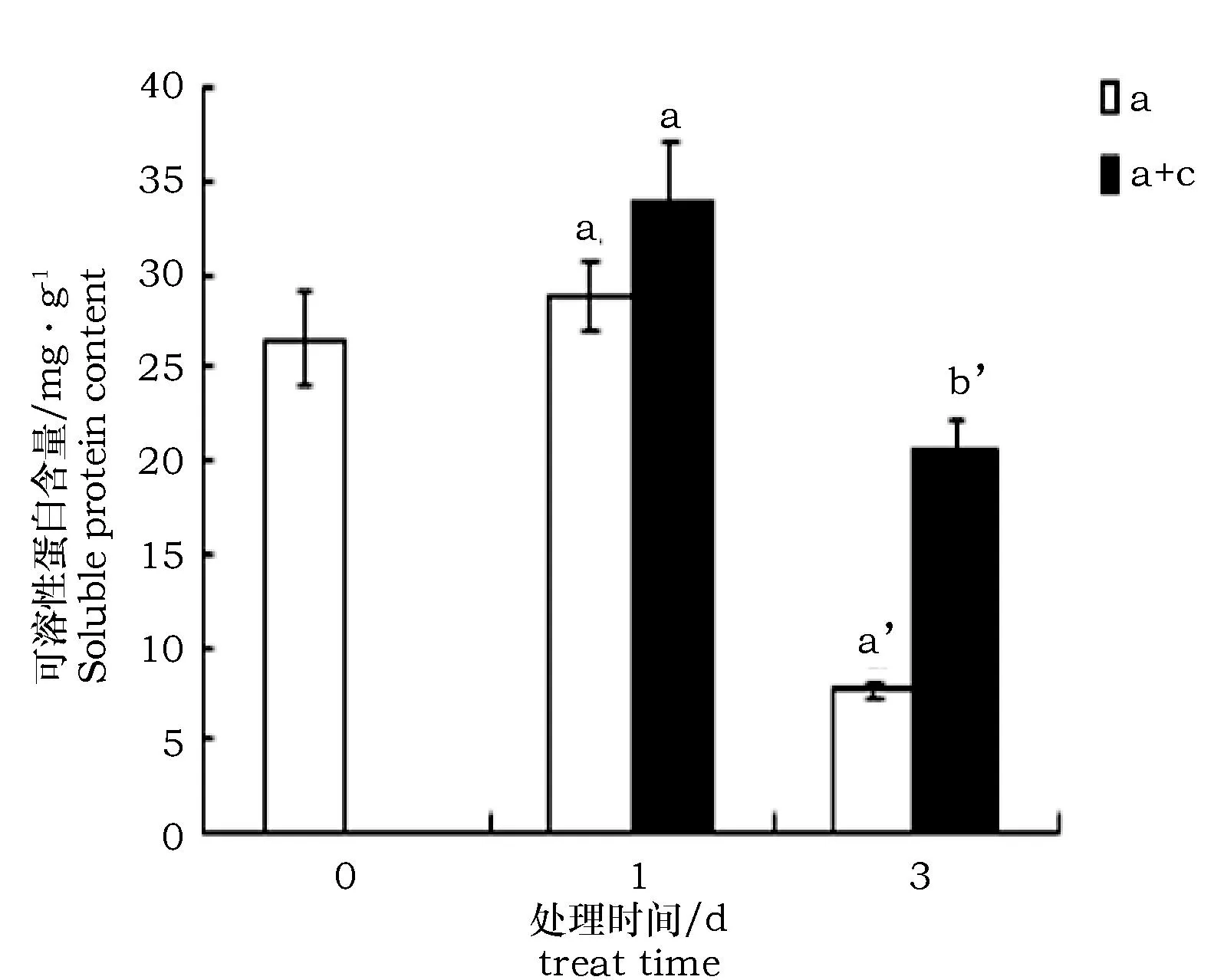
图7 柠檬酸对碱胁迫条件下枸杞可溶性蛋白含量变化的影响Fig.7 Soluble protein content under alkali stress with citric acid treatment
2.2.4柠檬酸对碱胁迫条件下枸杞可溶性糖含量变化的影响
柠檬酸浸泡的枸杞可溶性糖含量略微高于未浸泡的(图8)。
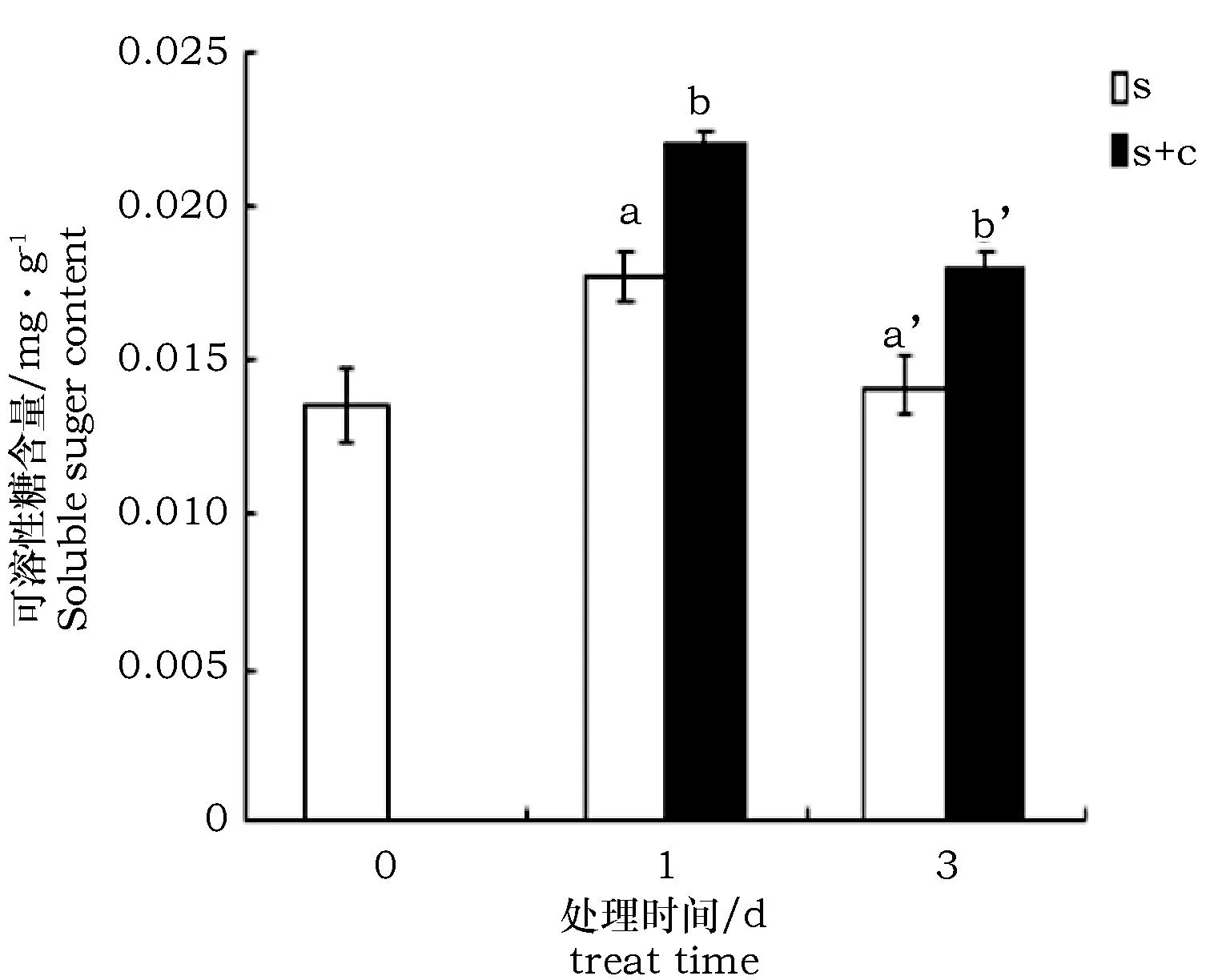
图8 柠檬酸对碱胁迫条件下枸杞可溶性糖含量变化的影响Fig.8 Soluble sugar content under alkali stress with citric acid treatment
3讨论与结论
有机酸是指一些具有酸性的有机化合物。最常见的有机酸是羧酸,其酸性源于羧基 (-COOH),可与醇反应生成酯。植物体内主要含有柠檬酸、苹果酸、草酸、琥珀酸等有机酸。徐进等研究表明用柠檬酸预处理可以提高龙葵叶片中镉的累积量却降低了根中镉的累积量,柠檬酸的生物合成可能和镉的长途运输有关。镉处理的龙葵体内柠檬酸及一些氨基酸的生物合成显著上升,说明这些代谢物参与提高了龙葵镉的累积和耐受性[20]。Tolr等研究发现, 鲁梅克斯(Rumex acetosa L.是一种适应高铝盐土壤植物)对铝的抗性是由于根内产生大量的蒽醌和柠檬酸, 根尖借助柠檬酸泌盐作用排除铝[21]。
柠檬酸浸泡降低了盐胁迫对枸杞造成的膜伤害,同时提高了SOD、CAT、POD酶的活性,以使枸杞保持较高的活性氧清除能力。说明通过柠檬酸浸泡后的枸杞可以保持较高的抗氧化酶水平、即高活性氧的清除能力,来减少盐胁迫对枸杞细胞造成的膜伤害,亦说明柠檬酸浸泡在降低盐胁迫对枸杞的伤害中起到一定的作用。
柠檬酸浸泡的枸杞与未经柠檬酸浸泡的枸杞相比MDA含量无显著差异,并且碱处理1 d时柠檬酸浸泡显著降低了枸杞SOD活性,碱处理3 d时柠檬酸浸泡显著降低了枸杞CAT活性。说明柠檬酸浸泡并没有提高枸杞的抗氧化酶活性,即没有提高枸杞的活性氧清除能力,因此柠檬酸浸泡并没有减轻碱胁迫对枸杞细胞质膜的过氧化伤害。但相对于未经柠檬酸浸泡的枸杞,柠檬酸浸泡显著提高了枸杞可溶性蛋白和可溶性糖含量,可能提高了枸杞调节渗透平衡的能力。
参考文献
[1]牛东玲,王启基.盐碱地治理研究进展[J].土壤通报,2002,33(6):449-450.
[2]惠红霞,许兴,李前荣. NaCl胁迫对枸杞叶片甜菜碱、叶绿素荧光及叶绿素含量的影响[J].干旱地区农业研究,2004,22(3):732-735.
[3]蔺海明,王龙强,贾恢先,等.盐地枸杞不同营养器官中盐离子分布规律[J].果树学报,2006,23(5):732-735.
[4]林栖凤,李冠一. 植物耐盐性研究进展[J]. 生物工程进展, 2000,20(2):20- 25.
[5]刘凤荣,陈火英,刘杨,等.盐胁迫下不同基因型番茄可溶性物质含量的变化[J].植物生理与分子生物学学报,2004,30(1):99-104.
[6]惠红霞,许兴,李守明.盐胁迫抑制枸杞光合作用的可能机理[J].生态学杂志,2004, 23 (1): 5-9.
[7]惠红霞,许兴,李前荣.外源甜菜碱对盐胁迫下枸杞光合功能的改善[J].西北植物学报, 2003,23(12):2137- 2422.
[8]龚明,丁念诚,贺子义,等.盐胁迫下大麦和小麦叶片脂质过氧化伤害与超微结构变化的关系[J].植物学报,1989,31(11): 841-846.
[9]吴成龙,尹金来,徐阳春,等.碱胁迫对菊芋幼苗生长及其光合作用和抗氧化作用的影响[J].西北植物学报,2006,26(3):0447-0454.
[10]徐国前,张振文,郭安鹊,等.植物多酚抗逆生态作用研究进展[J].西北植物学报,2011, 31(2):0423-0430.
[11]罗辉.玉米幼苗对盐胁迫的适应[J].井冈山师范学院学报(自然科学版), 2004,25(5):23-28.
[12]王龙强,蔺海明,肖雯,等.盐地宁夏枸杞生理生化指标及抗盐特性研究[J].甘肃农业大学学报,2004,39(6):611-614.
[13]陈忠林,张学勇,张绵,等. 碱胁迫对结缕草、高羊茅种子萌发及其胚生长的影响[J].种子,2010,29(12).
[14]刘建新,王鑫,王瑞娟,等.碱胁迫对黑麦草幼苗根系活性氧代谢和渗透溶质积累的影响[J]. 植物研究,2011, 31(6):674-679.
[15]郑国琦,许兴,徐兆桢,等. 盐胁迫对枸杞光合作用的气孔与非气孔限制[J].西北植物学报,2002,22(6):1355-1359.
[16]Y Nakano, K Asada. Hydrogen Peroxide is Scavenged by Ascorbate-specific Peroxidase in Spinach Chloroplasts[J]. Plant Cell Physiol. 1981, 22 (5): 867-880.
[17]DR Gossett, EP Millhollon, M Lucas. Antioxidant Response to NaCl Stress in Salt-Tolerant and Salt-Sensitive Cultivars of Cotton[J]. Crop Science,1994, 34(3): 706-714.
[18]Knorzer O.C., Durner J, Boger P. Alteration in the antioxidative system of suspension-cultured soybean cells (Glycine max) induced by oxidative stress[J]. Physiol Plant. 1996, 97: 388-396.
[19]陈贵,胡文玉,谢甫绨,等.提取植物体内MDA的溶剂及MDA作为衰老指标的探讨[J].植物生理学通讯,1991,27(1):44-46.
[20]Xu Jin, Zhu Yiyong, Ge Qing, et al. Comparative physiological responses of Solanum nigrum and Solanum torvum to cadmium stress[J]. New Phytologist. 2012, 196(1): 125-138.
[21]Tolrar P, Poschenrieder C, Luppib, B. Aluminium-induced changes in the profiles of both organic acids and phenolic substances underlie Al tolerance in Rumexacetosa L[J]. Environmental and Experimental Botany,2005, 54(3):231-23.
(编辑:梁文俊)
罗桂花,教授。Tel:13897437200,E-mail:744188682@qq.com
Effect of citric acid on the stress response to saline and alkali ofLyciumbarbarum
Liu Yangyang1,2,Li Yulong3,Luo Guihua1*,Wang Huichun1,Liu Xiaojing3,Xu Jin1,2*
(1.CollageofLifeScienceandGeography,QinghaiNormalUniversity,Xining810008,China; 2.XishuangbannaTropicalBotanicalGarden,ChineseAcademyofScinence,XishuangbannaYunnan666100,China; 3.InstituteofGeneticsandDevelopmentalBiology,ChineseAcademyofScinence,Shijiazhuang050000,China)
Abstract:In this study, HaiLyciumchinensehas been selected to investigate its antioxidant response to salt and alkali stress upon seedlings and the effects of citric acid in this process. After pretreatment with citric acid, SOD, CAT, POD activities, and the content of MDA, soluble protein and soluble sugar were measured. It showed that pretreatment with citric acid relieved membrane damage caused by salinity, and increased SOD, CAT, POD activities; making sure thatLyciumchinensecould maintain high active oxygen scavenging ability under salt stress. However, pretreatment with citric acid did not alleviate the membrane damage caused by alkali stress, for the content of MDA inLyciumchinenseshowed no significance between pretreatment with citric acid and the control. In addition, pretreatment with citric acid significantly reduced SOD activity first day and CAT activity third day; and also up regulated the soluble protein and soluble sugar, which may help to keep osmotic potential balance. It turned out that applied citric acid exogenously could improve the ability of tolerance to saline and alkali stresses inLyciumchinense.
Key words:LyciumChinense; Citric acid; Salt stress; Alkali stress; Enzymes activity; Osmoregulation
中图分类号:S567.1+9
文献标识码:A
文章编号:1671-8151(2016)02-0096-06
通讯作者:*徐进,研究员,硕士生导师。Tel:0871-65140420;E-mail:xujin@xtbg.ac.cn
作者简介:刘阳阳(1992-),女(汉),青海海东人,硕士,研究方向:植物生理
收稿日期:2015-11-03修回日期:2015-12-10
