序贯放化疗后辅助化疗治疗局部晚期鼻咽癌的疗效分析
2016-03-02陈秋燕华洋静玲张纬建陈秀英洪金省
苏 丽, 陈秋燕,华洋静玲, 张纬建, 陈秀英, 洪金省
序贯放化疗后辅助化疗治疗局部晚期鼻咽癌的疗效分析
苏 丽1, 陈秋燕2,华洋静玲3, 张纬建1, 陈秀英1, 洪金省1
目的 评价新辅助化疗(NACT)序贯调强放疗(IMRT)之后的辅助化疗(AC)对局部晚期鼻咽癌的临床疗效。 方法 收集初治的局部晚期鼻咽癌172例,其中NACT+IMRT组94例、NACT+IMRT+AC组78例。应用Kaplan-Meier法评估患者的生存率,Cox回归模型进行多因素分析。 结果 NACT+IMRT组与NACT+IMRT+AC组的3年总生存率(OS)、无进展生存率(PFS)、无复发生存率(RFS)、无远处转移生存率(DMFS)分别为86.66%vs. 84.47%,77.38%vs.75.31%,92.65%vs.86.00%,83.20%vs.88.64%,2组比较差别均无统计学意义(P>0.05)。对于N3及ⅣA期患者,AC延长了无远处转移生存,但是增加了3~4级骨髓抑制及听力下降的发生率(P<0.05)。N分期是DMFS的独立预后因素(P<0.05)。 结论 NACT+IMRT治疗后的AC对局部晚期鼻咽癌患者并没有增加生存获益,反而增加了毒副反应,但它可能有助于降低N3及ⅣA期患者的远处转移风险。
鼻咽癌;调强放射治疗;新辅助化疗;辅助化疗
鼻咽癌是东南亚以及我国华南地区的常见病[1]。放射治疗是鼻咽癌治疗的主要方式,在早期鼻咽癌治疗中取得了令人满意的疗效,放疗后5年总生存率(overall survival,OS)可达90%,但是对于局部晚期鼻咽癌放疗的疗效欠佳[2-3]。随着调强放射治疗(intensity modulated radiationtherapy,IMRT)技术广泛应用于鼻咽癌,其局部控制率已达80%~90%,失败的主要原因是远处转移[4-5]。因此,如何提高局部晚期鼻咽癌患者的疗效,降低远处转移已经成为目前大家关心的重点问题。辅助化疗(adjuvant chemotherapy,AC)目的在于减少远处转移,但它对局部晚期鼻咽癌患者的OS、局部控制及远处转移是否存在获益仍有争议。研究表明,AC可以提高N2~3局部晚期鼻咽癌患者的OS,降低局部复发率[6-8]。然而,也有多项临床研究及Meta分析报道,同步放化疗(concurrent chemoradiotherapy,CCRT)之后增加AC并未提高鼻咽癌患者的生存[9-12]。以上大部分的研究都是基于CCRT之后的AC,而且部分数据来自于常规放疗,但新辅助化疗(neoadjuvant chemotherapy,NACT)序贯IMRT基础上的AC是否可以为局部晚期鼻咽癌带来获益尚不明确。因此,笔者分析了接受IMRT的局部晚期鼻咽癌172例,旨在评估序贯放化疗后的AC对于局部晚期鼻咽癌患者长期生存的价值。
1 对象与方法
1.1 对象 回顾性分析2008年6月-2013年6月笔者医院放疗科收治的鼻咽癌患者172 例。入组标准:(1)经活检病理检查确诊为鼻咽癌;(2)根据2002年国际抗癌联盟(Union for International Cancer Control,UICC)分期诊断标准,Ⅲ~ⅣB期的初治鼻咽癌患者;(3)无远处转移;(4)卡氏评分>70分;(5)无化疗禁忌症;(6)放疗技术为IMRT。其中NACT+IMRT组共有94 例,NACT+IMRT+AC组有78 例。
1.2 放射治疗 采用医用电子直线加速器(Varian 600C/D,美国VARIAN公司)6 MV X线。鼻咽和颈部使用7野调强放射治疗技术同时照射。鼻咽原发灶(GTVnx)和颈部淋巴结转移灶(GTVnd)为MRI平扫+增强扫描所见病灶;临床靶区(CTV)1为高危区,为GTVnx外扩5~10 mm,包括整个鼻咽黏膜及黏膜下0.5 cm;CTV2 为低危区,涵盖CTV1,同时根据肿瘤侵犯位置和范围适当考虑包括鼻腔后部、上颌窦后部、翼腭窝、部分后组筛窦、咽旁间隙、颅底、部分颈椎、斜坡及需要预防照射的颈部淋巴引流区。计划靶区(PTV)在CTV基础上三维方向各外扩3~5 mm。GTVnx、GTVnd、CTV1和CTV2的处方剂量分别为68~76,66~70,60~62和50~56 Gy,每周5次,共30~33次;PTV接受>110%处方剂量体积<10%,接受<93%处方剂量体积<1%,PTV以外任何地方不能出现>110%处方剂量。危及器官限制剂量:50%腮腺体积剂量<30 Gy,最大剂量点限制:脑干≤54 Gy,脊髓≤45 Gy,垂体平均剂量≤50 Gy,晶体≤9 Gy,视神经、视交叉≤54 Gy,颞颌关节≤65 Gy,颞叶≤60 Gy或>65 Gy的体积≤1%。
1.3 化疗 所有患者采用含铂类的化疗方案:(1)NACT:亚叶酸钙100 mg/m2,d1~5+氟尿嘧啶500 mg/m2,d1~5+顺铂25 mg/m2,d1~3,每3周重复;或紫杉醇135 mg/ m2,d1+顺铂25 mg/m2,d1~3,每3周重复,共2周期。(2)AC:与NACT方案相同,均给予2周期。每次化疗前,均给予地塞米松、异丙嗪抗过敏预处理,并予5-羟色胺受体阻断剂止吐治疗。每个疗程化疗前复查血常规、肝肾功能及心电图检查,无化疗禁忌证则进行下个疗程化疗。
1.4 随访 所有患者治疗结束后,3年内每3月复查1次,4~5年每半年复查1次,5年后每1年复查1次。后续评价包括鼻咽部及颈部MRI平扫+增强,电子鼻咽镜检查,胸部CT,腹部超声,EB病毒(EBV)血清学检测,必要时还行全身骨显像(ECT)或者是正电子发射断层扫描CT(PETCT)检查。
1.5 疗效及毒副反应评价 主要观察指标为OS、无远处转移生存率(distant metastasis-free survival,DMFS)、无进展生存率(progress-free survival,PFS)、无复发生存率(recurrence-free survival,RFS);次要观察指标为放射毒性反应。毒副反应评估:每个患者在治疗期间每周进行1次,治疗结束后每3月评估1次。毒性反应评分采用国际常见不良反应标准NCI CTCAE(Common Terminology Criteria for Adverse Events)3.0版评分标准[13]。
1.6 统计学处理 采用SPSS 20.0软件进行统计分析。采用χ2检验比较两组患者的临床特征及毒副反应;使用Kaplan-Meier 法计算生存率,Log-rank检验进行组间差异比较,Cox回归模型进行多因素分析,计算风险比(hazard ratio,HR)及95%可信区间(confidence interval,CI)。P<0.05为差别有统计学意义。
2 结 果
2.1 一般临床特征 172例中,男性128例,女性44例,年龄中位数46岁(19~79岁);根据2002年UICC分期诊断标准,Ⅲ期患者84例(48.84%),ⅣA~B期患者88例(51.16%);其中NACT+IMRT组共94例,NACT+IMRT+AC组共78例。2组的基线特征见表1。
表1 2组患者临床特征比较
Tab 1 Comparison of clinical Characteristics of patients between the two groups
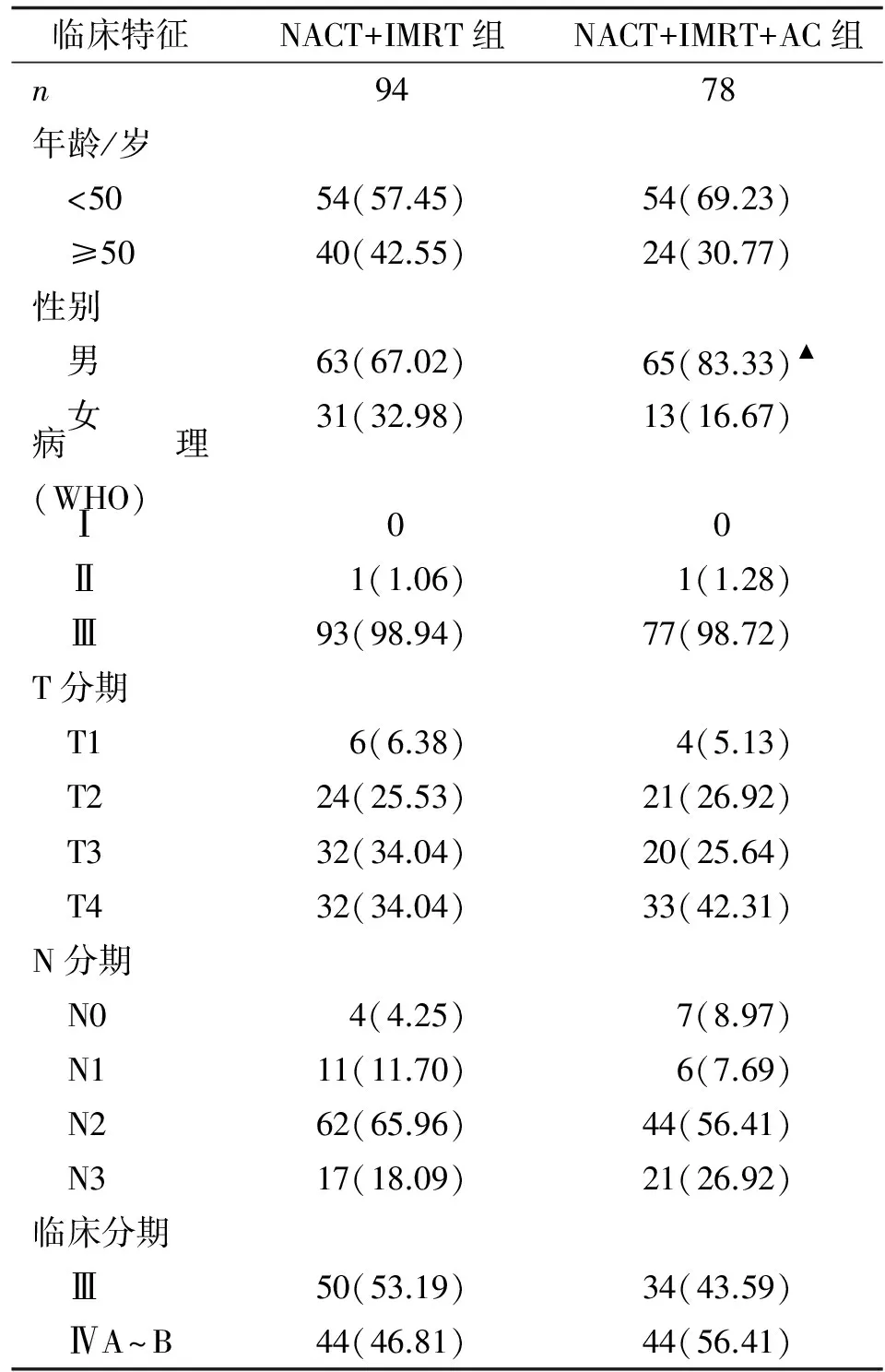
临床特征NACT+IMRT组NACT+IMRT+AC组n9478年龄/岁 <5054(57.45)54(69.23) ≥5040(42.55)24(30.77)性别 男63(67.02)65(83.33)▲ 女31(32.98)13(16.67)病理(WHO) Ⅰ00 Ⅱ1(1.06)1(1.28) Ⅲ93(98.94)77(98.72)T分期 T16(6.38)4(5.13) T224(25.53)21(26.92) T332(34.04)20(25.64) T432(34.04)33(42.31)N分期 N04(4.25)7(8.97) N111(11.70)6(7.69) N262(65.96)44(56.41) N317(18.09)21(26.92)临床分期 Ⅲ50(53.19)34(43.59) ⅣA~B44(46.81)44(56.41)
表中数据为n(%). NACT:新辅助化疗;IMRT:调强放疗;AC:辅助化疗. 与NACT+IMRT组比较,▲:P<0.05.
2.2 生存分析 本组患者随访截止至2016年4月,随访率为91.86%,随访中位时间59.73 月(37.57~93.57月),其中3年OS为85.56%、PFS为76.59%、RFS为89.70%、DMFS为85.66%。NACT+IMRT组与NACT+IMRT+AC组患者3年OS为86.66%和84.47%(P=0.312,图1A),PFS为77.38%和75.31%(P=0.749,图1B),RFS为92.65%和86.00%(P=0.253,图1C),DMFS为83.20%和88.64%(P=0.580,图1D),2组患者的所有生存情况均相似(P>0.05,图1)。
分层分析显示,与NACT+IMRT比较,NACT+IMRT+AC可以提高N3患者的DMFS(HR=0.258,95%CI=0.068~0.975;P=0.046,表2);NACT+IMRT+AC还可以提高ⅣA~B期患者的DMFS(HR=0.247,95%CI=0.081~0.756;P=0.014,表2)。根据UICC2002年分期标准,N3的局部晚期患者即为ⅣB期,所以对于大N(N3)及ⅣA期(T4N0~2M0)的这部分鼻咽癌患者,NACT+IMRT+AC能够提高DMFS(与NACT+IMRT相比,P<0.05,表2)。
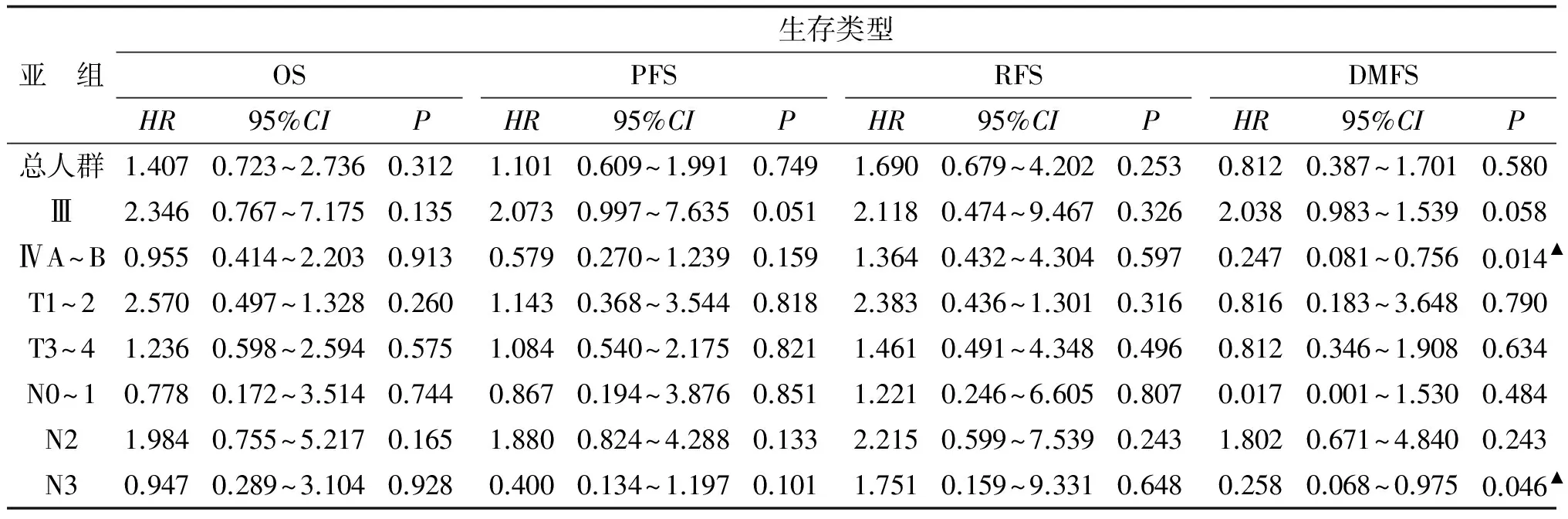
亚 组生存类型OSHR95%CIPPFSHR95%CIPRFSHR95%CIPDMFSHR95%CIP总人群1.4070.723~2.7360.3121.1010.609~1.9910.7491.6900.679~4.2020.2530.8120.387~1.7010.580Ⅲ2.3460.767~7.1750.1352.0730.997~7.6350.0512.1180.474~9.4670.3262.0380.983~1.5390.058ⅣA~B0.9550.414~2.2030.9130.5790.270~1.2390.1591.3640.432~4.3040.5970.2470.081~0.7560.014▲T1~22.5700.497~1.3280.2601.1430.368~3.5440.8182.3830.436~1.3010.3160.8160.183~3.6480.790T3~41.2360.598~2.5940.5751.0840.540~2.1750.8211.4610.491~4.3480.4960.8120.346~1.9080.634N0~10.7780.172~3.5140.7440.8670.194~3.8760.8511.2210.246~6.6050.8070.0170.001~1.5300.484N21.9840.755~5.2170.1651.8800.824~4.2880.1332.2150.599~7.5390.2431.8020.671~4.8400.243N30.9470.289~3.1040.9280.4000.134~1.1970.1011.7510.159~9.3310.6480.2580.068~0.9750.046▲
OS:总生存率;PFS:无进展生存率;RFS:无复发生存率;DMFS:无远处转移生存率;HR:风险比;CI:可信区间;NACT:新辅助化疗;IMRT:调强放疗;AC:辅助化疗. NACT+IMRT+AC组与NACT+IMRT组比较,▲:P<0.05.
2.3 毒副反应 鼻咽癌患者放化疗后主要的急性毒副反应有皮炎、口腔炎、骨髓抑制、恶心、呕吐、肝肾毒性等,慢性毒副反应有皮下纤维化、口干症、听力受损、后组颅神经损伤、颞叶损伤等,其中NACT+IMRT+AC组3~4级骨髓抑制和听力下降的发生率均高于NACT+IMRT组(P<0.05,表3);其余毒副反应2组比较差别无统计学意义(P>0.05,表3)。
表3 2组患者治疗相关的毒副反应比较
Tab 3 Comparison of treatment-related toxicities of patients between the two groups

毒副反应NCAT+IMRT组NACT+IMRT+AC组急性毒性反应 皮炎(3~4级)1(1.06)3(3.85) 口腔炎(3~4级)27(28.72)15(19.23) 骨髓抑制(3~4级)3(3.19)11(14.10)▲ 恶心、呕吐50(53.19)38(48.72) 肝毒性21(22.34)13(16.67) 肾毒性4(4.26)2(2.56)慢性毒性反应 皮下纤维化19(20.21)20(25.64) 口干症36(38.30)41(52.56) 听力受损6(6.38)15(19.23)☆ 后组颅神经损伤1(1.06)4(5.13) 颞叶损伤7(7.45)4(5.13)
表中数据为n(%). NACT:新辅助化疗;IMRT:调强放疗;AC:辅助化疗. 与NACT+IMRT组比较,▲:P<0.05.
2.4 预后因素分析 对于OS、RFS、PFS、DMFS有预测作用的指标包括性别、年龄、病理、T分期、N分期、临床分期和治疗方案等,但是由于笔者研究中无病理类型为WHO Ⅰ类的患者,而Ⅱ类仅有2例,数量太少,故未纳入分析。单因素分析显示,N分期是DMFS的预后因素(HR=2.175,95%CI=1.176~4.026,P<0.05,表4);多因素分析仍然显示N分期是DMFS的独立预后因素(HR=2.247,95%CI=1.224~4.123,P<0.05,表5)。
3 讨 论
随着放疗技术的不断提高,鼻咽癌的局控率虽然得到很大提升,但是远处转移仍是困扰医生的一个难题。化疗联合放疗不失为一种提高局部晚期鼻咽癌疗效、降低远处转移的有效策略,CCRT目前已经成为局部晚期鼻咽癌患者的标准治疗方案。但是,对于某些高转移风险的亚群,尤其是那些存在较大淋巴结或较广泛的淋巴结转移的患者,仅仅用CCRT来提高全身控制似乎不太可能[14]。NACT可以减轻放疗的肿瘤负荷,并杀灭微转移灶,因此被应用于很多实体肿瘤的综合治疗。Huang等研究发现,与NACT+放疗的方案相比,NACT+CCRT方案并没有改善局部晚期鼻咽癌患者的总体生存和无失败生存率[15]。另有研究对比了NACT+放疗+AC与CCRT+AC对局部晚期鼻咽癌患者远期生存的影响,发现两种治疗方案在OS、RFS及无瘤生存率等远期生存上并无差异,远期并发症也相似;但是CCRT增加了恶心、呕吐等消化道反应及口腔炎、白细胞减少的发生率[4,16]。这些副反应可能导致患者放疗中断,从而降低放化疗疗效[14]。因此,对于那些不能耐受同步放化疗的患者,NACT序贯放疗也是一种选择。为了减轻患者的毒性反应,减少放疗中断的几率,本组患者采用了NACT序贯放疗的综合治疗方案,研究显示序贯放化疗之后增加AC并没有提高局部晚期患者的远期生存,这与前人CCRT之后增加AC的研究结果一致[9-12]。
AC在其他头颈部肿瘤如口咽癌、口腔癌中体现出降低局部复发几率甚至延长OS的价值[17-18]。但是对于局部晚期鼻咽癌的患者,大多数研究显示AC并没有带来生存获益[11-12]。本组分析也发现,序贯放化疗后的AC并未能提高局部晚期鼻咽癌患者的3年OS、PFS、RFS、DMFS,而且还增加了3~4级骨髓抑制,听力下降等副反应,这与文献报道相吻合[11-12]。其原因可能在于IMRT克服了常规放疗技术等剂量曲线分布的缺陷,剂量适形度高,在有效保护周围正常组织的基础上,使得所有的肿瘤靶区均得到了足量照射,提高了鼻咽癌患者的局部控制率,可能掩盖了部分化疗的作用。而AC增加了骨髓抑制、消化道反应等副作用,不仅降低了患者的依从性,而且可能抵消序贯放化疗带来的生存获益[12]。此外,放疗后局部组织血供差,导致化疗药物局部浓度较低,疗效下降;AC在前期放化疗基础上进一步降低机体的免疫力;不完善的化疗方案也可能削弱了AC的作用[19]。
AC未显示出生存获益的另外一个可能的原因是以顺铂为基础的联合化疗方案只对那些存在高转移风险的患者有利(如大N的局部部晚期鼻咽癌患者)。预后因素的单因素及多因素分析均显示,N分期是DMFS的独立预后因素,N分级越高,鼻咽癌患者发生远处转移的几率越大,这与之前的研究结果一致[20]。分层组分析显示,对于N3或ⅣA期的局部晚期鼻咽癌患者,增加AC可提高DMFS,与文献报道相似[21]。因此,对于大N的局部晚期鼻咽癌患者,序贯放化疗后增加AC有可能带来生存获益,但是恰当的化疗周期及化疗药物剂量等问题还需要进一步探索。此外,现有的鼻咽癌TNM分期只是依靠解剖学特征及医生的触诊进行,并不能准确地区分那些存在高复发或转移风险的患者。越来越多的研究发现,一些生物、分子标志物及其他非解剖学指标与鼻咽癌的预后有关,如EBV-DNA拷贝数[22]。因此,今后还需综合多种指标,制定出更好的风险预测模型来筛选出高危患者,给予适当的辅助治疗以延长其生存。
综上所述,采用NACT序贯IMRT治疗初诊的局部晚期鼻咽癌患者可以获得较好的局部及区域控制率,AC并未改善患者的生存,反而增加了骨髓抑制、听力下降等毒性反应。尽管AC暂时未在所有局部晚期鼻咽癌患者中显示生存获益,但是它可能有利于那些存在高远处转移风险的患者(N3或IVA期)。笔者的研究也存在一定的局限性。首先,采用的是回顾性的非随机对照研究,存在选择偏倚及回忆偏倚。其次,样本量较小可能影响分析的准确性。因此,今后还需要扩大样本量,进行前瞻性临床试验来进一步明确AC对于局部晚期鼻咽癌患者生存及预后的作用。
[1] Chua M L,Wee J T,Hui E P,etal. Nasopharyngeal carcinoma[J].Lancet, 2016,387(10022):1012-1024.
[2] Lai S Z,Li W F,Chen L,etal. How does intensity-modulated radiotherapy versus conventional two-dimensional radiotherapy influence the treatment results in nasopharyngeal carcinoma patients[J]?IntJRadiatOncolBiolPhys, 2011,80(3):661-668.
[3] Yi J L,Gao L,Huang X D,etal. Nasopharyngeal carcinoma treated by radical radiotherapy alone: Ten-year experience of a single institution[J].IntJRadiatOncolBiolPhys, 2006,65(1):161-168.
[4] Qiu W Z,Huang P Y,Shi J L,etal. Neoadjuvant chemotherapy plus intensity-modulated radiotherapy versus concurrent chemoradiotherapy plus adjuvant chemotherapy for the treatment of locoregionally advanced nasopharyngeal carcinoma:a retrospective controlled study[J].ChinJCancer, 2016,35(1):1-9.
[5] Wu F,Wang R,Lu H,etal. Concurrent chemoradiotherapy in locoregionally advanced nasopharyngeal carcinoma: treatment outcomes of a prospective, multicentric clinical study[J].RadiotherOncol, 2014,112(1):106-111.
[6] Xu T,Hu C,Gao Y,etal. Treatment outcomes of different chemotherapy sequences in N3 stage nasopharyngeal carcinoma[J].RadiatOncol, 2010,78(3):S467-S468.
[7] Liang Z,Zhu X,Li L,etal. Concurrent chemoradiotherapy followed by adjuvant chemotherapy compared with concurrent chemoradiotherapy alone for the treatment of locally advanced nasopharyngeal carcinoma: a retrospective controlled study[J].CurrOncol, 2014,21(3):408-417.
[8] Ouyang P Y,Xie C,Mao Y P,etal. Significant efficacies of neoadjuvant and adjuvant chemotherapy for nasopharyngeal carcinoma by meta-analysis of published literature-based randomized, controlled trials[J].AnnOncol, 2013,24(8):2136-2146.
[9] Liang Z G,Zhu X D,Zhou Z R,etal. Comparison of concurrent chemoradiotherapy followed by adjuvant chemotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a meta-analysis of 793 patients from 5 randomized controlled trials[J].AsianPacJCancerPrev, 2012,13(11):5747-5752.
[10] Yan M,Kumachev A,Siu L L,etal. Chemoradiotherapy regimens for locoregionally advanced nasopharyngeal carcinoma: A Bayesian network meta-analysis[J].EurJCancer, 2015,51(12):1570-1579.
[11] Chen L,Hu C S,Chen X Z,etal. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma: a phase 3 multicentre randomised controlled trial[J].LancetOncol, 2012,13(2):163-171.
[12] Zhang W,Dou H,Lam C,etal. Concurrent chemoradiotherapy with or without adjuvant chemotherapy in intermediate and locoregionally advanced nasopharyngeal carcinoma[J].TumourBiol, 2013,34(3):1729-1736.
[13] Trotti A,Colevas A D,Setser A,etal. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J].SeminRadiatOncol, 2003,13(3):176-181.
[14] Lee A W M,Lau W H,Tung S Y,etal. Preliminary results of a randomized study on therapeutic gain by concurrent chemotherapy for regionally-advanced nasopharyngeal carcinoma: NPC-9901 Trial by the Hong Kong nasopharyngeal cancer study group[J].JClinOncol, 2005, 23(28):6966-6975.
[15] Huang P Y,Cao K J,Guo X,etal. A randomized trial of induction chemotherapy plus concurrent chemoradiotherapy versus induction chemotherapy plus radiotherapy for locoregionally advanced nasopharyngeal carcinoma[J].OralOncol, 2012,48(10):1038-1044.
[16] Xu T,Zhu G,He X,etal. A phase Ⅲ randomized study comparing neoadjuvant chemotherapy with concurrent chemotherapy combined with radiotherapy for locoregionally advanced nasopharyngeal carcinoma: Updated long-term survival outcomes[J].OralOncol, 2014,50(2):71-76.
[17] Furness S,Glenny A M,Worthington H V,etal. Interventions for the treatment of oral cavity and oropharyngeal cancer: chemotherapy[J].CochraneDatabaseSystRev, 2010,65(4):1399-1400.
[19] 冼献清,谢民强,江 刚. 鼻咽癌化疗现状及进展[J]. 临床耳鼻咽喉头颈外科杂志, 2013,27(3):164-168.
[20] Ng A,Lee V,Lui C,etal. Whole-field simultaneous integrated-boost intensity-modulated radiotherapy for patients with nasopharyngeal carcinoma[J].IntJRadiatOncolBiolPhys, 2009,76(1):138-145.
[21] Xu T,Shen C,Ou X,etal. The role of adjuvant chemotherapy in nasopharyngeal carcinoma with bulky neck lymph nodes in the era of IMRT[J].Oncotarget, 2016,7(15):21013-21022.
[22] Leung S F,Chan K C,Ma B B,etal. Plasma Epstein-Barr viral DNA load at midpoint of radiotherapy course predicts outcome in advanced-stage nasopharyngeal carcinoma[J].AnnOncol, 2014,25(6): 1204-1208.
(编辑:常志卫)
Efficacy of Adjuvant Chemotherapy on Patients with Locoregionally Advanced Nasopharyngeal Carcinoma after Undergoing Sequential Chemoradiotherapy
SU Li1, CHEN Qiuyan2, HUAYANG Jingling3, ZHANG Weijian1, CHEN Xiuying1, HONG Jinsheng1
1.Department of Radiation Oncology, The First Affiliated Hospital of Fujian Medical University;Key Laboratory of Radiation Biology(Fujian Medical University), Fujian Province University;Fujian Key Laboratory of Individualized Active Immunotherapy, Fujian Medical University, Fuzhou 350005, China;2.Department of Radiation Oncology, The Second Hospital of Xiamen, Xiamen 361021, China;3.Department of Epidemiology and Statistics, School of Public Health, Fujian Medical University, Fuzhou 350108, China
Objective To retrospectively study the efficacy of adjuvant chemotherapy (AC) following sequential chemoradiotherapy for patients with locoregionally advanced nasopharyngeal carcinoma. Methods 172 cases of locoregionally advanced nasopharyngeal carcinoma were reviewed, among them 94 received neoadjuvant chemotherapy (NACT) followed by intensity modulated radiation therapy(IMRT),while 78 received NACT plus IMRT followed by adjuvant chemotherapy(AC). The survival rates were assessed by Kaplan-Meier analysis. The multivariate analysis was performed by using the Cox proportional hazards regression tests. Results The 3-year overall survival(OS), progression-free survival (PFS), recurrence-free survival (RFS), and distant metastasis-free survival(DMFS) rate for the two groups (the NACT+IMRT groupvsNACT+IMRT+AC group) were 86.66%vs84.47%,77.38%vs75.31%,92.65%vs86.00%,and 83.20 %vs88.64 %, respectively. There was no significant difference in all parameters between the two groups(P>0.05). A stratified analysis indicated that AC improved the DMFS in N3 and IVA stage patients. Compared with the NACT+IMRT group, NACT+IMRT+AC significantly increased the occurrence rates of grade 3~4 bone marrow suppression and hear loss(P<0.05). The N staging was an independent prognostic factor for DMFS(P<0.05). Conclusion The addition of AC provide adds no survival benefit to patients with locoregionally advanced nasopharyngeal carcinoma after undergoing sequential chemoradiotherapy. However, AC seems to improve the DMFS for N3 or IVA stage patients.
nasopharyngeal carcinoma; intensity-modulated radiation therapy; neoadjuvant chemotherapy; adjuvant chemotherapy
2016-07-01
福建省自然科学基金资助项目(2016J01541);福建省卫生系统中青年骨干人才培养重点项目资助计划(2015-ZQN-ZD-19);福建省卫生和计划生育委员会青年科研课题(2014-1-57);2013-2015年度福建省中医药科研项目(wzzy201314)
1.福建医科大学 附属第一医院放疗科,福建省个体化主动免疫治疗重点实验室,放射生物福建省高校重点实验室(福建医科大学),福州 350005; 2.厦门市第二医院 放疗科,厦门 361021; 3.福建医科大学 公共卫生学院流行病与卫生统计学系,福州 350108
苏 丽(1980-),女,主治医师,医学硕士
洪金省.Email:13799375732@163.com
R739.6; R815.6; R979.1
A
1672-4194(2016)06-0380-07
