罗哌卡因联合地塞米松局部浸润改善骨与关节手术后镇痛效果
2016-03-01张超谢宗平金东旭张长青
张超 谢宗平 金东旭 张长青
200233, 上海交通大学附属第六人民医院骨科
罗哌卡因联合地塞米松局部浸润改善骨与关节手术后镇痛效果
张超 谢宗平金东旭 张长青
200233,上海交通大学附属第六人民医院骨科
【摘要】目的探讨罗哌卡因联合地塞米松手术区域局部浸润镇痛能否改善骨与关节手术后疼痛及减少术后口服镇痛药量。 方法将2014年6月至8月我院51例需行骨关节手术患者随机分成两组,实验组术中局部浸润0.1%罗哌卡因20 mL(200 mg)联合地塞米松2 mg,对照组术中局部浸润等量生理盐水。记录患者术后4、8、12、24、48 h疼痛视觉模拟评分(VAS),给予自觉疼痛难忍者口服镇痛药。主要评价指标为术后VAS评分;次要评价指标为口服镇痛药物剂量及首次口服镇痛药物距手术结束时间、术后不良反应、总体满意度等。结果实验组与对照组术后8、12、24、48 h VAS评分有统计学差异,两组口服奇曼丁总剂量、总体满意度有统计学差异。结论罗哌卡因联合地塞米松手术区域局部浸润可显著降低骨与关节手术后静息疼痛,减少需使用镇痛药物的人数,延迟术后镇痛药物应用时间,减少镇药物使用剂量。
【关键词】骨与关节手术;麻醉;镇痛;局部浸润
The analgesic effect of intraoperative wound infiltration with ropivacaine and dexamethasone after bone and joint surgeryZHANGChao,XIEZong-ping,JINDong-xu,ZHANGChang-qing.
Departmentoforthopaedics,theSixthPeople’sHospitalAffiliatedtoShanghaiJiaotongUniversity,Shanghai200233,China
Correspondingauthor:ZHANGChang-qingE-mail:zhangcq6th@gmail.com
【Abstract】ObjectiveTo evaluate the analgesic effect of intraoperative wound infiltration with ropivacaine and dexamethasone after bone and joint surgery. Methods From June to August 2014, 51 patients were randomized into two groups. At the end of suegery, 20 mL 0.1% ropivacaine (200 mg) and dexamethasone (2 mg) or saline was respectively infiltrated in two groups. The visual analog scales (VAS) scores at 4,8,12,24 and 48 h after surgery were recorded, and the patients were administered with analgesics if the patients thought the pain had a negative effect on rest. The primary endpoints were the VAS scores at 4,8,12,24 and 48 h. The secondary endpoints were total dose of analgesics, time of analgesics consumption, side-effects and gross satisfaction scales. Results The VAS scores at 8,12,24 and 48 h after surgery while resting, total dose of analgesics, time of analgesics consumption, side-effects and gross satisfaction scales were statistically different between two groups. Conclusion Ropivacaine and dexamethasone wound infiltration could reduce postoperative pain and analgesics requirements during the first 48 hours after surgery.
【Key words】Bone and joint surgery; Anesthesia; Analgesia; Local infiltration
骨与关节手术患者术后常出现中至重度疼痛[1],合理有效的术后镇痛可减轻疼痛并缩短患者住院时间。传统术后镇痛方式为:经静脉自控镇痛,硬膜外自控镇痛,外周神经区域阻滞镇痛,口服或静脉、肌肉注射非甾体类抗炎药或阿片类药物阵痛。然而,这些镇痛方式往往会引起恶心、呕吐、尿潴留、肢体运动阻滞等不良反应[2-4]。
近年来,局部浸润镇痛作为一种术后镇痛技术应用于临床,表现出高效的术后镇痛效果,同时又能减少麻醉药物对全身的不良反应。Bianconi等[5]在全髋关节置换术(THA)中采用局部浸润镇痛,结果表明局部浸润镇痛可有效减轻THA后疼痛。然而Andersen等[6]在THA中重复应用局部浸润镇痛,结果证实其不能提供额外的镇痛效果。Bech等[7]在髋臼周围截骨术中重复局部浸润罗哌卡因,结果也显示不能提供额外的镇痛效果。因此,目前在骨与关节手术中是否该应用局部浸润技术来改善术后镇痛效果仍存在争议,在药物配比、局部浸润技术、是否需要切口内置管等细节上也未能达成共识。
本研究目的在于评估骨与关节手术中应用单次局部浸润罗哌卡因联合地塞米松的术后镇痛效果。
1资料与方法
1.1临床资料
本研究已通过上海市第六人民医院伦理委员会批准,为随机空白对照研究,选取2014年6月至8月由同一主刀医师完成手术的骨关节病例。
纳入标准:美国麻醉医师协会(ASA)麻醉分级为Ⅰ~Ⅱ级,已获得知情同意,新鲜上肢或下肢骨折、股骨头坏死、髋关节撞击、髋关节炎等,年龄为16~80岁的患者。
排除标准:体重指数(BMI)>30、术后随访不完整、慢性疼痛、长期服用阿片类药物、对麻醉药物过敏或陈旧性骨折等患者。
剔除标准:手术时间超过3 h、出血量超过1200 mL的患者。
1.2麻醉技术
所有患者均采用同种术中全麻方式,具体分为3个阶段:①麻醉诱导阶段,静脉注射咪达唑仑0.05 mg/kg、芬太尼3~4 μg/kg、异丙酚1~2 mg/kg、维库溴铵0.1 mg/kg;②麻醉维持阶段,输液泵持续每小时输入异丙酚3~5 mg/kg、芬太尼2~4 μg/kg,并根据患者表现调整输注速率,术中喉罩给氧;③麻醉复苏阶段。
1.3局部浸润镇痛及术后处理
实验组和对照组分别采用不同额外镇痛措施:实验组予0.1%盐酸罗哌卡因注射液20 mL(200 mg)联合地塞米松2 mg,对照组予生理盐水20 mL。分3次注射:①于深筋膜缝合前,在切口中点旁约3 cm皮肤处插入1支8 cm长针头直达骨折端,确保针头触及骨质或植入物,保持针头位置不变,逐层缝合深筋膜、浅筋膜,由长针头注入5 mL罗哌卡因联合地塞米松(实验组)或生理盐水(对照组);②沿植入物活动长针头,于深部剥离的远、近端分别注射10 mL罗哌卡因联合地塞米松(实验组)或生理盐水(对照组);③皮肤缝合后,沿切口间隙皮下浸润注射剩余5 mL罗哌卡因(实验组)或生理盐水(对照组),以上注射均需确认回抽无血液。术后经静脉置管接入镇痛泵,泵内予盐酸曲马多注射液500 mg和注射用氯诺昔康16 mg于10 mL灭菌注射用水充分溶解,用0.9%氯化钠注射液稀释至100 mL,48 h内静脉持续用药2 mL/h。
术后采用疼痛视觉模拟评分(VAS)记录患者术后4、8、12、24、48 h静息状态下疼痛程度。如患者自觉疼痛难忍,予口服奇曼丁(盐酸曲马多缓释片)50 mg,最大剂量为400 mg/d,并记录每次服药时间、剂量。记录患者术后不良反应,包括消化道功能紊乱(表现为恶心、呕吐),胸闷、呼吸困难,皮肤瘙痒,神经精神紊乱(表现为失眠、兴奋、嗜睡),急性尿潴留等。术后第3天由患者及家属对术后镇痛效果总体满意度进行评价:4为很满意、3为满意、2为一般、1为不满意。
1.4评价指标
主要评价指标:术后4、8、12、24、48 h VAS评分。患者静息时根据自身体验于横线处标记,0分表示无痛,1~3分表示患者能忍受的轻微疼痛,4~6分表示中度疼痛并影响患者睡眠,7~9分表示患者有较强烈的痛感或难忍的重度疼痛,10分表示疼痛难忍。
次要评价指标:患者口服镇痛药物剂量以及首次口服镇痛药物距手术结束的时间、术后不良反应、总体满意度等。
1.5数据处理

2结果
2.1一般情况
本研究共纳入患者51例,其中对照组24例,实验组27例;上肢骨折切开复位内固定16例,下肢骨折切开复位内固定13例,THA 6例,股骨头坏死病灶清除联合吻合血管的游离腓骨8例,髋关节外科脱位联合股骨头成形术8例。实验组和对照组一般情况(年龄、性别、BMI、手术时间、术中失血量、切口长度等)无显著性差异(表1)。
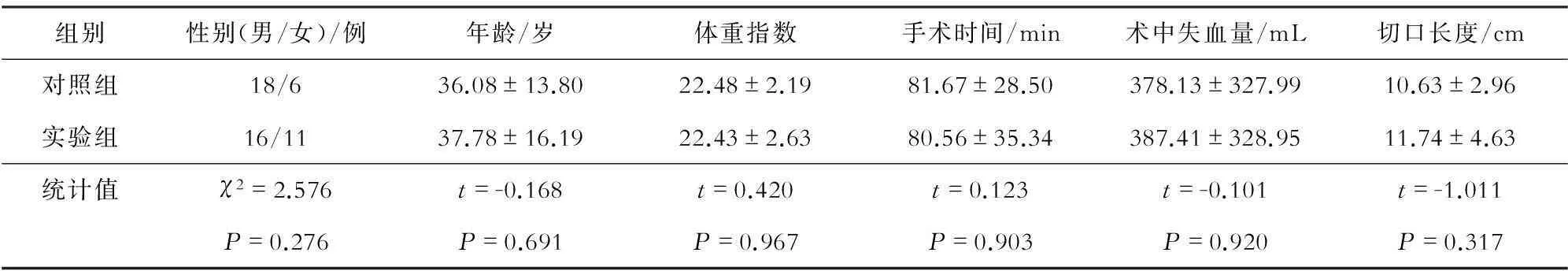
表1 对照组与实验组患者一般资料比较
2.2两组术后VAS评分
实验组术后4、8、12、24、48 h VAS评分均低于对照组,其中术后8、12、24、48 h VAS评分两组间差异有统计学意义(图1)。

图1 对照组与实验组术后不同时间VAS评分比较
2.3首次口服奇曼丁时间、用量、不良反应及镇痛效果总体满意度
实验组需应用镇痛药物的人数(19/27)少于对照组(23/24),两组口服奇曼丁总剂量、总体满意度差异有统计学意义,首次口服奇曼丁时间及不良反应的差异无统计学意义(表2)。

表2 对照组与实验组患者术后镇痛效果比较
3讨论
3.1局部浸润镇痛在骨科手术中的应用
Bianconi等[5]最先采用切口内置管的方法持续浸润镇痛,结果显示可有效减缓THA后疼痛。Kerr等[8]在全膝关节置换术(TKA)中应用持续浸润镇痛也取得类似效果。Andersen等[9]比较罗哌卡因联合酮咯酸、肾上腺素局部浸润与生理盐水局部浸润在THA后的镇痛效果,结果表明局部浸润镇痛组术后早期(24 h内)VAS评分降低且阿片类药物消耗降低。Lunn等[10]、Zoric等[11]采用单次局部浸润罗哌卡因联合或不联合肾上腺素,结果显示两组术后早期(48 h内)VAS评分以及阿片类药物消耗无显著性差异。Andersen等[6]采用双盲随机对照方法将12例同侧THA患者分为两组,一组为术中局部浸润罗哌卡因、肾上腺素,另一组术后8、24 h经关节周围置管局部浸润罗哌卡因、肾上腺素,结果发现两组术后48 h内VAS评分无显著性差异。Busch等[12]将64例TKA患者随机分为两组,结果发现局部浸润镇痛组较空白对照组术后4 h VAS评分显著降低,6、12、24 h阿片类药物消耗减少,满意度提高。Andersen等[13]对TKA患者于术中及术后8、24 h通过关节周围置管局部浸润镇痛,结果表明罗哌卡因局部浸润镇痛可显著降低术后4~32 h VAS评分。Andersen等[14]在另一项随机对照研究中将16例TKA患者随机分为两组,分别于术中及术后6、24 h经关节周围置管注入罗哌卡因或生理盐水,结果发现罗哌卡因组术后1~6 h VAS评分降低,术后24 h两组VAS评分无显著性差异。
有研究[10,12-13,15-17]对比文献报道的THA与TKA局部浸润镇痛效果,发现局部浸润镇痛在THA中的效果逊于其在TKA中的效果,但这些研究同时使用了非阿片类镇痛药物如塞来昔布、对乙酰氨基酚、加巴喷丁等多种药物镇痛,多模式镇痛可带来额外的镇痛效果,甚至掩盖局部浸润镇痛效果。由于创伤所致的骨折患者术后疼痛程度与TKA后中到重度的亚急性疼痛类似[17-18],因此我们对所有患者均使用了经静脉持续性输注镇痛泵,推测如单纯使用局部浸润镇痛可获得更显著的差异。
3.2局部浸润镇痛罗哌卡因的剂量及配比
Lunn等[10]、Busch等[19]、Liu等[20]在局部浸润镇痛中使用的药物有罗哌卡因、布比卡因、吗啡、酮咯酸(非甾体类抗炎药)、倍他米松、肾上腺素等。其中Lunn等[10]应用罗哌卡因的单次剂量为300 mg,并在术后通过伤口内置管注入不同剂量的罗哌卡因。研究[21-22]显示,皮质类固醇药物局部应用可减轻切口周围炎症反应,减缓镇痛药物局部吸收,从而降低镇痛药物的用量及不良反应,且低剂量、短期应用皮质类固醇药物不会引起并发症及不良反应。本研究中采用单次术中局部浸润200 mg罗哌卡因联合低剂量地塞米松(2 mg),一方面排除了其他镇痛药物对实验的影响,证实罗哌卡因在局部浸润镇痛中起主要作用,另一方面也可消除应用非甾体类抗炎药对骨修复的影响[23]。
3.3局部浸润镇痛的安全性
目前罗哌卡因的安全性已得到广泛验证,在切口内局部浸润罗哌卡因的主要风险在于局部麻醉药物的血清浓度升高以及心脏毒性。Gill等[16]研究证实,即使使用高剂量(360 mg)罗哌卡因于切口内局部浸润,其血清浓度仍低于中毒水平。Knudsen等[17]研究认为,罗哌卡因对心肌的毒性低于布比卡因,具有良好的耐受性。Dahl等[24]研究认为,罗哌卡因有明显的收缩血管作用,使用时无需加入肾上腺素。
3.4局部浸润镇痛的局限性
本研究的局限性有:①经静脉镇痛泵输注为持续性输注,会影响不良反应的评估;②病例数量有限,样本量不足;③混合多种术式,无法精确评估局部浸润镇痛对每种术式的镇痛效果;④缺少分析口服奇曼丁对VAS评分的影响,但研究发现与对照组相比,实验组口服奇曼丁的时间延迟且总剂量显著减少,这验证了罗哌卡因局部浸润可显著降低术后早期VAS评分。
参考文献
[1]Astur DC, Aleluia V, Veronese C, et al. A prospective double blinded randomized study of anterior cruciate ligament reconstruction with hamstrings tendon and spinal anesthesia with or without femoral nerve block[J]. Knee, 2014, 21(5):911-915.
[2]Moen V, Dahlgren N, Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990-1999[J]. Anesthesiology, 2004, 101(4):950-959.
[3]Fournier R, van Gessel E, Gaggero G, et al. Postoperative analgesia with “3-in-1”femoral nerve block after prosthetic hip surgery[J]. Can J Anaesth, 1998, 45(1):34-38.
[4]Marino J, Russo J, Kenny M, et al. Continuous lumbar plexus block for postoperative pain control after total hip arthroplasty. A randomized controlled trial[J]. J Bone Joint Surg Am, 2009, 91(1):29-37.
[5]Bianconi M, Ferraro L, Traina GC, et al. Pharmacokinetics and efficacy of ropivacaine continuous wound instillation after joint replacement surgery[J]. Br J Anaesth, 2003, 91(6):830-835.
[6]Andersen LO, Otte KS, Husted H, et al. High-volume infiltration analgesia in bilateral hip arthroplasty. A randomized, double-blind placebo-controlled trial[J]. Acta Orthop, 2011, 82(4):423-426.
[7]Bech RD, Ovesen O, Lindholm P, et al. Local anesthetic wound infiltration for pain management after periacetabular osteotomy. A randomized, placebo-controlled, double-blind clinical trial with 53 patients[J]. Acta Orthop, 2014, 85(2):141-146.
[8]Kerr DR, Kohan L. Local infiltration analgesia: a technique for the control of acute postoperative pain following knee and hip surgery. A case study of 325 patients[J]. Acta Orthop, 2008, 79(2):174-183.
[9]Andersen LJ, Poulsen T, Krogh B, et al. Postoperative analgesia in total hip arthroplasty: a randomized double-blinded, placebo-controlled study on peroperative and postoperative ropivacaine, ketorolac, and adrenaline wound infiltration[J]. Acta Orthop, 2007, 78(2):187-192.
[10]Lunn TH, Husted H, Solgaard S, et al. Intraoperative local infiltration analgesia for early analgesia after total hip arthroplasty: a randomized, double-blind, placebo-controlled trial[J]. Reg Anesth Pain Med, 2011, 36(5):424-429.
[11]Zoric L, Cuvillon P, Alonso S, et al. Single-shot intraoperative local anaesthetic infiltration does not reduce morphine consumption after total hip arthroplasty: a double-blinded placebo-controlled randomized study[J]. Br J Anaesth, 2014, 112(4):722-728.
[12]Busch CA, Shore BJ, Bhandari R, et al. Efficacy of periarticular multimodal drug injection in total knee arthroplasty. A randomized trial[J]. J Bone Joint Surg Am, 2006, 88(5):959-963.
[13]Andersen LO, Husted H, Otte KS, et al. High-volume infiltration analgesia in total knee arthroplasty: a randomized, double-blind, placebo-controlled trial[J]. Acta Anaesthesiol Scand, 2008, 52(10):1331-1335.
[14]Andersen LO, Husted H, Kristensen BB, et al. Analgesic efficacy of subcutaneous local anaesthetic wound infiltration in bilateral knee arthroplasty: a randomised, placebo-controlled, double-blind trial[J]. Acta Anaesthesiol Scand, 2010, 54(5):543-548.
[15]Vendittoli PA, Makinen P, Drolet P, et al. A multimodal analgesia protocol for total knee arthroplasty. A randomized, controlled study[J]. J Bone Joint Surg Am, 2006, 88(2):282-289.
[16]Gill AM, Scott NB, Abbas M, et al. Ropivacaine plasma levels following local infiltration analgesia for primary total hip arthroplasty[J]. Anaesthesia, 2014, 69(4):368-373.
[17]Knudsen K, Beckman-Suurkula M, Blomberg S, et al. Central nervous and cardiovascular effects of i.v. infusions of ropivacaine, bupivacaine and placebo in volunteers[J]. Br J Anaesth, 1997, 78(5):507-514.
[18]Andersen LO, Gaarn-Larsen L, Kristensen BB, et al. Subacute pain and function after fast-track hip and knee arthroplasty[J]. Anaesthesia, 2009, 64(5):508-513.
[19]Busch CA, Whitehouse MR, Shore BJ, et al. The efficacy of periarticular multimodal drug infiltration in total hip arthroplasty[J]. Clin Orthop Relat Res, 2010, 468(8):2152-2159.
[20]Liu W, Cong R, Li X, et al. Reduced opioid consumption and improved early rehabilitation with local and intraarticular cocktail analgesic injection in total hip arthroplasty: a randomized controlled clinical trial[J]. Pain Med, 2011, 12(3):387-393.
[21]Salerno A, Hermann R. Efficacy and safety of steroid use for postoperative pain relief. Update and review of the medical literature[J]. J Bone Joint Surg Am, 2006, 88(6):1361-1372.
[22]Pang HN, Lo NN, Yang KY, et al. Peri-articular steroid injection improves the outcome after unicondylar knee replacement: a prospective, randomised controlled trial with a two-year follow-up[J]. J Bone Joint Surg Br, 2008, 90(6):738-744.
[23]Harder AT, An YH. The mechanisms of the inhibitory effects of nonsteroidal anti-inflammatory drugs on bone healing: a concise review[J]. J Clin Pharmacol, 2003, 43(8):807-815.
[24]Dahl JB, Simonsen L, Mogensen T, et al. The effect of 0.5% ropivacaine on epidural blood flow[J]. Acta Anaesthesiol Scand, 1990, 34(4):308-310.
(收稿:2015-01-26;修回:2015-04-22)
(本文编辑:李圆圆)
DOI:10.3969/j.issn.1673-7083.2016.01.012
通信作者:张长青 E-mail: zhangcq6th@gmail.com
