酸度及盐浓度对β-胸苷与牛血清白蛋白结合作用的影响
2016-02-27金向程俞小清
金向程, 俞小清, 邵 爽
(浙江外国语学院科学技术学院, 浙江 杭州 310012)
酸度及盐浓度对β-胸苷与牛血清白蛋白结合作用的影响
金向程, 俞小清, 邵爽
(浙江外国语学院科学技术学院, 浙江 杭州 310012)
摘要:用荧光光谱法研究了Tris-HCl缓冲溶液(pH=7.1)中β-胸苷(THMD)与牛血清白蛋白(BSA)的结合作用.分别用Stern-Volmer 方程、位点结合模型探讨了THMD与BSA 的作用机制,考察了pH和盐浓度对上述结合作用的影响.结果表明:THMD导致BSA內源荧光猝灭;随着温度的升高,THMD与BSA之间的结合常数和结合位点数减小;pH对上述作用有明显影响,过强的酸性或碱性均会抑制THMD与BSA的结合;体系中盐浓度增大会导致THMD与BSA的结合常数减小.
关键词:β-胸苷;牛血清白蛋白;pH; 盐浓度;荧光光谱;荧光猝灭
血清白蛋白是血浆中含量最丰富的蛋白质,具有较强的结合作用,可以结合外源性化合物从而起到其在体内的储存和运输作用[1].药物从给药部位进入血液后,正是通过与血清白蛋白结合,到达靶部位进而发生药理作用的.研究药物与血清白蛋白的结合及各种外在因素对其的影响,有助于全面了解药物在体内的状态和作用机制[2].
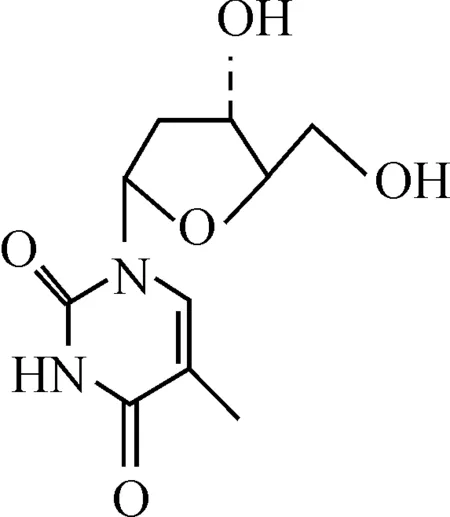
图1 β-胸苷分子结构Fig. 1 Molecular structure of β-thymidine
β-胸苷(β-thymidine,THMD,分子结构见图1)是合成抗艾滋病药物如齐多夫定和司他夫定等的主要原料[3-4],无天然产物存在.THMD的制备主要有化学合成法、DNA酶解法、发酵法等,生物方法生产条件要求高、成本昂贵,一般以化学合成法为主[5].
药物小分子与生物大分子(如BSA)的结合作用是目前化学、药学及生命科学领域的研究热点,外界因素(如共存金属离子、溶液pH、离子强度以及蛋白质变性剂的存在等)对其结
合有着广泛而复杂的影响.在前期研究[6-8]基础上,本文着重考察pH和盐浓度两个因素对THMD与BSA 结合作用的影响,运用荧光法实验,借助理论模型处理实验数据,得到猝灭常数、结合常数、平均结合位点数等重要作用参数,从而为阐明环境因素对药物小分子与BSA的结合的影响提供有用信息和数据.
1仪器和试剂
1.1 仪器
荧光分光光度计(FP-6200型,日本Jasco公司);数控恒温槽(THCY-10,宁波天恒仪器厂);移液器(Finnpipett,5~50 μL,上海雷勃分析仪器有限公司);电子分析天平(AB265-S,METTER TOLEDO, Switzerland); pH计(FE20,梅特勒-托利多仪器上海有限公司);超纯水器(UPWS-10T,杭州永洁达净化科技有限公司).
1.2 试剂及配制
THMD(原料药)由杭州科本药业有限公司提供(质量符合USP29标准);BSA购自上海伯奥生物科技有限公司;三羟基氨基甲烷(Tris)(纯度≥99.9%);浓盐酸、氯化钠(质量分数≥99.5%)、磷酸氢二钠(Na2HPO4·12H2O)、柠檬酸(C6H8O7·H2O)、硼砂(Na2B4O7·10H2O)、氢氧化钠等试剂均为分析纯;实验用水为UPWS超纯水器处理的二次超纯水,检测无荧光杂质.
用0.1 mol/L NaCl溶液分别配制pH=4.0的Na2HPO4-C6H8O7缓冲液、pH=7.1的Tris-HCl缓冲液、pH=10.0的Na2B4O7-NaOH缓冲液.分别用上述不同pH的缓冲液配制1.0×10-5mol·L-1BSA 溶液及1.0×10-3mol·L-1THMD溶液备用.
配制pH=7.1的Tris-HCl缓冲溶液(分别含0.1,0.2,0.3,0.5,0.7,0.9 mol·L-1的NaCl以改变盐浓度).分别用上述不同盐浓度的Tris-HCl缓冲溶液配制1.0×10-5mol·L-1BSA 溶液及1.0×10-3mol·L-1THMD溶液备用.
1.3 实验方法
1.3.1THMD对BSA荧光猝灭光谱
BSA荧光激发和发射光谱测定:移取一定浓度BSA溶液于石英比色皿中,设置发射波长为280 nm,狭缝宽度为5 nm,在298 K下扫描250~350 nm的荧光激发光谱,测得其最大激发波长;并在最大激发波长处,同样条件下扫描其290~410 nm的荧光发射光谱,得到最大发射波长.
移取BSA溶液与不同浓度的THMD溶液(pH均为7.1)于容量瓶中,混匀后恒至指定温度,移取2.5 mL于石英比色皿中,设置荧光激发和发射最大狭缝宽度均为5 nm,最大激发波长为282 nm.测得一系列不同浓度的THMD对BSA的荧光猝灭光谱,并记录最大荧光强度.
1.3.2不同pH值时THMD对BSA的荧光猝灭光谱
分别用pH=4.0,7.1和10.0的缓冲溶液配制的BSA溶液和不同浓度的THMD溶液,按照1.3.1的方法测得不同浓度的THMD对BSA的荧光猝灭光谱,记录最大荧光强度.
1.3.3不同盐浓度时THMD对BSA的荧光猝灭光谱
分别移取含不同NaCl浓度的BSA溶液与不同浓度的THMD溶液(pH均为7.1)于容量瓶中,混匀、恒温至298 K,移取2.5 mL于石英比色皿中,按照1.3.1的方法测得不同浓度的THMD对BSA的荧光猝灭光谱,记录最大荧光强度.
2结果与讨论
2.1 THMD对BSA的荧光猝灭光谱
按上述实验方法,在最大激发波长(282 nm)下,固定BSA的浓度,逐渐增大THMD的浓度,在298 K分别测定不同体系的荧光光谱,结果示于图2.
从图2可以看出,固定BSA浓度,逐渐增大THMD浓度,BSA的荧光强度随之下降,产生荧光猝灭.以上结果说明THMD和BSA之间发生了相互作用,产生了能量转移.
2.2 THMD对BSA的猝灭机制
荧光猝灭作用通常可分为动态猝灭和静态猝灭两种机制.动态猝灭过程遵循Stern-Volmer方程[9]:
F0/F=1+Kqτ0[D]=1+KSV[D].
(1)
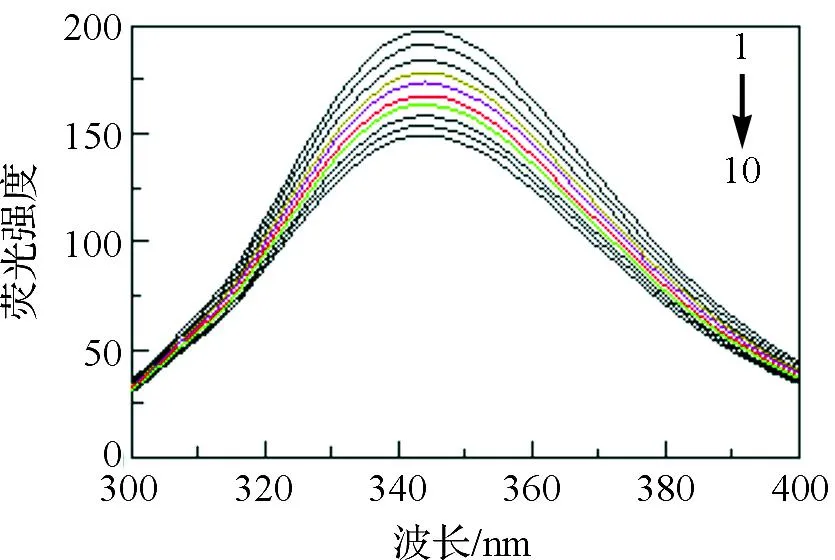
T=298 K,pH=7.1, λex=282 nm, [NaCl]=0.1 mol·L-1,[BSA]=1.0×10-6mol·L-1,[THMD](mol·L-1),1→10:0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.2, 1.4, 1.6, 1.8.图2 THMD对BSA荧光光谱的影响Fig. 2 Effect of THMD on fluorescence spectrum of BSA
式中F0为未加入猝灭剂时荧光物质的荧光强度,F为猝灭剂浓度等于[D]时荧光物质的荧光强度,Kq为双分子猝灭速率常数,τ0为没有猝灭剂存在下荧光分子的平均寿命(取10-8s),KSV称为Stern-Volmer 猝灭常数.
以最大发射波长345 nm处BSA荧光强度按式(1)将F0/F对[THMD]进行线性回归,结果列于表1.该结果表明此猝灭过程与Stern-Volmer方程较相符,随温度的升高,KSV减小.在不同温度下,THMD对BSA的Kq在1012L·(mol·s)-1数量级,远大于各种猝灭剂对生物大分子的最大动态猝灭速率常数(通常Kq=2×1010L·(mol·s)-1[10]),可推断THMD对BSA的猝灭主要是静态猝灭,二者形成了具有一定稳定性的复合物.

表1 THMD与BSA结合的KSV,Kq及相关系数R2
注:T=298 K,pH=7.1.
2.3 位点模型及处理
表2THMD与BSA结合的KA,n及相关系数R2
Tab. 2KA,nandR2between THMD and BSA
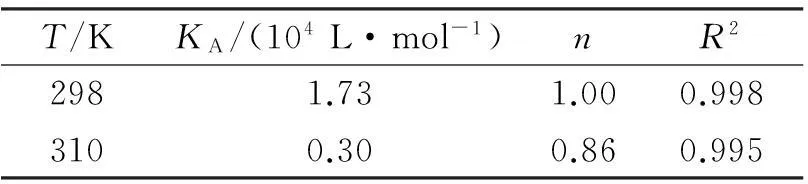
T/KKA/(104L·mol-1)nR22981.731.000.9983100.300.860.995
注:T=298 K,pH=7.1.
设THMD与BSA形成n个结合位点的复合物,且这种复合物无荧光,可得求算结合常数KA和结合位点数n的公式[11]:
lg[(F0-F)/F]=lgKA+nlg[D].
(2)
将实验结果(298和310K温度下)按式(2)处理,即lg[(F0-F)/F]对lg[D]进行线性回归,结果列于表2.从表2可以看出温度对THMD与BSA结合作用的影响,即温度升高,THMD与BSA的KA, n 均减小.这是因为温度的升高加剧了分子间的热运动,从而导致复合物稳定性下降.此结果同时也进一步为THMD对BSA的静态猝灭提供了证据.
2.4 pH对THMD-BSA结合作用的影响
按1.3.2方法测得不同pH下THMD-BSA的荧光猝灭光谱,按式(2)进行线性拟合,结果示于表3.
结果表明:pH对结合位点数n影响不大,但对结合常数KA影响较大,较强的酸性或碱性均导致KA显著减小.这与文献报道[12]一致,较强酸性会增强蛋白质中Trp残基微环境的疏水性, 从而降低其局部表面的疏水性;而较强的碱性会增强蛋白质中Phe残基微环境的极性.上述两种情况均会促使蛋白质分子充分伸展,导致能量传递的有效性差,抑制了蛋白质与小分子的结合.

表3 不同pH下THMD与BSA结合的KA, n及相关系数R2
注:T=298 K, [NaCl]=0.1 mol·L-1.
2.5 盐浓度对THMD-BSA结合作用的影响
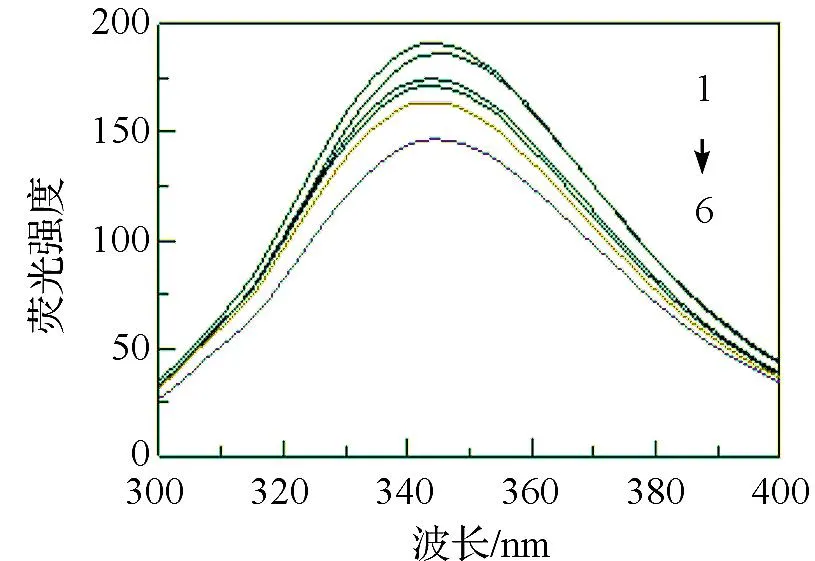
T=298 K,pH=7.1,[BSA]=1.0×10-6mol·L-1,[THMD]=0.2×10-5mol·L-1, [NaCl]/(mol·L-1),1→6: 0.1,0.2,0.3,0.5,0.7,0.9.图3 不同 [NaCl]时THMD-BSA的猝灭光谱Fig. 3 Quenching spectra of THMD-BSAat different [NaCl]
按1.3.3将不同盐浓度下THMD与BSA的荧光猝灭光谱按式(2)进行线性拟合,结果示于表4.将不同NaCl浓度时THMD与BSA的荧光猝灭谱线绘图示于图3.
结果表明:1)盐浓度增大,导致THMD对BSA的荧光猝灭强度减小,但最大发射峰位置未发生明显变化(图3),表明盐浓度不改变THDM-BSA复合物的结构;2)随着盐浓度的增加, THMD与BSA的结合作用(KA)减小,结合位点数(n)变化不大(表4).上述规律与文献报道一致,主要原因可归结为以下两个方面:盐浓度的增加,离子强烈屏蔽蛋白质分子与结合分子之间的静电引力,从而减小了二者之间的结合作用[13];同时NaCl的加入,造成较高的离子氛,降低了两者的亲和力[14].
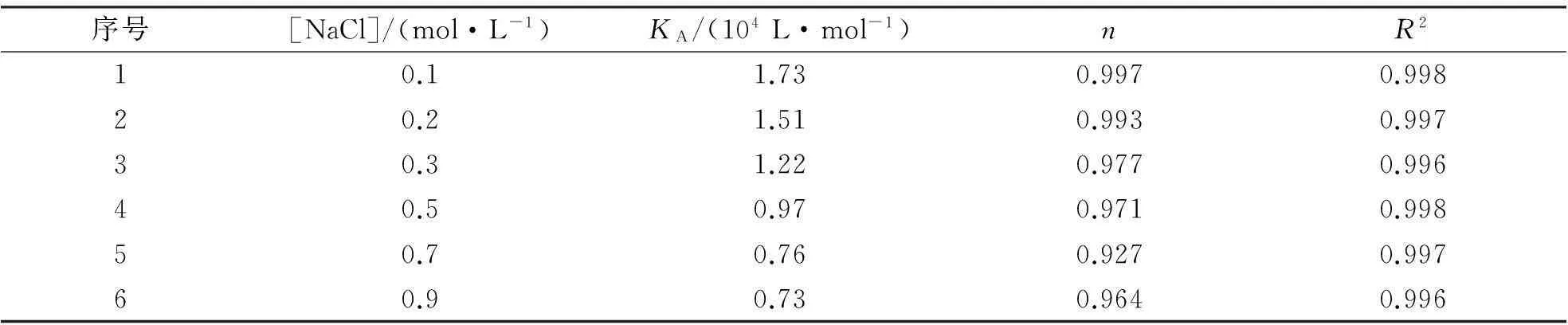
表4 不同盐浓度下THMD与BSA结合的KA,n及相关系数R2
注:T=298 K, pH=7.1.
参考文献:
[1] 杨频.生物无机化学导论[M].西安:西安交通大学出版社,1991:164.
[2] SHAIKH S, SEETHARAMAPPA J, ASHOKA S, et al. A study of the interaction between bromopyrogallol red and bovine serum albumin by spectroscopic methods[J]. Dyes and Pigments,2007,73(2):211-216.
[3] HORWITZ J P,CHUA J, ROOGE M A, et al.The formation of 2’,3’-unsaturated pyrimidine nucleosides via a novel β-eliminiation reaction[J].J Org Chem,1966,31(1):205-211.
[4] FRESKOS J N, SENARATNE K P. Synthesis of β-thymidine: US4914233[P].1990-04-03.
[5] 吴嘉圣,董金锋.有机胺催化剂在β-胸苷合成中的应用[J].浙江化工,2013,44(1):16-18.
[6] 邵爽,马博英,王学杰,等.头孢地嗪钠与牛血清白蛋白相互作用研究[J].物理化学学报,2005,21(7):792-795.
[7] 游金宗,邵爽,雷群芳.甲磺酸帕珠沙星与牛血清白蛋白相互作用及共存金属离子的影响[J].浙江大学学报(理学版),2007,34(2):205-209.
[8] 邵爽,邱瑾.金属离子对齐多夫定与牛血清白蛋白结合作用的影响[J].物理化学学报,2009,25(7):1342-1346.
[9] 许金钩,王尊本.荧光分析法[M]. 3版.北京:科学出版社,2006:64.
[10] 易平贵,商志才,俞庆森,等.丝裂霉素C与牛血清白蛋白结合作用的研究[J].化学学报,2000,58(12):1649-1653.
[11] 魏晓芳,刘会洲.Triton X2100与牛血清白蛋白的相互作用[J].分析化学,2000,28(6):699-701.
[12] 唐臻强,贺干武,易平贵.酸度对氧氟沙星与牛血清白蛋白结合的影响[J].光谱学与光谱分析,2008,28(5):1107-1110.
[13] 张怀敬,何华,李杉杉,等.不同代PAMAM树状大分子与牛血清白蛋白的相互作用研究[J].化学学报,2010,68(17):1741-1748.
[14] 陶慧林,刘帅涛,黎舒怀,等.荧光法研究两面针总生物碱与牛血清蛋白的相互作用[J].化学世界,2012(9):536-538.

第15卷第1期2016年1月杭州师范大学学报(自然科学版)JournalofHangzhouNormalUniversity(NaturalScienceEdition)Vol.15No.1Jan.2016

第15卷第1期2016年1月杭州师范大学学报(自然科学版)JournalofHangzhouNormalUniversity(NaturalScienceEdition)Vol.15No.1Jan.2016
Effects of pH and Salt Concentration on the Interaction of
β-thymidine with Bovine Serum Albumins
JIN Xiangcheng, YU Xiaoqing, SHAO Shuang
(School of Science and Technology, Zhejiang International Studies University, Hangzhou 310012, China)
Abstract:The interaction betweenβ-hymidine(THMD) and bovine serum albumin (BSA) in Tris-HCl buffer solution is studied by fluorescence spectrum. The interaction mechanism between THMD and BSA is discussed using the Stern-Volmer equation and site binding model respectively. The effects of ionic strength and pH on the system are also investigated. The results show that the fluorescence intensity of BSA is quenched when THMD is added. The binding constant and the number of binding sites decrease, as the temperature grows. pH has obvious influence on the above, a strong acidic or alkaline all can inhibit the combination of THMD and BSA. With the increasing of salt concentration, the binding constant between THMD and BSA decreases.
Key words:β-thymidine(THMD);bovine serum albumin(BSA);pH;salt concentration; fluorescence spectrum;fluorescence quenching
文章编号:1674-232X(2016)01-0046-04
中图分类号:O657; O647
文献标志码:A
doi:10.3969/j.issn.1674-232X.2016.01.009
通信作者:邵爽(1962—),男,教授,博士,主要从事热力学、化学生物学研究.E-mail:shuangshao701@163.com
收稿日期:2015-07-22
