糖尿病患者角膜朗格汉斯细胞与神经纤维病理改变的研究
2016-02-27韩治华杨淑焕郭卫民刘喜燕
韩治华,杨淑焕,郭卫民,刘喜燕
作者单位:(710003)中国陕西省西安市,陕西省中医医院1眼科;2脾胃科
糖尿病患者角膜朗格汉斯细胞与神经纤维病理改变的研究
韩治华1,杨淑焕1,郭卫民1,刘喜燕2

作者单位:(710003)中国陕西省西安市,陕西省中医医院1眼科;2脾胃科
Study on corneal Langerhans cells and pathological changes of nerve fibers in diabetic patients
Zhi-Hua Han1, Shu-Huan Yang1, Wei-Min Guo1, Xi-Yan Liu2

Citation:Han ZH, Yang SH, Guo WM,etal. Study on corneal Langerhans cells and pathological changes of nerve fibers in diabetic patients.GuojiYankeZazhi(IntEyeSci) 2016;16(2):343-345
摘要
目的:探讨糖尿病神经病变患者角膜上皮下朗格汉斯细胞(Langerhans cell,LCs)与神经纤维病理改变的关系,分析其发病机制,并提出免疫机制在此过程中的可能作用。
方法:选取60例糖尿病神经病变患者和32例健康对照者,分析角膜神经纤维形态、数量、长度、角膜知觉和LC细胞密度,并分析二者的相关性。
结果:糖尿病神经病变患者角膜神经纤维数量和长度、分支数量明显降低,神经纤维弯曲度明显增加。糖尿病神经病变患者角膜中央和周边上皮下的LC密度与正常对照组相比升高(P<0.05)。同时相关性分析结果显示:LC密度和神经纤维密度(r=0.461,P=0.011)、长度(r=0.519,P=0.002)间存在线性相关。同时糖尿病神经病变患者角膜中央的知觉较对照组明显减退(P<0.05)。
结论:糖尿病神经病变患者角膜下神经纤维明显受损,角膜知觉减退,LC细胞数量增加,提示这种改变可能是免疫机制介导所致。
关键词:糖尿病周边神经病变;朗格汉斯细胞;神经纤维;免疫机制
引用:韩治华,杨淑焕,郭卫民,等.糖尿病患者角膜朗格汉斯细胞与神经纤维病理改变的研究.国际眼科杂志2016;16(2):343-345
0 引言
糖尿病神经病变是糖尿病最常见的慢性并发症之一,病变可累及中枢神经及周围神经,后者尤为常见。其中远端感觉神经病变是最常见的病变,占所有糖尿病神经病变的50%以上。目前认为最主要的发生机制中,自身免疫是其重要的机制之一。角膜是神经分布最为敏感的组织之一,正常角膜上皮细胞下神经纤维数量多,平行排列,分支夹角为锐角,可见神经串珠。在从深向浅走形的过程中分支增加、直径减少、形成串珠、由直变弯、分支夹角度数减小。研究显示糖尿病患者角膜神经纤维密度和长度减少,形态异常。在对糖尿病神经病变活体和尸检的研究发现,神经病变存在自身免疫机制,一些回顾性的尸检报告结果观察到部分糖尿病神经病变患者中有不同程度的泛素羧基末端水解酶-1(ubiquitin carboxy terminal hydrolases L1,UCH-L1)的浸润(UCHL1可以识别T淋巴细胞亚群,并激活T淋巴细胞)。但也报道糖尿病神经病变的某些特定部位存在炎性浸润,而另外一些部位则不存在。同时研究表明,免疫介导机制可能与高血糖损害末梢知觉和自主神经元的作用机制一致[1]。那么角膜会不会也存在上述病变呢?众所周知,角膜和眼表抗原递呈细胞是LCs和树突状细胞(DC),他们源自于骨髓可以刺激T细胞和B细胞发生反应[2]。研究已经证实,在角膜上皮细胞层存在LCs和角膜中央前基质层有DCs[3],并且在疱疹性角膜炎、假单胞菌角膜炎[4]和角膜移植排斥反应[5]也发现LC和DC细胞的存在。因此我们推测,在糖尿病神经病变患者的角膜中可能有免疫作用的参与。角膜共焦显微镜是一个非侵入性的研究方法,利用角膜共焦显微镜可发现亚临床及显现的糖尿病神经病变,为进一步揭示糖尿病神经病变的严重程度提供了研究途径。本研究的目的是采用角膜共焦显微镜定量观察糖尿病神经病变患者和健康者角膜中角膜神经纤维的形态改变和角膜知觉与LCs的密度,进而揭示糖尿病神经病变中角膜的病理改变和免疫机制的作用。
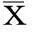
表1 两组研究对象角膜中央神经纤维比较±s
1 对象和方法
1.1对象选取我院2014-01/2015-05内分泌科确诊的糖尿病周围神经病变患者60例120眼和正常对照32例64眼,所有受试者均行角膜共焦显微镜检查。纳入标准:糖尿病性周围神经病变的诊断标准:参照《中国2型糖尿病防治指南》中的关于“糖尿病周围神经病变”的标准确诊;患者经实验室检查确定有糖尿病;具有肢体感觉、神经病变表现,深浅感觉减退,腱反射减退或消失;肌电图提示传导速度障碍[6]。糖尿病周围神经病变患者60例和正常对照32例,所有受试者均行角膜共焦显微镜检查。排除标准:心、肝、肺、肾等存在严重器质性病变的患者,妊娠期或哺乳期女性,合并有酮症酸中毒急性发作者,其他原因引起的神经病变,有角膜接触镜配戴史或角膜手术病史。
1.2方法激光共焦显微镜是由海德堡视网膜激光断层扫描系统Ⅱ代(HRTⅡ)和Rostock 角膜模块组件(RCM)组成。观察视野为380m×380m,放大倍数为800倍,分辨率为1μm。分别计算角膜中央和周边朗格汉斯细胞数量、角膜中央角膜神经纤维密度、神经纤维长度、神经分支密度和神经纤维弯曲和。采用角膜知觉仪(Cochet Bonnet)测量中央角膜知觉。令患者取坐位向直前方注视,用0.11mm直径的尼龙线垂直触到角膜,直到使线变弯到刚可看出的弯度(大约偏斜5°)为止,用最长60mm的尼龙线试验,如无感觉,再用缩短5mm的长度试验,直到患者感到有线的接触。重复3次检查结果取其平均值,所有检查均由同一名检查者检测并完成。

表2 两组研究对象LC密度比较,个/mm2)

图1两组研究对象神经纤维形态变化A:正常受试者上皮下神经纤维;B:糖尿病神经病变患者的神经纤维。
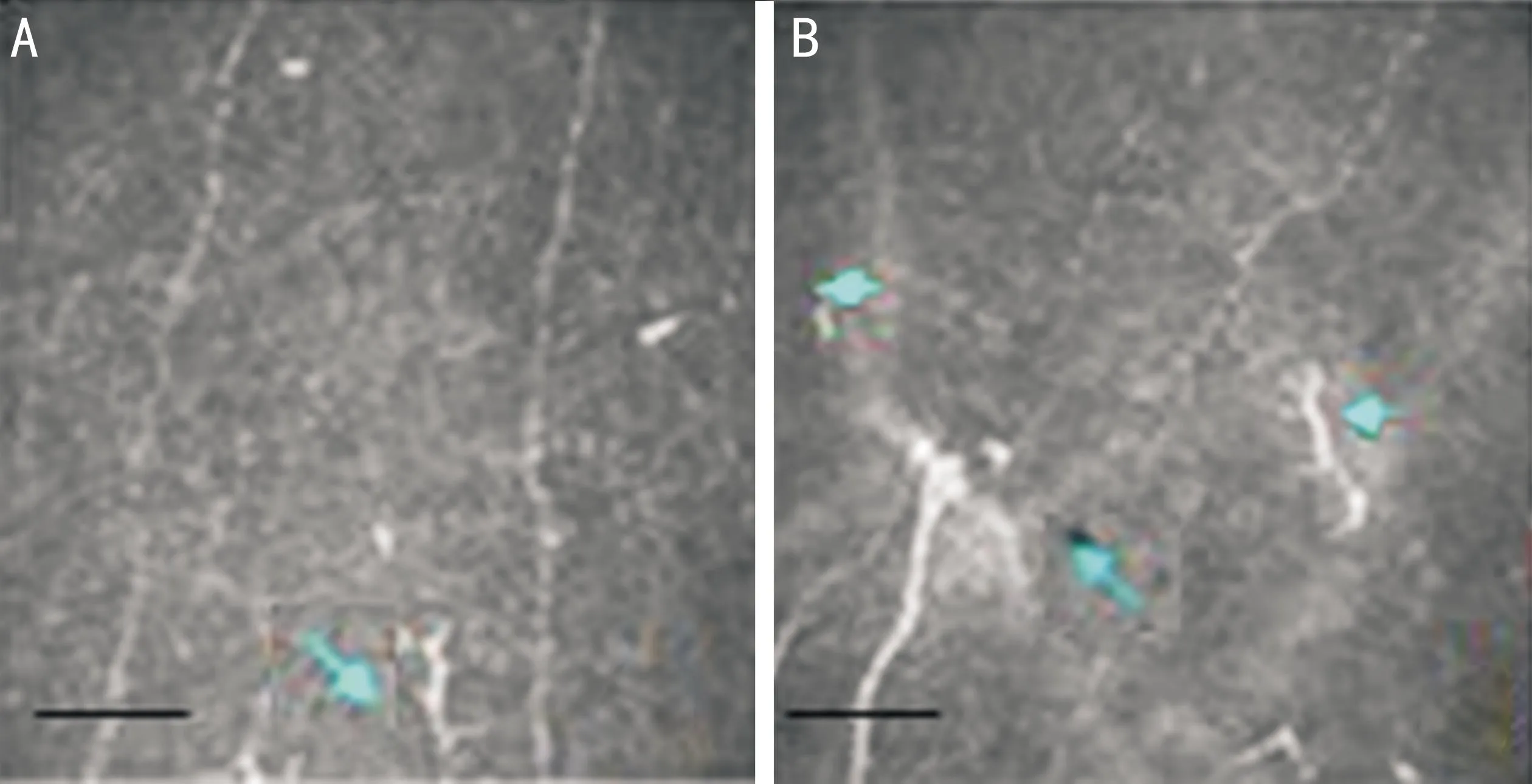
图2两组研究对象LC密度比较A:正常受试者上皮下LC数量少;B:糖尿病神经病变患者的LC数量增多、体积变大。
统计学分析:应用SPSS 19.0统计软件进行分析。计量资料以均数±标准差表示,两组基线数据之间采用独立样本t检验,两独立样本的相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1两组研究对象一般情况典型的2型糖尿病神经病变患者60例,平均年龄为55±1岁,平均糖尿病病程为16.7±2.9a。32例年龄匹配的健康志愿者作为对照组,平均年龄54.3±5.2岁。两组受试者年龄间无统计学差异(t=0.682,P>0.05)。
2.2两组研究对象角膜神经纤维结果与对照组比较,糖尿病组角膜中央神经纤维数量、长度和分支数量明显降低,神经纤维弯曲度明显增加(P<0.05,表1,图1)。
2.3两组研究对象朗格汉斯细胞密度比较糖尿病患者角膜中央和周边上皮下的LC密度与正常对照组相比显著升高(表2,图2)。
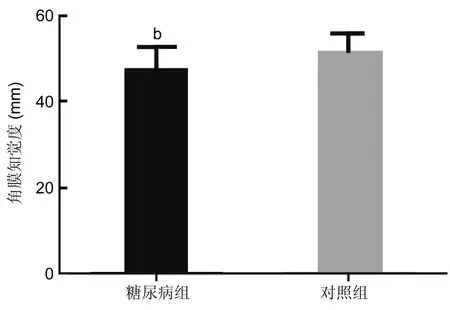
图3两组研究对象角膜知觉度比较bP<0.01vs正常对照组。
2.4两组研究对象角膜知觉检查与正常对照组比较,糖尿病组角膜中央的知觉度明显减退(47.2±5.7vs51.3±4.6,P=0.007,图3)。
2.5神经纤维与LC之间的相关性分析LC密度和神经纤维密度(r=0.461,P=0.011)、长度(r=0.519,P=0.002)间存在线性相关性。
3 讨论
很多研究均证实,糖尿病患者角膜的知觉丧失,角膜神经纤维的形态发生异常[7]。众所周知,角膜中神经可以作为全身神经病变的一个敏感指示剂,在糖尿病患者中角膜神经受损程度可以提示糖尿病神经病变的严重程度。体外的动物实验证明,用STZ诱导的糖尿病小鼠,8wk后上皮下神经纤维数量减少。同时在53%的糖尿病神经病变患者中角膜神经纤维密度,分支纤维的密度和神经长度明显减低[8]。本研究发现糖尿病神经病变患者的神经纤维密度、分支密度和长度均明显减少,与上述研究结果一致。
同时本研究发现,LCs的密度在糖尿病患者中显著增加,特别是角膜上皮下的数量明显增多,考虑在糖尿病神经损伤的早期阶段中LCs可能发挥作用。同时相关性分析结果提示,LC的数量增多与神经纤维密度的减少存在相关性,这些结果说明糖尿病神经损害的发病机制中有免疫作用的参与。此外,角膜缺氧引起的慢性炎症刺激使Langerhans 细胞作为抗原呈递细胞从角膜缘向角膜中央移动,导致角膜上皮下LC细胞密度增加[9-10]。Edwards等[11]研究结果提示,有糖尿病外周神经病变的患者角膜神经纤维度明显短于没有糖尿病外周神经病变的糖尿病患者和正常人。
Tavakoli等[12]采用共聚焦显微镜观察糖尿病神经病变患者的角膜发现角膜上皮LC细胞的数量增多,得出免疫机制可能介导了糖尿病患者早期的角膜神经损伤。宋晓辉等[13]研究发现糖尿病神经病变患者存在相关免疫功能紊乱、神经细胞损伤、结构破坏和神经轴索萎缩、消失,致使神经细胞内抗原蛋白漏出,进一步激活免疫系统,产生神经自身抗体,最终导致神经细胞死亡或凋亡。研究显示,糖尿病神经病变患者体液免疫功能呈升高趋势,IgM和自身抗体ANA、ICA升高[14]。在对糖尿病神经病变的腓肠神经研究发现,在神经内膜和神经束膜有免疫球蛋白的沉积,主要是IgM/IgG及C3,得出高血糖引起的血管屏障破坏导致集体对某些神经组织产生免疫反应[15]。我们的研究发现,在糖尿病神经病变患者的角膜周边和中央上皮下LC细胞数量明显高于正常人群,考虑高糖环境下激活了多条经典途径如多元醇通路,引起细胞功能紊乱,进而激活体内免疫功能到最后一系列的神经纤维病变。然而,有研究认为通过共聚焦显微镜来计数LC细胞并不可靠,所以免疫机制是否在糖尿病患者角膜神经损害中起作用需要其他实验技术的验证。
同时本研究也发现,在神经纤维数量减少和LC细胞间存在显著相关性。Hamrah等[16]研究结果与本实验的结果一致,这进一步地支持人类免疫介导机制参与糖尿病神经病变,上述研究结果支持潜在的免疫机制介导角膜神经损伤。同时明确免疫机制介导的神经损害可以为预防早期神经纤维损害提供治疗帮助。本研究采用活体动态观察角膜损害的变化,并未进行深入的组织学和免疫学指标的检测,尚缺乏体外研究的证实,但可为糖尿病周边神经病变的临床研究提供一定的理论依据。
参考文献
1 Forrest KY, Maser RE, Pambianco G,etal. Hypertension as a risk factor for diabetic neuropathy: a prospective study.Diabetes1997;46(4):665-670
2 Dana MR. Corneal antigen-presenting cells: diversity, plasticity, and disguise: the Cogan lecture.InvestOphthalmolVisSci2004;45(45):722-727
3 Hamrah P, Dana MR. Corneal antigen-presenting cells.ChemImmunolAllergy2007;92:58-70
4 Hazlett LD. Pathogenic mechanisms of P. aeruginosa keratitis: a review of the role of T cells,Langerhans cells, PMN, and cytokines.DNACellBiol2002;21(5-6):383-390
5 He J, Bazan HE. Mapping the nerve architecture of diabetic human corneas.Ophthalmology2012;119:956-996
6 陈丽兰,伊娜,李慧枝.穴位注射联合中药熏洗治疗糖尿病下肢周围神经病变40例.广东医学 2013;34(10):1615-1617
7 Bursova S, Dubovy P, Vlckova-Moravcova E,etal.Expression of growth-associated protein 43 in the skin nerve fibers of patients with type 2 diabetes mellitus.JNeurolSci2012;315(1-2):60-63
8 Petropoulos IN, Alam U,Fadavi H,etal. Rapid automated diagnosis of diabetic peripheral neuropathy withinvivocorneal confocal microscopy.InvestOphthalmolVisSci2014;55(4):2071-2078
9 Su PY, Hu FR, Chen YM,etal. Dendritiform cells found in central cornea by in-vivo confocal microscopy in a patient with mixed bacterial keratitis.OculImmunolInflamm2006;14(4):241-244
10 Zhivov A, Stave J, Vollmar B,etal.Invivoconfocal microscopic evaluation of Langerhans cell density and distribution in the corneal epithelium of healthy volunteers and contact lens wearers.Cornea2007;26(1):47-54
11 Edwards K,Pritchard N,Vagenas D,etal.Utility of corneal confocal microscopy for assessing mild diabetic neuropathy: baseline findings of the LANDMark study.ClinExpOptom2012;95(3):348-354
12 Tavakoli MQC, Abbott C, Kallinikos P,etal. Corneal confocal microscopy: a novel noninvasive test to diagnose and stratify the severity of human diabetic neuropathy.DiabetesCare2010;33(8):1792-1797
13 宋晓辉,李全民,王龙,等.聚腺苷二磷酸核糖聚合酶、离子通道和自身免疫与糖尿病周围神经病变的研究进展.中国糖尿病杂志 2015;7(23):55-59
14 Kang M,Chung KY.PKC-mediates mulitiple endothelin-1 actions on systolic Ca2+and contractility in ventricular myocytes.BiochemBiophysResCommun2012;423(3):600-605
15 Laura C,Luciana G,Alessandro G,etal.Nerve growth factor control of neuronal expression of angiogen eficandvaso active factors.PNAS2001;98(15):4160
16 Hamrah P, Zhang Q, Liu Y,etal. Novel characterization of MHC class II-negative population of resident corneal Langerhans cell-type dendritic cells.InvestOphthalmolVisSci2002;43(3):639-646
·临床报告·
1Department of Ophthalmology;2Department of Spleen and Stomach, Shaanxi Provincial Hospital of Traditional Chinese Medicine,Xi’an 710003, Shaanxi Province, China
Correspondence to:Xi-Yan Liu. Department of Spleen and Stomach, Shaanxi Provincial Hospital of Traditional Chinese Medicine,Xi’an 710003, Shaanxi Province, China.420635257@qq.com
Received:2015-09-10Accepted:2016-01-15
Abstract
•AIM: To study the relation between corneal epithelium Langerhans cells(LCs) and pathological changes of nerve fibers in patients with diabetic peripheral neuropathy in order to further analyze the pathogenesis and find the possible role of immune mechanism in this process.
•METHODS: We selected 60 patients with diabetic neuropathy and 32 healthy controls to observe the morphology, number and length of corneal nerve fibers, corneal central sensation and the cell density of LCs to analyze the correlation of the two.
•RESULTS: The number, length and the number of branches of corneal nerve fibers obvious declined in the patients with diabetic neuropathy. The curling degree of nerve fiber of diabetes group was obviously increased. The density of LCs at corneal central and peripheral areas in patients with diabetic neuropathy significantly increased compared to those of normal control group (P<0.05). The correlation analysis results showed that there were linear correlation between LCs and nerve fiber density(r=0.461,P=0.011), LCs and nerve fiber length (r=0.519,P=0.002). And corneal central sensation decreased obviously in patients with diabetic neuropathy compared to that in normal control(P<0.05).
•CONCLUSION: In patients with diabetic neuropathy, the nerve fibers are significantly impaired, corneal sensation decreases and number of LCs significantly increases, which suggests that the changes might be mediated by the immune mechanism.
KEYWORDS:•diabetic peripheral neuropathy;Langerhans cells;nerve fibers;immune mechanism
DOI:10.3980/j.issn.1672-5123.2016.2.39
收稿日期:2015-09-10 修回日期: 2016-01-15
通讯作者:刘喜燕,女,硕士,副主任医师,研究方向:糖尿病.420635257@qq.com
作者简介:韩治华,女,硕士,主治医师,研究方向:眼表疾病、糖尿病视网膜疾病。
杂志排行
国际眼科杂志的其它文章
- VEGF, HIF-1α and PEDF expression in the retina of streptozotocin-induced diabetics rats treated with ozone
- 比较糖尿病和非糖尿病患者超声乳化术超乳参数和黄斑厚度的变化
- Retinal asymmetry in Chinese adults measured by cirrus high definition optical coherence tomography
- Lens-sparing vitrectomy for shaken baby syndrome
- ReLEx®飞秒激光微小切口基质透镜取出术治疗近视或近视散光术后屈光情况研究
- Eaf2基因敲除对紫外线诱导的鼠白内障形成的影响
