2型糖尿病并发骨质疏松病变患者血清OPG及C-反应蛋白与尿微量清蛋白/肌酐比值的关系
2016-02-26陈桂明孙业富夏爱萍陶晓军
陈桂明,孙业富,夏爱萍,陶晓军
(1.苏州大学附属高邮市人民医院,江苏高邮 225600;2.扬州职业大学医学院,江苏扬州 225012)
2型糖尿病并发骨质疏松病变患者血清OPG及C-反应蛋白与尿微量清蛋白/肌酐比值的关系
陈桂明1,孙业富2△#,夏爱萍1,陶晓军1
(1.苏州大学附属高邮市人民医院,江苏高邮 225600;2.扬州职业大学医学院,江苏扬州 225012)
摘要:目的探讨糖尿病骨质疏松患者血清骨保护素(OPG)及C-反应蛋白(CRP)与尿微量清蛋白/肌酐(UMA/Cr)比值的关系。方法选取2型糖尿病(T2DM)患者154例,分为无糖尿病骨质疏松(NDO)组65例、非增生性糖尿病骨质疏松(NPDO)组53例、增生性糖尿病骨质疏松(PDO)组36例;另选取40例体检健康者为健康对照(NC)组。酶联免疫吸附试验(ELISA)测定血清OPG水平,同时检测CRP及UMA/Cr;T2DM患者的BCG、CRP 及UMA/Cr相互间关系采用Spearman相关分析及偏相关分析。结果在NC组、NDO组、NPDO组及PDO组中OPG依次降低,CRP及UMA/Cr依次增高,组间比较及组间两两比较差异均有统计学意义(均P<0.05);偏相关分析显示,OPG水平与CRP、UMA/Cr呈负相关(均P<0.05),CRP与UMA/Cr呈正相关(P<0.05)。结论糖尿病性骨质疏松症的发展与OPG的降低及CRP、UMA/Cr的增高密切相关,OPG可能是UMA的保护因子,CRP可能是促进因子。
关键词:糖尿病骨质疏松;骨保护素;C反应蛋白;尿微量清蛋白/肌酐比值
2型糖尿病(T2DM) 老年患者常并发骨质疏松症(OP),简称糖尿病性骨质疏松症(DO)。早期无明显自觉症状,常在轻微外力导致骨折后才被发现,也是糖尿病致残率最高的疾病[1-2]。笔者通过观察2 型糖尿病并发疏松症患者骨保护素(OPG) 及C-反应蛋白(CRP)与尿微量清蛋白/肌酐比值(UMA/Cr)的变化,同时分析它们的相互关系,从而为指导糖尿病并发症的临床防治工作提供参考。
1资料与方法
1.1一般资料
1.1.1疾病组选取2014 年1月至2015年5月苏州大学附属高邮市人民医院内分泌科住院的T2DM患者154例,依据2010年美国糖尿病协会(ADA) T2DM 诊断标准确诊,已知病程为6 个月至33年,体质量指数22.1~26.3 kg/m2。所有患者均排除影响骨代谢的疾病(甲状腺功能亢进、风湿性关节炎、变形性骨炎等)、服用影响骨代谢的药物(如糖皮质激素、降钙素、雌激素、氟化物、甲状腺激素、双膦酸盐、抗癫痫药物和利尿剂),肝、肾、心肌功能均无明显异常。T2DM患者分为无糖尿病骨质疏松组(NDO)65例,男34例,女31例,平均年龄(59.76±8.82)岁;非增生性糖尿病骨质疏松组(NPDO)53例,男29例,女24例,平均年龄(60.85±9.73)岁;增生性糖尿病骨质疏松组(PDO)36例,男19例,女17例,平均(61.29±9.52)岁。
1.1.2健康对照(NC)组选取同期体检健康者65例作为NC组,男35例,女30例,平均年龄(62.00±9.00) 岁。两组年龄及性别构成差异均无统计学意义(P>0.05)。
1.2仪器与试剂
1.2.1仪器日立7600全自动生化分析仪,ROCHE cobas E601全自动化学发光免疫分析仪,KUBOTA8410离心机。
1.2.2试剂CRP(北京万泰,批号为DL4102AA22),尿微量白蛋白、尿肌酐(北京利德曼,批号分别为405091C、411241J),血清OPG试剂盒(美国R&D公司,批号为140133C26),以上试剂均在有效期内。
1.3方法
1.3.1血清OPG及CRP测定取清晨空腹静脉血2.0 mL,30 min内3 000 r/min离心10 min,提取血清-70 ℃保存。全自动化学发光免疫分析仪统一检测血清OPG。CRP测定采用胶乳增强免疫比浊法,参数按说明书设置,校准品、质控品为配套产品。所有标本测定3次,取其平均值,检测符合实验室质控标准。
1.3.2UMA、Cr及UMA/Cr地值测定收集T2DM患者连续3 d的晨尿标本,检测UMA及Cr浓度并计算3次UMA/Cr的平均值。尿微量白蛋白检测采用免疫比浊法,Cr检测采用酶速率法,参数按说明书设置,校准品、质控品为配套产品。所有标本测定3次,取其平均值,检测符合实验室质控标准。
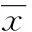
2结果
2.1各组血清OPG、CRP及UMA/Cr比较,NC组与NDO组、NPDO组和PDO组中血清OPG水平依次降低,CRP及UMA/Cr依次增高,组间比较及组间两两比较差异均有统计学意义(均P<0.05)。见表1。


组别nOPG(mg/L,x±s)CRP(mg/L,x±s)UMA/Cr[mg/mmoL,M(P25,P75)]NC组6511.25±2.872.17±1.951.42(0.96,2.13)NDO组658.11±2.34*4.89±4.52*2.37(1.63,4.28)*NPDO组536.42±2.19*#5.77±5.13*#5.72(3.23,18.96)*#PDO组364.75±2.09*#△6.62±5.29*#△22.64(6.95,39.63)*#△
*:P<0.05,与NC组比较;#:P<0.05,与NDO组比较;△:P<0.05,与PDO组比较。
2.2OPG、CRP及UMA/Cr间的相关性分析Spearman相关分析表明,T2DM患者血清OPG水平与CRP(r=-0.296)、UMA/Cr(r=-0.367)均呈明显负相关(均P<0.05),CRP与UMA/Cr呈正相关(r=0.241,P<0.05)。控制年龄及性别影响因素后,偏相关分析显示,OPG水平与CRP(r=-0.262)、UMA/Cr(r=-0.323)仍呈明显负相关(均P<0.05),CRP与UMA/Cr亦呈正相关(r=0.226,P<0.05)。
3讨论
随着人类社会经济发展和人口老龄化的进程,糖尿病在群体的发病率较以前有明显的上升,很多研究证明,糖尿病更易并发骨质疏松症[3-4]。并成为长期严重疼痛和功能障碍的主要原因,严重影响糖尿病患者的生活质量。在1型糖尿病患者青少年发病时期即发生骨丢失,其在2型糖尿病老年患者中表现更加显著。通过研究OPG及CRP与UMA/Cr比值变化之间的相关性,可以早期反映骨的转化水平及破骨和成骨细胞功能,预测骨折发生的风险[5]。
OPG最初发现与其同源核因子κB受体活化因子配体(RANKL)结合抑制了RANKL与其受体核因子κB受体活化因子(RANK)的结合,从而抑制破骨细胞的成熟,在骨代谢疾病方面起重要作用[6]。本研究对154例2型糖尿病老年患者及65例体检健康者研究发现,随着患者年龄的增加,骨密度水平下降、OPG参与骨的代谢具有降低破骨细胞分化和增加骨密度的作用。本研究中,随着DO的发展,OPG逐渐降低,提示OPG可能作为保护因子在DO的发展过程逐渐被耗损。此外,本研究显示,在DO的不同进展阶段,CRP水平逐渐升高,提示炎症与DO的发展密切相关。CRP是慢性非特异性炎症的敏感指标,也是糖尿病微血管并发症发生、发展的标志物。有研究发现,CRP能够刺激视网膜血管内皮细胞产生氧自由基,使细胞氧化磷酸化发生障碍,继而引起血管内皮细胞功能障碍最终导致视网膜的微血管发生病变[7-8]。本研究还显示,T2DM患者中,OPG与CRP呈明显负相关,且在校正年龄和性别影响因素后,此相关性仍然有统计学意义,进一步提示OPG可能作为保护因子随着炎症的发展逐渐被消耗。
本研究中,随着糖尿病并发疏松症的发展,即在糖尿病并发疏松症的不同进展阶段,UMA/Cr逐渐增高,提示糖尿病并发疏松症的发展与UMA密切相关。UMA不仅是肾脏疾病及心血管疾病的危险因素,而且对其他器官如骨质疏松症亦具有严重损伤[9]。研究显示,无论在1型或2型糖尿病中,UMA均是糖尿病并发疏松症的一个重要的危险因素[10-11]。2007年,ADA推荐筛查和诊断UMA采用测定即时尿标本的UMA/Cr比值,UMA/Cr比值可以替代传统的24 h尿蛋白定量,不仅方便快速,且精确可靠。本研究中,UMA/Cr与CRP呈明显正相关,与OPG呈明显负相关,当控制年龄及性别影响因素后,此相关性仍然明显,提示炎性因子及脂肪细胞因子可能参与调节尿蛋白排泄。如前所述,肾脏参与了机体的OPG代谢,随着糖尿病并发疏松症的不断发展,其调节尿蛋白排泄的能力亦逐渐下降,致使UMA增加。CRP作为炎性因子可加重UMA排泄,Sabanayagam等[12]新近的一项研究对包含5 127名亚洲多种族人群的观察发现,升高的CRP水平和UMA及大量清蛋白尿呈独立正相关,且该相关性不依赖于糖尿病、高血压等其他疾病。
综上所述,本研究认为,糖尿病并发疏松症的发展与OPG的降低及CRP、UMA/Cr的增高密切相关,OPG可能是UMA的保护因子,CRP可能是促进因子,但其具体生理病理机制尚待进一步研究。
参考文献
[1] Lampropoulos CE,Papaioannou I,D'cruz DP. Osteoporosis:a risk factor for cardiovascular disease[J].Nat RevRheumatol,2012,8(10):587.
[2] Sealand R,Razavi C,Adler RA. Diabetes mellitus and osteoporosis[J].Curr Diab Rep,2013,13(3):411.
[3] Echouffo-Tcheugui JB,Ali MK,Roglic G,et al.Screening intervals for diabetic retinopathy and incidence of visual loss:a systematic review[J].Diabet Med,2013,30(11):1272-1292.
[4] Loureiro MB,Ururahy MA,Freire-Neto FP,et al. Low bone mineral density is associated to poor glycemic control and increased OPG expression in children and adolescents with type 1 iabetes[J].Diabetes Res Clin Pract,2014,10(3):300-302.
[5] Chuengsamarn S,Rattanamongkolgul S,Jirawatnotai S.Association between serum uric acid level and microalbuminuria to chronic vascular complications in Thai patients with type 2 diabetes[J].Diabetes Complications,2014,28(2):124-129.
[6]Schieferdecker A,Voigt M,Riecken K,et al.Denosumab mimics the natural decoy receptor osteoprotegerin by interacting with its major binding site on RANKL[J].Oncotarget,2014,5(16):6647-6653.
[7]Lee S,Kwak HB.Role of adiponectin in metabolic and cardiovascular disease[J].Exerc Rehabil,2014,10(1):54-59.
[8]Christou GA,Kiortsis DN.The role of adiponectin in renal physiology and development of albuminuria[J].J Endocrinol,2014,221(2):49-61.
[9]Tomic M,Ljubic S,Kastelan S.The role of inflammation and endothelial dysfunction in the pathogenesis of diabetic retinopathy[J].Coll Antropol,2013,37(1):51-57.
[10]Moriya T,Tanaka S,Kawasaki R,et al.Diabetic retinopathy and microalbuminuria can predict macroalbuminuria and renal function decline in Japanese type 2 diabetic patients:Japan Diabetes Complications Study[J].Diabetes Care,2013,36(9):2803-2809.
[11]Romero-Aroca P,Baget-Bernaldiz M,Reyes-Torres J,et al.Relationship between diabetic retinopathy,microalbuminuria and overt nephropathy,and twenty-year incidence follow-up of a sample of type 1 diabetic patients[J].Diabetes Complications,2012,26(6):506-512.
[12]Sabanayagam C,Lee J,Shankar A,et al.C-reactive protein and microalbuminuria in a multi-ethnic Asian population[J].Nephrol Dial Transplant,2010,25(10):1167-1172.
(收稿日期:2015-08-20)
DOI:10.3969/j.issn.1673-4130.2016.01.039
文献标识码:A
文章编号:1673-4130(2016)01-0087-03
#共同第一作者。△通讯作者,E-mail:syfgy@sina.com。
·临床研究·
