三环唑诱导水稻抗性相关基因的表达分析
2016-02-24赵俊龙毛根林汪聪颖徐汉虹朱小源
陈 炎, 赵俊龙, 毛根林, 汪聪颖, 林 菲, 徐汉虹, 朱小源
(1 华南农业大学 农学院/天然农药与化学生物学教育部重点实验室, 广东 广州 510642;2 广东省农业科学院 植物保护研究所, 广东 广州 510640)
三环唑诱导水稻抗性相关基因的表达分析
陈炎1, 赵俊龙1, 毛根林1, 汪聪颖2, 林菲1, 徐汉虹1, 朱小源2
(1 华南农业大学 农学院/天然农药与化学生物学教育部重点实验室, 广东 广州 510642;2 广东省农业科学院 植物保护研究所, 广东 广州 510640)
摘要:【目的】探讨三环唑处理下水稻抗性相关基因表达的动态变化及与抗瘟性的相关性。【方法】室内抑菌活性测定三环唑对稻瘟病菌丝生长和孢子萌发的抑制作用;温室不同时间点接种稻瘟病菌后施用三环唑,测定其防效;利用实时荧光定量PCR对水稻受三环唑处理后不同时间点诱导抗性相关基因进行表达分析。【结果】三环唑对水稻稻瘟菌菌丝生长和孢子萌发无显著抑制作用;接种稻瘟病菌24 h后施用三环唑,仍然能够获得87.2%的防治效果。RT-qPCR结果表明,三环唑能够诱导水稻防卫反应基因OsNH1-1、OsPR1a和OsPR10的表达,进一步选取水杨酸和茉莉酸途径的关键基因进行检测,发现茉莉酸途径的关键基因OsLOX和OsAOS2的表达受到三环唑显著诱导。【结论】三环唑防治稻瘟病并非仅仅抑制了黑色素的合成,三环唑对水稻具有诱导抗性作用,三环唑主要通过茉莉酸途径起诱导抗性作用。
关键词:三环唑; 抑菌活性; 稻瘟病; 抗性相关基因; 基因表达
由稻瘟病菌Magnaporthegrisea(Hebert)Barr引起的水稻稻瘟病严重威胁着世界水稻生产。三环唑是防治稻瘟病的主要药剂之一,已有20多年的使用历史,被认为是低抗性风险类农药。目前,三环唑被认为主要通过2种途径起作用,一是抑制稻瘟病菌附着孢内黑色素合成[1],二是抑制病菌对植株再侵染[2]。然而,稻瘟病菌黑色素合成基因缺失突变体对水稻仍然具有致病性,暗示着三环唑对稻瘟病的防治存在着其他的机制[3]。有研究表明,三环唑不仅可抑制病斑扩展及产孢,还可诱导水稻体内与抗病反应有关的酶活性的提高[4]。
诱导抗性(Induced resistance)是指利用物理、化学或生物因子预先处理植物,激活植物对病虫害和逆境的反应而产生的局部或系统抗性[5]。植物抗病信号传导途径目前已知的主要有3条:1)水杨酸(Salicylic acid,SA)信号传导途径;2)茉莉酸(Jasmonic acid,JA)信号传导途径;3)乙烯(Ethylene,ET)信号传导途径[6-7]。不同的信号分子调控不同类型病原物产生的抗性[8]。通常认为对活体或者半活体营养型病原物的抗性主要由R基因介导的抗病反应或者由SA介导,而对坏死营养型病原物的抗性主要来自JA和ET途径[9-11]。
为了进一步证实和评价三环唑防治稻瘟病的作用机理,确定三环唑诱导寄主产生抗性的途径,本研究评价了三环唑对稻瘟菌的菌丝生长和孢子萌发的抑制作用;以及在稻瘟菌接种水稻后的不同时间点,施用三环唑对稻瘟病的防治效果。进一步检测了水稻诱导抗性相关基因的表达的动态变化,探索三环唑与诱导抗性信号传导途径的关系。
1材料与方法
1.1材料
试验于2012年12月在广东省农业科学院植物保护研究所稻瘟病接种温室进行。供试水稻品种为日本晴OryzasativaL. ssp.japonicacv. Nipponbare,对广东省田间稻瘟病分离菌株T13易感病。三环唑为质量分数为20%可湿性粉剂,购自杭州南郊化学有限公司。
1.2菌丝生长抑制率测定
用无菌水将三环唑配制成20 μg·mL-1的溶液后, 用0.02 μmol·L-1的过滤除菌器过滤,均匀涂在马铃薯培养基(PDA)平板上,晾干。稻瘟病菌在PDA平板上于 25 ℃培养7 d后,用灭菌刀片在菌落近边缘内侧切下边长为 5 mm的菌块,放入上述晾干后的PDA平板的正中央,25 ℃培养10 d后测量菌落直径,根据下列公式计算菌落生长抑制率:抑制率=(1-试验组菌落直径/对照组菌落直径)×100%。用无菌水涂抹的PDA平板处理作为空白对照组。试验重复3次。
1.3孢子萌发抑制率测定
稻瘟病菌在PDA平板25 ℃培养7 d后,加入10 mL左右的无菌水,用小药勺轻轻刮洗2遍,刮伤菌落,放在室温25 ℃,紫光灯下产孢2 d。用20 μg·mL-1三环唑配制成1×105mL-1的孢子悬浮液,取1滴加入凹形载玻片,放入保湿培养皿置于25 ℃恒温培养箱中,24 h后用BX51显微镜(奥林巴斯)检测,计算孢子萌发率和抑制率。用清水配制相同孢子数的孢子悬浮液为对照。试验重复3次。
萌发率=萌发孢子数/总孢子数×100%;
抑制率=(1-试验组萌发率/对照组萌发率)×100%。
1.4菌株培养及三环唑防效检测
菌株培养、致病性测试及病级调查参照朱小源等[12]的方法。水稻秧苗单棵种植于一次性塑料饮水杯中。人工喷雾1×105mL-1的接种菌液于杯栽水稻3.5~4叶期秧苗上。分别于接种后0、1、2、4、6、8、10、12、14、16、24 h喷雾施用20 μg·mL-1的三环唑,每杯5 mL,每个处理5棵秧苗,重复3次,施用清水的植株作为对照。7 d后调查水稻叶片病斑数,记录病株数并计算防效。
1.5基因表达分析材料
水稻材料催芽后穴播于30 cm × 20 cm × 5 cm规格的搪瓷盘里,每盘播24穴,每穴播种量为8~10粒种子,稻苗采取旱育栽培,长至“一叶一心”期,用硫酸铵进行施肥,每盘施用0.5 g,共施3次。待稻苗长至3.5~4叶龄,用20 μg·mL-1的三环唑喷雾施药,施药量为每盘20 mL。以清水喷施为对照,分别于施药后0、6、12 h采集叶片,每个时间点采集5片叶,用锡箔纸包好并做标签,立即投入液氮中,于-70 ℃冰箱保存,待提取RNA。设定3次独立生物学重复。
1.6总RNA的提取和cDNA第一链的合成
采用Trizol法提取三环唑处理后不同时段样品的总RNA,并用微量分光光度计(NanoDorp 2000C)检测RNA的D260 nm和D280 nm、样品的D260 nm/D280 nm以及D260 nm/D230 nm,确定RNA的浓度和纯度,同时用含体积分数为12.5%甲醛的琼脂糖凝胶电泳检测RNA的完整性。随后RNA用RQ1 RNase-free DNase处理,并用反转录试剂盒M-MLV kit进行cDNA的反转录,方法按照说明书进行。
1.7实时荧光定量PCR
分别选取代表水稻不同诱导抗性通路的基因9个,分别为水稻SA-诱导抗性基因(OsEDS1、OsPAD4、OsPAL和OsICS1)、水稻诱导抗性基因(OsLOX和OsAOS2)和诱导抗性下游基因(OsNH1-1、OsPR1a和OsPR10),参照Qiu等[13]的序列(表1),委托华大科技(北京)有限公司进行引物合成。以反转录获得的cDNA稀释2倍为模板,在ABI 7500荧光定量仪上进行实时荧光定量PCR反应。20 μL反应体系包括SYBR Premix ExTaq(2×)10 μL,上、下游引物各0.4 μL,ROX Reference DyeⅡ0.4 μL,模板2 μL,加ddH2O至20 μL。Real-Time PCR反应程序为:95 ℃预变性60 s; 95 ℃变性5 s,60 ℃退火34 s,72 ℃延伸45 s (收集荧光信号),40个循环;PCR反应结束后进行溶解曲线分析。每个样品重复测定3次。

表1 实时荧光定量PCR引物表
1.8相对定量表达分析
按照Bustin等[14]建立的方法确定引物的扩增特异性和效率。利用RefFinder软件对常用的水稻内参基因eEF1a、Actin和UBQ5-2进行稳定性分析,从而选出在此试验条件下稳定性最好的基因作为内参基因。目的基因表达量以选出的内参基因作为标准进行相对定量,相对表达量的计算采用2-⊿⊿Ct法:相对表达量 = 2-⊿⊿Ct= 2-[(CtE-CtF)-(CtA-CtB)]=2(CtF-CtB)-(CtE-CtA)。其中,CtA为处理前待测基因Ct值;CtB为处理前参照基因Ct值;CtE为处理后待测基因Ct值;CtF为处理后参照基因Ct值。
1.9统计分析
利用IBM SPSS staitistics 20软件进行t检验,比较试验组与对照组平均数之间的差异,判断差异显著性。
2结果与分析
2.1三环唑对水稻稻瘟病菌丝的生长抑制率
三环唑对水稻稻瘟病菌菌落生长抑制率试验结果表明,20 μg·mL-1的三环唑对水稻稻瘟病菌落的生长无明显的抑制作用(图1)。10 d后,测量三环唑试验组的菌落直径平均为7.57 cm,用无菌水处理的对照组菌落直径为7.60 cm。三环唑对稻瘟病菌丝生长抑制率仅为0.39%,抑制作用不明显(P>0.05,图1)。

ns表示与对照组无显著差异(P>0.05,t检验)。
Fig.1Effect of tricyclazole on the hyphal growth of Magnaporthe grisea
2.2三环唑对水稻稻瘟病菌的孢子萌发抑制率
用20 μg·mL-1的三环唑对水稻稻瘟病孢子悬浮液处理24 h后进行显微观察。镜检结果显示,三环唑试验组的孢子平均萌发率为95%,对照组的萌发率平均为100%。三环唑对水稻稻瘟病菌的孢子萌发无显著抑制作用(P>0.05)。
2.3三环唑对水稻稻瘟病的防治效果
抗性调查结果表明,水稻接种稻瘟病菌后0、1、2、4,6,8,10,12 h后,施用20 μg·mL-1三环唑,均能达到100%的防效。接种后14、16和24 h也仍分别有91.2%、90.3%和87.2%的防效。
稻瘟菌孢子的附着胞在24 h内已全部黑色素化。如果三环唑仅为抑制黑色素合成的抗侵入剂,那么在黑色素已完全形成后用药应无明显的防病效果。从本试验接种后24 h用药的效果来看,三环唑防病并非仅仅抑制黑色素的合成。
2.4水稻内参基因的稳定性分析
为了确定三环唑处理条件对水稻内参基因稳定性的影响,为基因表达分析奠定基础。选择了已知常用的水稻内参基因eEF1a、Actin和UBQ5-2进行了基因稳定性分析。RefFinder在线分析工具表明,三环唑和清水对照的处理下,3个内参基因表达稳定性
由高到低依次为:eEF1a>Actin>UBQ5-2(图2)。因此,选定eEF1a作为下一步诱导抗性相关基因表达分析的内参基因。

图2 3个水稻候选内参基因稳定性的比较分析
Fig.2Expression stability values of three rice candidate reference genes
2.5三环唑处理对水稻防卫反应下游基因表达的影响
选取水稻防卫反应3个下游基因OsNH1-1,Os-PR1a和OsPR10进行表达分析,结果表明:三环唑处理水稻12 h后,OsNH1-1基因表达量显著提高;三环唑处理水稻0和12 h后,OsPR1a基因表达量也显著提高,随后出现降低;OsPR10基因表达量在0 h出现显著升高,而后在12 h降低,24 h与对照无显著差别(图3)。以上结果说明,三环唑对水稻幼苗具有诱导抗病性的作用。

图3 三环唑处理对水稻防卫反应下游基因表达的影响
2.6三环唑处理对水稻SA诱导抗性途径基因表达的影响
为了确定三环唑对水稻诱导抗性的途径,选取了4个SA途径相关基因进行表达分析(图4)。结果表明,除了OsPAD4基因在三环唑处理后12 h和OsICS1基因在三环唑处理后0 h表现微弱升高之外,其他基因和时间点均表现显著下降或者表达差异不显著,说明三环唑对水稻的诱导抗性作用通过SA途径起作用的可能性非常小。
2.7三环唑处理对水稻JA诱导抗性途径基因表达的影响
选取了2个JA途径相关基因进行了表达分析(图5)。结果发现,OsLOX基因在三环唑处理0和12 h后,出现了表达量极显著提高(P<0.01)。OsAOS2基因在三环唑处理12 h后也出现显著性提高(P<0.05)。说明三环唑对水稻的诱导抗性作用主要通过JA途径起作用。
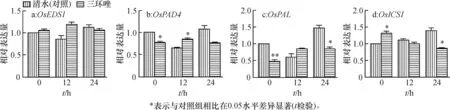
图4三环唑对水稻SA抗性途径相关基因表达的影响
Fig.4Effect of tricyclazole on the expression of rice SA signaling pathway gene
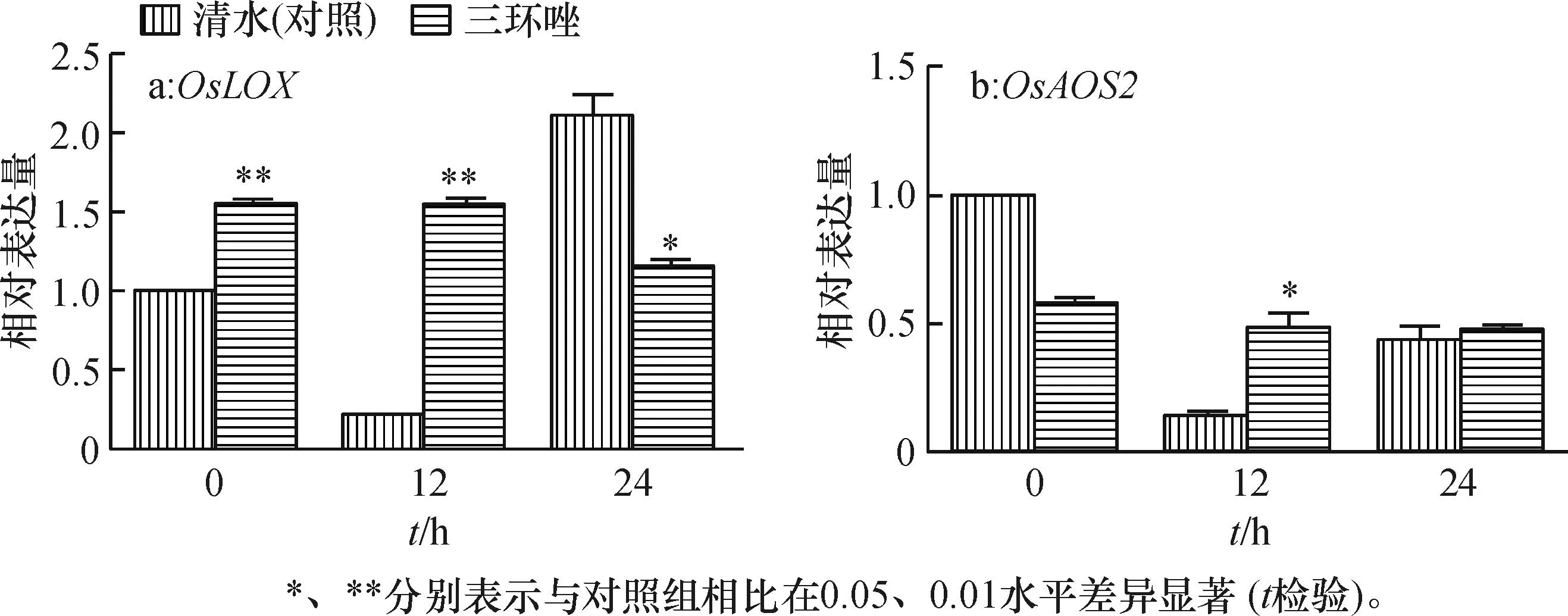
图5 三环唑对水稻JA诱导抗性途径相关基因表达的影响
3讨论与结论
三环唑是防治水稻稻瘟病的特效药。一直以来,对三环唑作用机理的研究主要集中于其对稻瘟病菌的抑制作用[2, 15-16]。本研究的试验结果证明,三环唑对稻瘟菌菌丝生长、孢子萌发均没有抑制效果。水稻接种稻瘟菌24 h后施用三环唑,仍然能够达到87.2%的防治效果,这与杨荣明等[17]的研究结果是一致的。而稻瘟病菌的附着胞在24 h内已经全部黑色素化,说明三环唑防病并非仅仅是抑制黑色素的形成[2, 18]。本研究对三环唑是否同时激发了水稻的诱导抗性问题进行探讨和证明。诱导抗性是一种普遍存在的现象, 其内在的信号途径以及在植物保护中的潜在应用价值已经得到深入的研究。
虽然大量试验证实诱导抗性是一种控制植物病害的有效方法,但投入到生产实际应用得还较少,主要原因是对诱导抗性的认识不够全面,对引起诱导抗性的机理了解不深入。本文对水稻应答三环唑处理后,诱导抗性相关基因进行表达分析。OsNH1-1是水稻中与拟南芥NPR1同源的基因,被认为是SA和JA途径交叉的关键节点,是植物系统性抗性的重要调节中心[19]。OsPR1a和OsPR10是抗性表达的标志性基因,由于无论是PTI还是ETI抗性,均表现出这2个基因表达量的提高[20],因此,OsPR1a和OsPR10被认为是防卫反映下游基因[21]。本研究结果发现,三环唑诱导了水稻防卫反应下游基因OsNH1-1、OsPR1a和OsPR10的表达,说明三环唑对水稻具有诱导抗性作用。
SA可以经由异分支酸合成酶途径和苯丙途径合成[22-23]。ICS1为在异分支酸途径中SA合成的关键基因。所需抗病基因介导抗性的2个其他基因是OsPAD4和OsEDS1,以正反馈回路功能调节SA上游OsICS1基因的合成[24-25]。本研究选取了4个SA途径相关基因(OsICS1,OsEDS1,OsPAD4和OsPAL)进行表达分析,结果显示,这4个基因的表达量变化不明显,说明三环唑不是通过SA途径起诱导抗性的作用。
JA合成途径开始于α亚麻酸,LOX和AOS是该途径的2个重要的基因[26]。本研究发现受三环唑处理后,OsLOX和OsAOS2基因的表达量显著提高,三环唑主要通过JA途径起作用。JA途径是植物抗病信号传导的主要途径之一,主要介导坏死营养型病原物产生的抗性[9-11]。稻瘟病菌是兼性营养病原菌,侵入水稻细胞的初始阶段,主要以活体营养为主,随后初次侵染细胞死亡,病原菌转化为死体营养方式,同时以活体营养方式继续侵染下一个临近的细胞[8]。本研究的结果从另一个角度说明,三环唑可能通过JA途径介导的诱导抗性,阻止病原菌在植株体内的再侵染,从而延长了药物的持效期。可能是三环唑不易使稻瘟病产生抗性,属于低抗药性风险类农药的原因之一。深入研究水稻植株内三环唑受体分子,对于开发水稻稻瘟病菌诱抗剂具有重要的意义。
参考文献:
[1]WOLOSHUK C P, SISLER H D, VIGIL E L. Action of the antipenetrant, tricyclazole, on appressoria ofPyriculariaoryzae[J]. Physiol Plant Pathol,1983, 22(2): 221-245.
[2]KUNOVA A, PIZZATTI C, CORTESI P. Impact of tricyclazole and azoxystrobin on growth, sporulation and secondary infection of the rice blast fungus,Magnaportheoryzae[J]. Pest Manag Sci, 2013, 69(2): 278-284.
[3]BASHYAL B M, CHAND R, KUSHWAHA C, et al. Association of melanin content with conidiogenesis inBipolarissorokinianaof barley (HordeumvulgareL.)[J]. World J Microb Biot, 2010, 26(2): 309-316.
[4]KUMAR M, CHAND R, DUBEY R S, et al. Effect of Tricyclazole on morphology, virulence and enzymatic alterations in pathogenic fungiBipolarissorokinianafor management of spot blotch disease in barley[J]. World J Microb Biot,2015, 31(1): 23-35.
[5]CHOUDHARY D K, JOHRI B N. Interactions ofBacillusspp. and plants-with special reference to induced systemic resistance (ISR)[J]. Microbiol Res,2009, 164(5): 493-513.
[6]DONG X N. SA, JA, ethylene, and disease resistance in plants[J]. Curr Opin Plant Biol,1998, 1(4): 316-323.
[7]THATCHER L F, ANDERSON J P, SINGH K B. Plant defence responses: What have we learnt fromArabidopsis?[J]. Funct Plant Biol,2005, 32(1): 1-19.
[8]THOMMA B P H J, EGGERMONT K, PENNINCKX I A M A, et al. Separate jasmonate-dependent and salicylate-dependent defense-response pathways inArabidopsisare essential for resistance to distinct microbial pathogens[J]. Proc Natl Acad Sci USA,1998, 95(25): 15107-15111.
[9]GLAZEBROOK J. Genes controlling expression of defense responses inArabidopsis: 2001 status[J]. Curr Opin Plant Biol, 2001, 4(4): 301-308.
[10]HAMMOND-KOSACK K E, PARKER J E. Deciphering plant-pathogen communication: Fresh perspectives for molecular resistance breeding[J]. Curr Opin Plant Biol,2003, 14(2): 177-193.
[11]FELTON G W, KORTH K L. Trade-offs between pathogen and herbivore resistance[J]. Curr Opin Plant Biol,2000, 3(4): 309-314.
[12]朱小源,杨健源,刘景梅,等. 广东水稻品种抗稻瘟病性分析与利用策略[J]. 广东农业科学,2006,33(5): 34-37.
[13]QIU D Y, XIAO J, DING X H, et al. OsWRKY13 mediates rice disease resistance by regulating defense-related genes in salicylate-and jasmonate-dependent signaling[J]. Mol Plant Microbe In, 2007, 20(5): 492-499.
[14]BUSTIN S A, VANDESOMPELE J, PFAFFL M W. Standardization of qPCR and RT-qPCR[J]. Genet Eng Biotechn N,2009, 29(14): 40-43.
[15]NIKOLAEV O N, AVER′YANOV A A, LAPIKOVA V P, et al. Possible involvement of reactive oxygen species in action of some anti-blast fungicides[J]. Pestic Biochem Phys, 1994, 50(3): 219-228.
[16]INOUE S, KATO T, JORDAN V W L, et al. Inhibition of appressorial adhesion ofPyriculariaoryzaeto barley leaves by fungicides[J]. Pest Manag Sci,1987, 19(2): 145-152.
[17]杨荣明,周明国,叶钟音. 三环唑防治稻瘟病的作用机制[J]. 南京农业大学学报,1998,21(2): 37-40.
[18]HOMMA Y, ARIMOTO Y, TAKAHASHI H, et al. Observation of the various growth stages of rice blast fungus (PyriculariaoryzaeCavara) by onion epidermal strip method[J]. J Pestic Sci,1983, 8(3): 371-377.
[19]CHEN Y C, CHANG H S, LAI H M, et al. Characterization of the wound-inducible protein ipomoelin from sweet potato[J]. Plant Cell Environ,2005, 28(2): 251-259.
[20]AGRAWAL G K, RAKWAL R, JWA N. Differential induction of three pathogenesis-related genes, PR10, PR1b and PR5 by the ethylene generator ethephon under light and dark in rice (OryzasativaL.) seedlings[J]. J Plant Physiol,2001, 158(1): 133-137.
[21]LI J, BRADER G, PALVA E T. The WRKY70 transcription factor: A node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense[J]. Plant Cell, 2004, 16(2): 319-331.
[22]LEE H, LEóN J, RASKIN I. Biosynthesis and metabolism of salicylic acid[J]. Proc Natl Acad Sci USA, 1995, 92(10): 4076-4079.
[23]MAUCH F, MAUCH-MANI B, GAILLE C, et al. Manipulation of salicylate content inArabidopsisthalianaby the expression of an engineered bacterial salicylate synthase[J]. Plant J, 2001, 25(1): 67-77.
[24]FEYS B J, MOISAN L J, NEWMAN M, et al. Direct interaction between theArabidopsisdisease resistance signaling proteins, EDS1 and PAD4[J]. EMBO J,2001, 20(19): 5400-5411.
[25]FALK A, FEYS B J, FROST L N, et al. EDS1, an essential component of R gene-mediated disease resistance in Arabidopsis has homology to eukaryotic lipases[J]. Proc Natl Acad Sci USA,1999, 96(6): 3292-3297.
[26]ZHAO J, DAVIS L C, VERPOORTE R. Elicitor signal transduction leading to production of plant secondary metabolites[J]. Biotechnol Adv,2005, 23(4): 283-333.
【责任编辑柴焰】
Tricyclazole induced expression of genes associated with rice resistance
CHEN Yan1, ZHAO Junlong1, MAO Genlin1, WANG Congying2, LIN Fei1, XU Hanhong1, ZHU Xiaoyuan2
(1 College of Agriculture, South China Agricultural University/Key Laboratory of Natural Pesticide & Chemical
Biology, Ministry of Education, Guangzhou 510642,China; 2 Plant Protection Research Institute,
Guangdong Academy of Agricultural Sciences, Guangzhou 510640,China)
Abstract:【Objective】 This study aims at analyzing both the dynamics and the correlations with rice blast resistance of rice defense related gene expression under tricyclazole treatment.【Method】 Antifungal activity of tricyclazole was determined indoor under greenhouse conditions. Real-time PCR analysis was performed to monitor the expression levels of rice defense related genes after tricyclazole treatment.【Result】 Rice blast fungus mycelium growth and spore germination were not inhibited by tricyclazole. However, tricyclazole treatment 24 h after rice blast fungus inoculation could still help 87.2% of the rice strains to successfully defense the fungi. RT-qPCR results showed that rice defense related genesOsNH1-1,OsPR1aandOsPR10 were induced by tricyclazole. Moreover, by analyzing the expression of key genes in the salicylic acid and jasmonic acid pathways, the key genes ofOsLOXandOsAOS2 from the latter one were significantly induced by tricyclazole treatment.【Conclusion】 The prevention of rice blast by tricyclazole is not only by inhibiting the synthesis of melanin. RT-qPCR results show that tricyclazole can trigger rice resistance by inducing expression of key genes in the jasmonic acid pathway.
Key words:tricyclazole; antifungal activity; rice blast; resistance related genes; gene expression
中图分类号:S511;S502
文献标志码:A
文章编号:1001-411X(2016)01-0035-06
基金项目:国家现代农业产业技术体系专项(CARS-01-24)
作者简介:陈炎(1992—),女, 硕士研究生,E-mail:1553637900@qq.com;通信作者:徐汉虹(1961—),男,教授,博士,E-mail: hhxu@scau.edu.cn; 朱小源(1965—),男,研究员,博士,E-mail: zhuxy@gdppri.com
收稿日期:2015-04-10优先出版时间:2015-12-07
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20151207.1116.012.html
陈炎, 赵俊龙, 毛根林,等.三环唑诱导水稻抗性相关基因的表达分析[J].华南农业大学学报,2016,37(1):35-40.
