苦楝SRAP分子标记及遗传多样性分析
2016-02-23陈丽君刘明骞廖柏勇李俊成陈晓阳
陈丽君, 刘明骞, 廖柏勇, 李俊成, 陈晓阳
(1 华南农业大学 试验中心, 广东 广州 510642;2 华南农业大学 华南农业博物馆筹建办公室, 广东 广州 510642;3 广东省森林植物种质创新与利用重点实验室/华南农业大学 林学与风景园林学院, 广东 广州 510642)
苦楝SRAP分子标记及遗传多样性分析
陈丽君1, 刘明骞2, 廖柏勇3, 李俊成3, 陈晓阳3
(1 华南农业大学 试验中心, 广东 广州 510642;2 华南农业大学 华南农业博物馆筹建办公室, 广东 广州 510642;3 广东省森林植物种质创新与利用重点实验室/华南农业大学 林学与风景园林学院, 广东 广州 510642)
摘要:【目的】为快速分析苦楝Meliaazedarach不同种源提供方法,揭示苦楝遗传多样性,为苦楝的开发、利用及选择育种提供一定的理论依据。【方法】从783对SRAP引物组合中筛选出20对多态性较高的引物组合,对苦楝国内全分布区的37个种源和肯尼亚1个种源样品进行SRAP遗传多样性分析。【结果】20对引物组合共扩增出242条谱带,其中多态性条带101条,多态性百分率平均值为40.89%,每对引物组合扩增条带5~17条,平均每对引物扩增条带12.1条;其多态性信息量(Polymorphism information content,PIC)值介于0.188~0.488,平均值为0.299。基于UPGMA法聚类以0.350为阈值可将38个苦楝种源划分为7类,在此基础上,去掉2个种源,将其余36个种源划分5个地理类群。【结论】SRAP分子标记可以很好地反映苦楝的遗传多样性,聚类类群划分结果有明显的地理趋势和气候生态特征。
关键词:苦楝; 种源; 遗传多样性; SRAP
苦楝Meliaazedarach又名翠树、楝树、紫花树、森树等,为楝科楝属落叶乔木,分布于中国、韩国、日本、印度、斯里兰卡、印度尼西亚和澳大利亚等地,欧洲、美洲也有栽培[1]。苦楝生长速度快、木材材质优良、纹理美丽,易加工,可用于家具、建筑、农具、船舶、乐器等方面,木材抗白蚁、抗虫蛀、耐腐。苦楝耐烟尘、能大量吸收有毒有害气体,是优良的城市及工矿区绿化树种,也是我国南方四旁绿化常用树种[2-3]。苦楝的根、皮、花、果均可入药,也可作为植物源农药[4]。分子标记是继形态学标记、细胞学标记、生化标记之后最为可靠的遗传标记技术[5~6]。目前已有少量文献对部分苦楝种源的遗传多样性进行分析,程诗明[7]采用7对AFLP引物对分层随机抽样的8个群体240个个体基因组进行研究分析,共扩增得到658条清晰谱带,其中650条为多态性谱带,各群体多态位点百分率为51.4%~76.29%;陈羡德[8]利用筛选出的20个RAPD引物对15个不同来源的苦楝进行分析,20个随机引物共扩增出193条重复性好、清晰的谱带,其中多态性谱带共计189条,占97.9%。夏海涛[9]采用筛选出的24个简单重复序列间多态性(Inter-simple sequence repeat,ISSR)引物对13个种源苦楝优树DNA进行分析,共扩增出382个位点,多态位点百分率为98.43%,其中南宁和仓山种源的多态位点百分率最高,为54.97%,延平的多态位点百分率最低,为43.98%,说明13个种源苦楝的遗传多样性丰富。但是,苦楝分布广泛,以前的研究采样点偏少,不足以准确地反映全分布区苦楝的遗传多样性。本项研究从国内18个省(区、市)37个县(市)采集苦楝种子,并收集肯尼亚内罗毕苦楝种子,采取相关序列扩增多态性(Sequence-related amplified polymorphism, SRAP)分子标记方法进行遗传多样性分析。此外,SRAP分子标记结合了扩增片段长度多态性(Amplified fragment length polymorphism, AFLP)及随机扩增的多态性DNA(Random amplified polymorphic DNA, RAPD)各自的优点,方便快速,只需要极少量DNA材料,且不需要预先知道DNA序列信息,即可快速获得大量的信息,试验结果稳定可靠,且再现性较高,重复性较好[10~11]。
1材料与方法
1.1试验材料
以国内全分布区的37个种源和肯尼亚内罗毕1个种源为对象进行苦楝SRAP遗传多样性分析,采种点地理位置及编号见表1。试验材料采于广州市华南农业大学苗圃1年生苦楝,采集幼嫩枝条上嫩叶6~8片,低温保存用于提取DNA。
1.2试验仪器与设备
试验仪器主要有超微量紫外分光光度计(Thermo nanodrop 2000),PCR扩增仪(PTC-200),DYY-Ⅲ型恒压恒流电泳仪(北京六一仪器公司),凝胶成像系统(Bio-rad),高速离心机(Eppendorf)等。试验用TaqDNA聚合酶、dNTPs、Mg2+及100 bp DNA ladder 等购自TaKaRa公司,琼脂糖和Gold View核酸染料购自广州鼎国生物科技有限公司,酚、三氯甲烷、乙醇、异丙醇、硫代硫酸钠、硼酸、甲醛、冰醋酸、硝酸银等其他试剂为国产分析纯。SRAP引物由上海生工生物工程有限公司合成,本研究所用引物序列见表2。
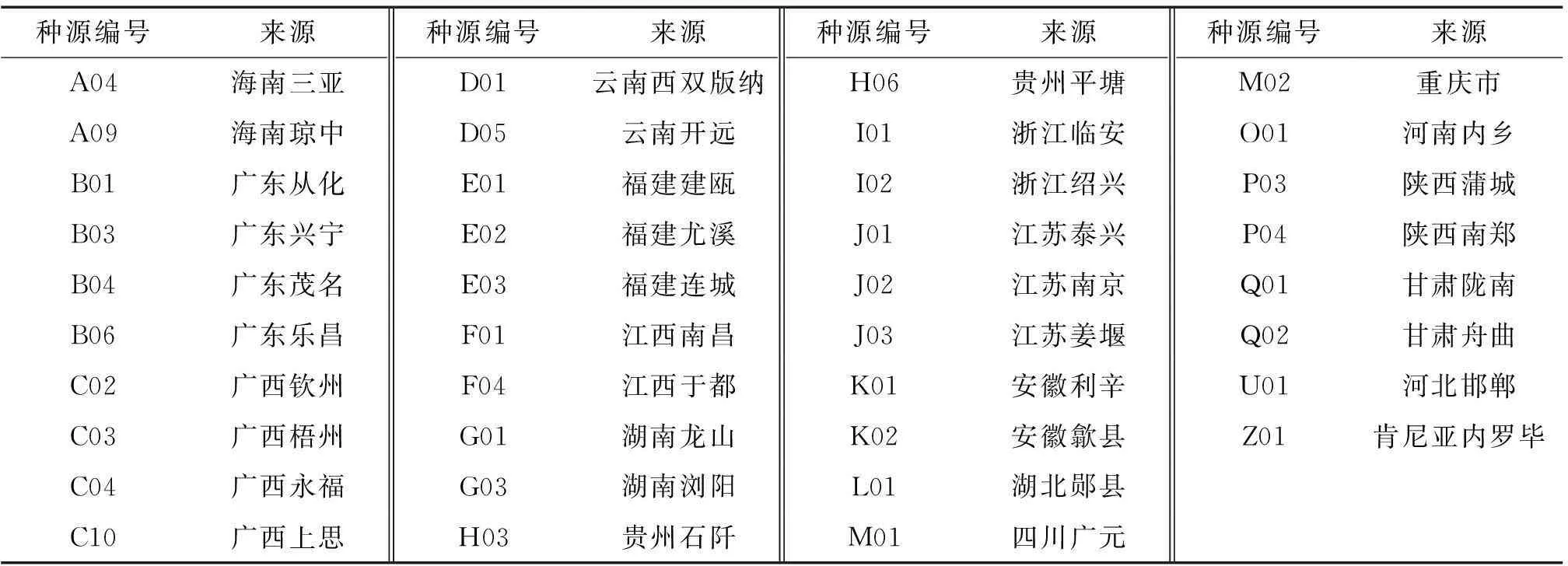
表1 苦楝材料及来源
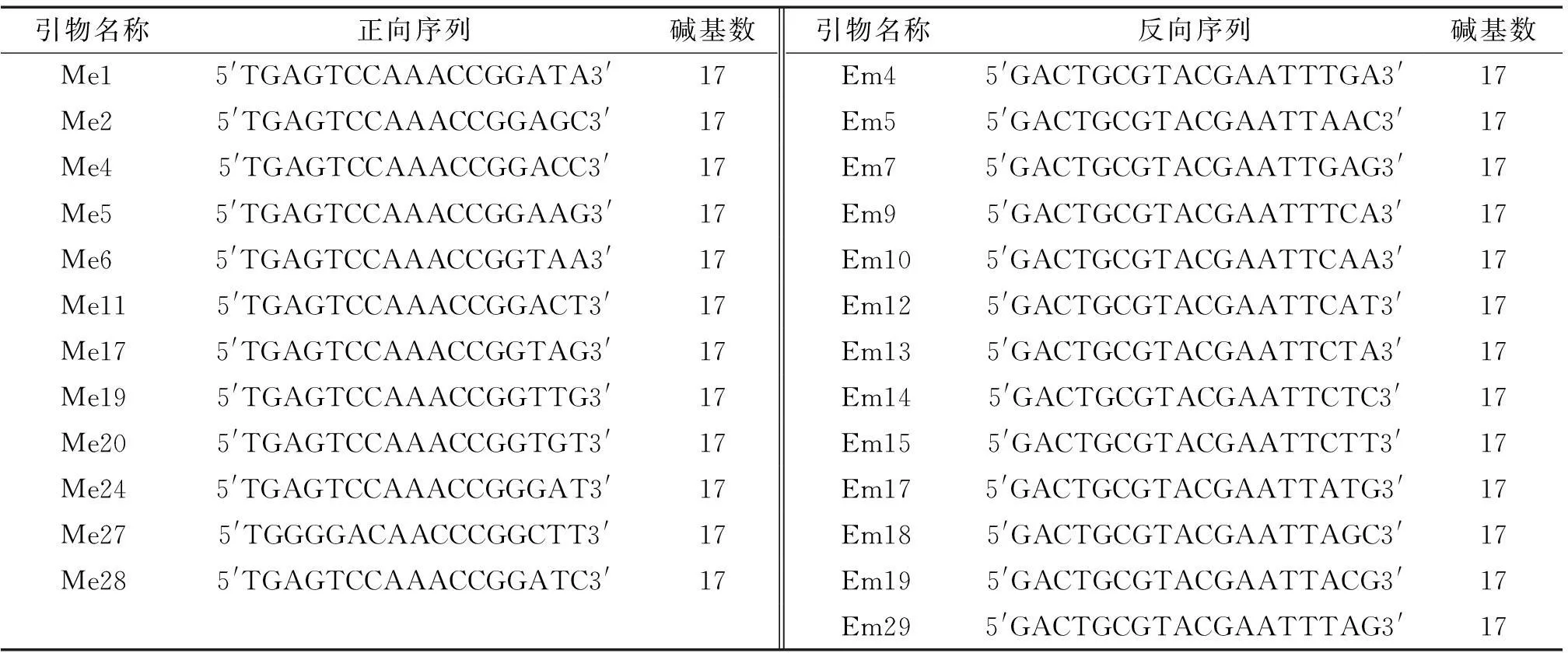
表2 用于苦楝SRAP分析的引物序列
1.3苦楝DNA提取和SRAP-PCR扩增
苦楝基因组 DNA 提取参照上海生工生物工程有限公司柱式基因组 DNA 提取试剂盒说明书。所提取的基因组DNA用8 g·L-1琼脂糖凝胶电泳检测质量,超微量紫外分光光度计检测浓度后稀释至50 ng·μL-1,置于-20 ℃条件下保存备用。通过单因子及正交试验建立并优化苦楝SRAP-PCR最佳反应体系为模板DNA 30 ng、dNTPs浓度0.125 mmol·L-1、Mg2+浓度2.25 mmol·L-1、引物浓度0.48 μmol·L-1、TaqDNA聚合酶0.75 U(25 μL)。SRAP-PCR反应程序为: 94 ℃预变性5 min;94 ℃变性1 min,35 ℃复性1 min,72 ℃延伸1 min,5个循环;94 ℃变性1 min,50 ℃复性1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
1.4数据统计与分析方法
电泳结果统计时将具有相同迁移率的扩增片段,按0/1系统纪录,有带记为1,无带记为0,并参照标准Marker带估计扩增片段的大小,形成0/1矩阵。将图形资料转换成数据资料,并输入Excel 2007中建立0/1数据矩阵,使用NTSYS-pc2.10e软件计算遗传距离和相似系数,使用非加权平均法(UPGMA)进行聚类分析。
2结果与分析
2.1SRAP扩增多态性条带统计
本研究采用20对SRAP引物对苦楝38个不同种源进行扩增,分析结果见表3。由表3可知,引物扩增条带多数集中在100~1 500 bp之间,20对引物组合对全部样品进行分析,共扩增出247条带,其中多态性条带101条,平均多态性百分率为40.89%。20对引物扩增的条带数从5条(Me11/Em29)到17条(Me20/Em7)不等,平均为12.1条。多态性条带的数量从1条(Me11/Em29、Me6/Em29)到12条(Me20/Em7)不等,多态性比率最高的引物组合为Me24/Em14(88.89%),其次为Me20/Em7(70.59%)、Me1/Em9(60.00%);多态性比率最低的引物组合为Me6/Em29(12.50%),总体而言,引物多态性比率较高。
多态性信息量(Polymorphism information content,PIC)是用来衡量不同引物对反应多态性高低的程度,20对引物组合的PIC为0.188~0.488,其中Me1/Em9扩增引物总条带数(15条)、多态性条带数(9条)以及PIC(0.387)均较高,该引物组合可以成为苦楝SRAP分子标记的骨干引物[12],20对引物的平均PIC为0.299,介于0.25~0.50之间,说明所选的SRAP引物可以很好地反映苦楝的遗传多样性[13]。引物Me1/Em9的扩增图谱见图1。
2.238个不同苦楝种源的聚类分析
根据SRAP标记分析结果,对苦楝38个种源间基于Nei’s的遗传距离进行UPGMA聚类分析,从聚类分析结果(图2)可知,以0.350为阈值,38个种源可以分为7类,A04、A09、B01、B04、B06、C02、C03、C10、H03、H06、Z01为第1类,这一类主要分布在海南、广东、广西等地理位置偏南的地区,其中肯尼亚内罗毕的种源Z01也在这一类;B03、E02、E03、F01、F04、I01、J01、J02、K02为第2类,这一类主要分布在广东、福建、浙江、江苏东部沿海省份;E01、G01、G03、I02、J03、K01、L01、M02、P03、P04、U01为第3类,主要分布在湖南、湖北、陕西、河北等地;D01、D05、M01为第4类,主要为云南种源;Q01、Q02为第5类,来自甘肃。O01和C04各为一类,分别来自河南内乡和广西永福。
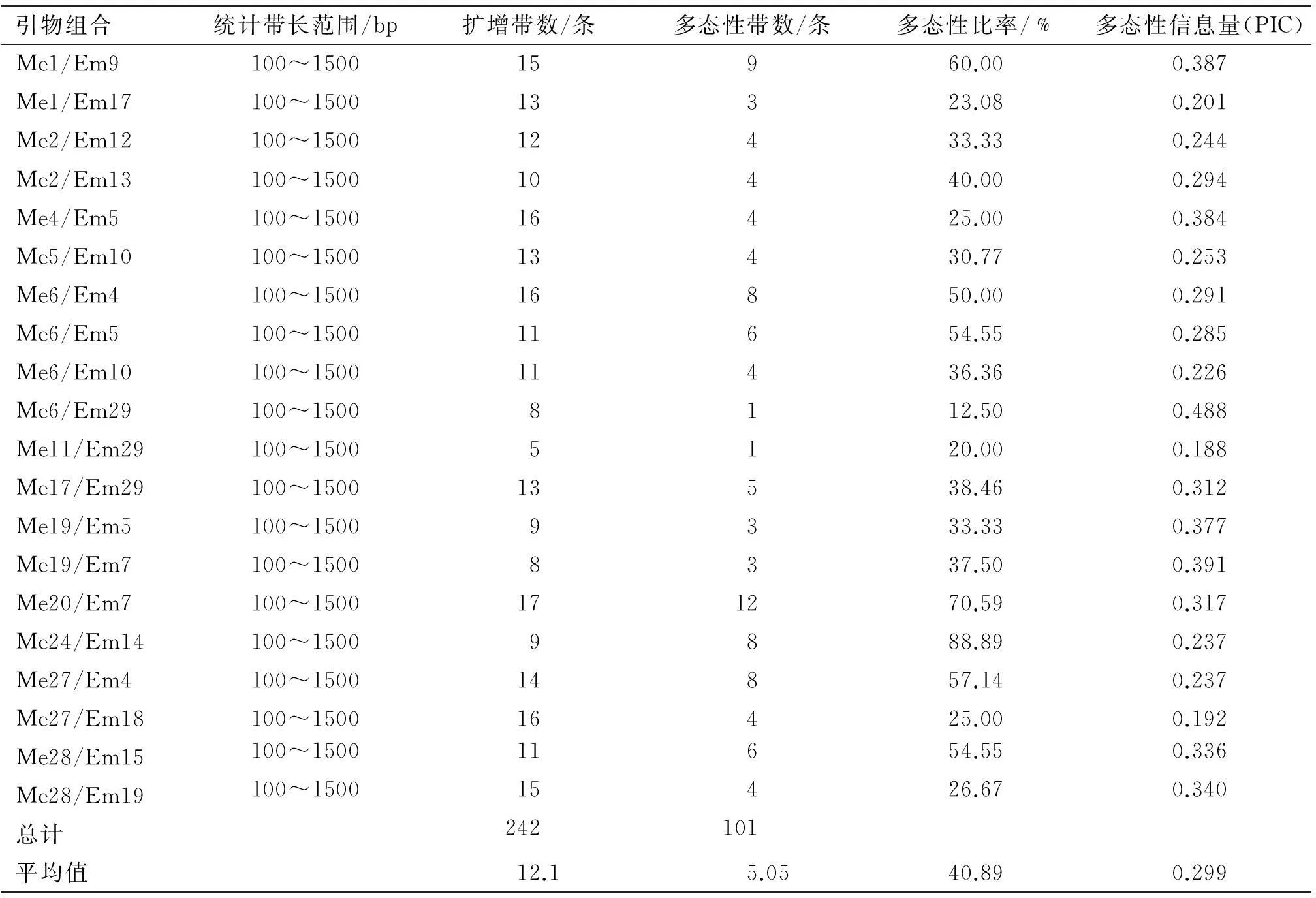
表3 SRAP引物组合扩增信息分析
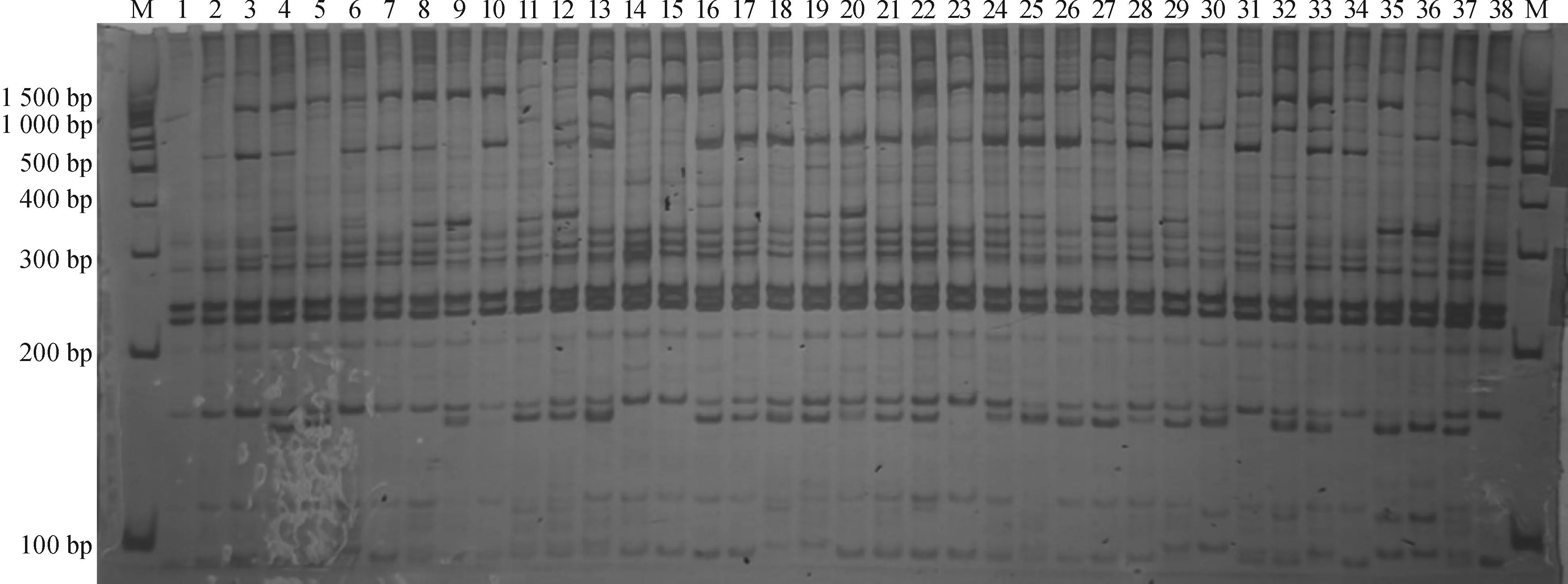
M:100 bp DNA ladder;1~38分别为种源编号A04、A09、B01、B03、B04、B06、C02、C03、C04、C10、D01、D05、E01、E02、E03、F01、F04、G01、G03、H03、H06 、I01、I02、J01、J02、J03、K01、K02、L01、M01、M02、O01、P03、P04、Q01、Q02、U01、Z01的DNA。
图1Me1/Em9引物对苦楝群体材料的扩增聚丙烯电泳图
Fig.1Amplified products of samples from different provenances of Melia azedarach on polyacrylamide gels with the primer combination of Me1/Em9
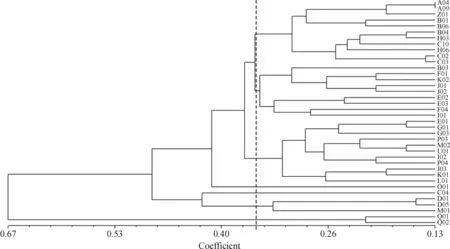
图2 SRAP标记的38个苦楝种源UPGMA聚类图
3讨论
本试验从783对引物组合中筛选获得多态性较好的引物组合20对,这些引物组合多态性百分率平均为40.89%,PIC平均为0.299,说明SRAP分子标记可以较好地应用于苦楝的遗传多样性分析[13],并为充分开发、利用苦楝资源及完善苦楝遗传背景分析奠定基础。通过本试验开发出了多态性比率和PIC均较高的可用于苦楝SRAP分析的骨干引物(Me4/Em5、Me1/Em9),可将大部分种源划分为准确的类型,为快速分析苦楝不同种源提供了方法。
根据SRAP标记分析结果,以0.350为阈值,可将38个苦楝种源划分为7类。其中,O01和C04各为一类,分别来自河南内乡和广西永福。由于这2类仅各含1个种源,代表性不强,为稳妥起见,河南内乡和广西永福暂不独立成类,将其余的36个种源,划分5个类群。苦楝种源类群划分有明显的地理趋势和气候生态特征。例如第1类群的种源来自海南、广东、广西等偏南省份,属于纬度较低,沿海地区的苦楝,这些地方水热条件充足。肯尼亚内罗毕种源聚在此类,这可能因为当地气候条件与我国两广、海南岛的气候更相似;第2类群种源主要分布在广东、福建、浙江、江苏东部沿海省份,其气温和降水量普遍低于第1类种源地;第3类群种源主要分布在湖南、湖北、陕西、河北等地,其气温和降水量低于第2类种源地;第4、5类群分别为云南、甘肃种源,两地区的气候差异很大,与前3类也有较大差异。
将该聚类结果与苦楝果核及种子性状做比对[14],果实主要表型特征为第1类的果实种子形态较小且质量较轻、棱粒较小;第2类的果实果核棱纹明显、果核单果棱数及粒数较少;第3类的果实种子较宽,果核形态近球形且棱纹不明显;第4类的果实种子形状较大且质量较重,果核皮较厚,果核单果棱数较多,但种粒数较少;第5类的果实果核和种子的质量及形态较大,核果皮较厚且棱纹较明显,果核单果棱数及粒数较多。
参考文献:
[1]杨湘.不同果核群苦楝中苦楝素含量变化规律研究[D].南京:南京林业大学,2011.
[2]刘丽云.苦楝栽培技术及应用价值[J].北方园艺,2009(9):144-145.
[3]曾东东.家具用苦楝集成材的研究[D].南京:南京林业大学,2011.
[4]程诗明,顾万春.苦楝遗传资源学研究进展及其展望[J].浙江林业科技,2007,27(2):64-69.
[5]单雪,王秀利,仇雪梅.分子标记及其在海洋动物遗传研究中的应用[J]. 生物技术通讯,2005,16(4): 46.
[6]姚红伟,张立冬,孙金阳,等. DNA分子标记技术概述[J]. 河北渔业,2010(7): 42-46.
[7]程诗明.苦楝聚合群体遗传多样性研究与核心种质构建[D].北京:中国林业科学研究院,2005.
[8]陈羡德.植物源农药原料林树种苦楝良种选育及其遗传多样性分析[D].福州:福建农林大学,2008.
[9]夏海涛.药用苦楝遗传多样性ISSR分析和遗传变异规律研究[D].福州:福建农林大学,2009.
[10]董星光,樊丽,王志刚,等.梨SRAP体系的正交优化研究[J].江苏农业科学,2009(2):51-53.
[11]张晓蕾,张凯旋,杨传平,等.白桦SRAP反应体系的建立与优化[J].东北林业大学学报,2010,38(9):1-3.
[12]令狐斌,侯思宇,孙朝霞,等.苦荞SRAP分子标记体系优化与遗传多样性分析[J].中国农业大学学报,2015,20(1):37-43.
[13]XIE W G, ZHANG X Q.Genetic diversity analysis and transferability of cereal EST-SSR markers to orchardgrass (DactylisglomerataL.) [J]. Biochem Syst Ecol, 2010,38(4):740-749.
[14]陈丽君,邓小梅,丁美美,等.苦楝种源果核及种子性状地理变异的研究[J].北京林业大学学报,2014,36(1):15-20.
【责任编辑柴焰】
Analysis of genetic diversity of Melia azedarach with SRAP markers
CHEN Lijun1, LIU Mingqian2, LIAO Boyong3, LI Juncheng3, CHEN Xiaoyang3
(1 Center for Teaching & Research Base, South China Agricultural University, Guangzhou 510642, China;
2 Preparation Office of South China Agricultural Museum, South China Agricultural University, Guangzhou 510642, China;
3 Guangdong Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm/College of
Forestry and Landscape Architecture, South China Agricultural University, Guangzhou 510642, China)
Abstract:【Objective】 To set up a method for rapid detection of different provenances, to investigate the genetic diversity, and to provide a theoretical basis for development, utilization and selective breeding ofMeliaazedarach.【Method】 Twenty SRAP primer combinations (PCs) with relatively high polymorphisms from 783 PCs were selected to analyze the genetic diversity of 37 provenances from all distribution areas nationwide and 1 provenance from Kenya. 【Result】The results showed 242 clear bands were amplified by 20 PCs, among which 101 bands (40.89%) were polymorphic. The number of bands of each PC ranged from 5 to 17, with an average of 12.1. The polymorphism information content (PIC) values of these PCs ranged from 0.188 to 0.488, with an average of 0.299. Thirty-eight provenances could be divided into 7 categories based on UPGMA (with a threshold value of 0.350), and furthermore, by excluding 2 provenances, the rest 36 provenances could be divided into 5 geographic groups. 【Conclusion】SRAP markers can be used to effectively evaluate the genetic diversity ofMeliaazedarach, and the results of cluster analysis demonstrate clear geographical trends and climatic-ecological characteristics.
Key words:Meliaazedarach; provenance; genetic diversity; SRAP
中图分类号:S792.33
文献标志码:A
文章编号:1001-411X(2016)01-0070-05
基金项目:广东省林业科技创新项目(2011KJCX002)
作者简介:陈丽君(1989—),女,硕士, E-mail:chenlijun0311@163.com;通信作者:陈晓阳(1958—),男,教授,博士,E-mail:xychen@scau.edu.cn
收稿日期:2015-03-13优先出版时间:2015-12-07
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20151207.1133.026.html
陈丽君, 刘明骞, 廖柏勇,等.苦楝SRAP分子标记及遗传多样性分析[J].华南农业大学学报,2016,37(1):70-74.
