模拟中长期微重力和噪声环境对大鼠听功能及内耳毛细胞凋亡的影响△
2016-02-23陈娜吴玮韩浩伦王刚周丽斌王鸿南李保卫丁瑞英刘钢
陈娜 吴玮, 韩浩伦 王刚 周丽斌 王鸿南 李保卫 丁瑞英 刘钢
模拟中长期微重力和噪声环境对大鼠听功能及内耳毛细胞凋亡的影响△
陈娜1吴玮1,2韩浩伦2王刚2周丽斌2王鸿南2李保卫2丁瑞英2刘钢3
【摘要】目的研究模拟中长期微重力和噪声环境对大鼠听功能及内耳细胞凋亡的影响。 方法36只SD大鼠随机分为两组:空白组(6只)和实验组(30只)。实验组给予持续尾部悬吊模拟微重力及飞船舱内噪声(稳态噪声+脉冲噪声)暴露,分别于悬吊及暴露前、悬吊及暴露3天、1周、2周、4周和8周后检测双耳ABR反应阈,并于悬吊及暴露3天、1周、2周、4周和8周取实验动物耳蜗行免疫组化染色观察半胱氨酸天冬氨酸蛋白酶3(caspase-3)在内耳的表达。空白组不做任何处理,常规饲养,于实验前及实验3天、1周、2周、4周和8周分别检测双耳ABR反应阈,并于饲养8周后取耳蜗行免疫组化染色观察。 结果实验前两组大鼠ABR反应阈差异无统计学意义(P>0.05)。实验组大鼠悬吊及噪声暴露后各时间点ABR反应阈较空白组均明显增高(P<0.01),悬吊及暴露4周实验组大鼠ABR反应阈为90.00±4.26 dB SPL,明显高于3天、1周、2周及8周时(P<0.05);悬吊及暴露8周大鼠ABR反应阈(80.00±5.22 dB SPL)有所下降,与暴露2周(85.00±4.77 dB SPL)、4周大鼠比较差异有统计学意义(P<0.01)。悬吊及噪声暴露后大鼠内耳细胞caspase-3的表达较空白组明显增强,且在一定时间内随暴露时间的延长其表达有逐渐增强的趋势,尤以悬吊及暴露4周时最明显,暴露8周时其表达强度较4周时明显下降。 结论模拟中长期微重力和噪声环境对大鼠的听功能有明显损伤,且与内耳细胞凋亡呈相同的趋势;微重力和噪声因素造成的听功能损伤可能与内耳细胞的凋亡有关。
【关键词】微重力;噪声;听性脑干反应;细胞凋亡;半胱氨酸天冬氨酸蛋白酶-3
网络出版时间:2015-12-2815:14
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20151228.1514.044.html
国外已有研究[1]证实,飞船内噪声对宇航员听觉有明显的损伤作用,高达156 dB A[2]或190 dB A[3]的脉冲噪声可造成一定的听力缺失;早期的实验[4]也证明,强度为98.0±2 dB A的风洞稳态噪声可导致豚鼠听损伤。但以上大多为短期实验,研究的是独立的模拟噪声因素,而失重也是飞船飞行过程中存在的重要特殊状态,其导致的听力异常[5]将直接缩短宇航员的职业寿命并影响其生活质量。因此,本研究拟通过观察模拟中长期微重力和噪声环境对大鼠听功能及内耳细胞凋亡的影响,探讨噪声和失重两种因素同时作用造成听损伤的可能机制。
1材料与方法
1.1实验动物及分组选取健康SD大鼠36只(由北京市海淀区兴隆实验动物养殖场提供),均为雄性,体重180~200 g,耳廓反射灵敏,鼓膜标志清晰,无强噪声暴露及耳毒性药物使用史。随机分为两组:空白组(6只)和实验组(30只)。
1.2实验方法两组大鼠均进行听性脑干反应(ABR)测试,测试后实验组给予持续尾部悬吊模拟微重力及飞船舱内噪声(稳态噪声+脉冲噪声)暴露,分别于悬吊及噪声暴露3天、1周、2周、4周和8周后检测双耳ABR反应阈,并于暴露3天、1周、2周、4周和8周取实验动物耳蜗行免疫组化染色观察caspase-3在内耳的表达。空白组不做任何处理,常规饲养8周,于3天、1周、2周、4周和8周检测双耳ABR反应阈,并于饲养8周后取耳蜗行免疫组化染色观察。
1.2.1模拟失重方法实验组大鼠采用目前最常用的头低位模拟失重法[6](Morey-Holton法)进行持续尾部悬吊模拟微重力实验,动物分为5组,每组6只,分别悬吊3天、1周、2周、4周及8周,尾部利用胶带缠于悬吊的铁丝上,保持动物头低位,后肢完全离地,前肢承担部分身体重量,身体纵轴与水平面呈30°夹角;悬吊期间保证动物可以自由活动、自由进食。
1.2.2噪声暴露方法稳态噪声由白噪声信号发生器(UZ-3型)发出,经均衡器(MEQ)、功率放大器(PA-1000)传到扬声器(YZ20-7),并将扬声器放置于大鼠笼前部;稳定噪声声强用BK2250手持式分析仪测量,测得其声强为72±2 dB SPL;脉冲噪声由气动激波管产生传到传声器(BK4136),峰值声强为160 dB SPL,有效持续时间为30 ms,发数为3,重复间隔为1 min;脉冲噪声声强由BK2209精密脉冲声级计测量,用TDS2022数字示波器记录波形。每天持续给予实验组动物8小时稳态噪声暴露,按照每个时间点5只动物分别暴露3天、1周、2周、4周、8周,于每个时间点稳态噪声暴露结束后各组分别给予脉冲噪声暴露一次(含3 发)。
1.2.3ABR测试各组大鼠给予咪唑安定(80 mg/kg)和盐酸赛拉嗪注射液(200 mg/kg)进行肌肉注射麻醉(麻醉深度达角膜反射消失,必要时给予总量的20%~30%维持),应用听性脑干反应仪在隔声静电屏蔽室内检测短声诱发(滤波带宽80~3 000 Hz,叠加1 024次,扫描10 ms)的双耳ABR反应阈,颅顶为记录电极,测试耳为参考电极,鼻尖处为地线;刺激强度为5~97 dB SPL,间隔5 dB,以重复性好、比较稳定的波Ⅲ为标准判断反应阈。测试及麻醉复苏过程中保持环境温度在38 ℃左右并用热水瓶保持大鼠体温恒定。
1.2.4形态学及免疫组化观察方法动物于相应时间点行ABR检测后取耳蜗,将一侧耳蜗置于4%多聚甲醛液中,在解剖显微镜下摘除镫骨,用细针于蜗顶钻一小孔,将4%多聚甲醛缓慢灌流蜗管内并置于4%多聚甲醛中固定,4 ℃冰箱过夜后用PBS漂洗3次,10%EDTA脱钙2周,耳蜗石蜡包埋,平行连续切片,每片厚度3~5 μm,分别做HE染色及caspase-3(caspase-3抗体来自于美国abcam公司)免疫组化观察,免疫组化显色结果由2名以上病理科技师进行双盲判定。
1.3统计学方法数据采用SPSS 19.0统计学软件处理,各组ABR反应阈比较采用方差分析,以P<0.05为差异有统计学意义。
2结果
2.1各组ABR反应阈比较(表1)实验前各组ABR反应阈差异无统计学意义(P>0.05)。实验组大鼠悬吊及噪声暴露后各时间点ABR反应阈较空白组均明显增高(P<0.01),悬吊及噪声暴露4周的大鼠ABR反应阈最高,与暴露3天、1周、2周及8周的大鼠ABR反应阈比较差异有统计学意义(P<0.05);暴露8周大鼠的ABR反应阈有所下降,与暴露2周、4周大鼠比较,差异有显著统计学意义(P<0.01)。

±s)
注:*与空白组同时间点比较,F=82.91,P<0.01;△与实验组其他各时间点比较,P<0.05;#与实验组2周、4周比较,P<0.05
2.2各组耳蜗Corti器HE染色结果空白组大鼠Corti器毛细胞完好且排列较为整齐,实验组大鼠耳蜗Corti器毛细胞均有不同程度的紊乱甚至缺失,且悬吊及噪声暴露时间越长,大鼠Corti器的损伤越明显(图1)。
2.3各组内耳细胞内凋亡标志物caspase-3免疫组化观察结果空白组Corti器毛细胞结构完整清晰,且无caspase-3的阳性表达;实验组Corti器均有caspase-3的阳性表达,且一定范围内暴露时间长的动物阳性表达更加明显,尤以暴露4周的大鼠阳性表达最强(图2)。
空白组螺旋韧带和血管纹上caspase-3为阴性表达,实验组该部位caspase-3均为阳性表达,且在一定时间内表达程度随时间而渐强;与阳性最强的暴露4周大鼠相比,暴露8周的大鼠caspase-3的表达略有下降但仍明显强于空白组(图3)。
空白组螺旋神经节中caspase-3为阴性表达,实验组螺旋神经节均为阳性表达,且在一定时间内随暴露时间的延长而有逐渐增强的趋势,暴露4周的大鼠阳性表达最强,暴露8周的大鼠表达弱于暴露4周大鼠(图4)。
3讨论
以往对听觉系统损伤的研究[7,8]大多集中于噪声环境下,多数是针对单纯噪声环境对听功能的影响,少有模拟噪声联合失重的复合环境。而失重也是飞船中重要的状态,会给人体各种器官造成影响[9,10],以往的实验认为,失重因素对于听觉系统的影响虽不及噪声明显,但仍能造成一定的听力损伤[11]。为此,本实验模拟稳态、脉冲噪声及微重力的复合环境,以期更贴近飞船中的真实环境。
既往研究证实,噪声会引起人体各系统的损伤[12],特别是听觉系统,甚至可以造成不可逆的永久性听损伤。程浩等[13]认为,持续暴露在较高水平的噪声中(主频率在0.8 kHz以上)会损伤内耳的听觉细胞,产生不可逆的听损伤。从文中结果看,实验组各时间点ABR阈值均较空白组明显增高,且在一定时间范围内随模拟失重与噪声暴露时间的延长,听损伤逐渐明显。说明中长期暴露于飞船复合环境中,在一定时间范围内可能会导致听觉系统的损伤。另外,本研究结果显示空白组第8周时ABR反应阈略有升高,可能与8周时正常大鼠听觉出现老化现象或多次麻醉多次测听有关。事先给予较低强度的噪声暴露后,动物适应后会对更高强度的噪声产生耐受,从而减少对听觉系统的损伤程度,这种效应即为噪声习服[14],Miller等[15]在栗鼠及其它动物身上均证明了这种现象。从文中结果可见悬吊及噪声暴露4周的实验组大鼠ABR反应阈最高,8周组ABR反应阈有所下降,可见长期(8周)暴露于模拟稳态、脉冲噪声和微重力复合环境中的动物,听损伤较轻且有所恢复;可能是由于大鼠暴露于模拟微重力及持续稳态噪声(72±2 dB SPL)环境中,对该环境产生习服,减轻了稳态噪声后给予的脉冲噪声(160 dB SPL)造成的听损伤,对听觉有一定保护作用,使得ABR反应阈有所降低。其次,听觉中枢在持续稳态噪声暴露之后呈现一定的可塑性,朱小青等(2014)釆用电生理学离体脑片技术,观察持续噪声暴露(65 dB SPL)对诱导大鼠听皮层长时程增强效应的影响,结果显示连续噪声暴露改变了听皮层(后部)的突触可塑性,呈现类似于成长发育期的“重启”阶段,使听觉中枢在一定程度上得到重塑。考虑悬吊及噪声暴露8周的动物处于稳态噪声及微重力环境的时间长于其他时间点动物,噪声习服对脉冲造成的听损伤的保护作用最明显,并且诱导的长时程增强效应更加明显,从而导致8周组大鼠ABR反应阈比4周、2周组有所降低。

图1 空白组及实验组不同时间点内耳Corti器HE染色结果(×40)

图2 空白组及实验组不同时间点内耳Corti器caspase-3免疫组化染色结果(×40)
噪声所致的听觉系统损伤与内耳Corti器及螺旋神经节等细胞的凋亡有关。细胞凋亡是为维持内环境稳定,在多基因控制下主动进行的复杂但有序的死亡过程,虽然目前还不确定对凋亡过程的调控机理,但国内外研究[16~18]已经证实caspase水解酶家族(caspase-3、caspase-8等)、Fas、bcl-2家族等在凋亡过程中发挥了重要作用。生物体内有多个信号可以诱导细胞凋亡,其共同的特征之一就是在凋亡早期这一系列细胞内蛋白水解酶的活化;通过对caspase-3的定性检测可以了解细胞凋亡的程度和时间。caspase-3以无催化活性的酶原形式存在于胞质中,当细胞进入凋亡过程时,它去除N端前肽,进入活化第一步,经由特异的Asp残基处的蛋白水解作用而被激活,从而产生了由蛋白水解作用形成的caspase-3自我放大级联反应,开启细胞内的死亡程序,进而裂解DNA降解产物损伤细胞[18];凋亡程序一旦开始,便激活级联反应,发生不可逆的凋亡。Hu等[19]将灰鼠暴露在110 dB SPL 4 kHz的窄带噪声环境中1 h后,发现耳蜗Corti器存在大量缺失、凋亡和坏死的细胞,同时还观察到caspase-3在Corti器中呈阳性表达,与本实验结果一致。本实验显示凋亡标志物caspase-3在空白组内耳细胞的表达为阴性,在实验组内耳细胞的表达为阳性,且在一定时间范围内暴露时间越长其表达越明显,尤以4周组大鼠阳性表达最强,说明一定时间范围内内耳细胞凋亡程度与噪声累积量成正比,8周组大鼠其阳性表达较4周组弱,与听功能检测结果一致。吴玮等[20]研究显示,噪声习服可减少外毛细胞纤毛团状变和内毛细胞静纤毛的缺失脱落,从而有效减轻高强度风洞噪声对动物听器官的损伤。文中暴露8周的大鼠内耳细胞caspase-3阳性表达较4周弱,可能与稳态噪声暴露的持续时间不同有关,经过了8周持续稳态噪声暴露,给予脉冲噪声时大鼠内耳毛细胞的凋亡程度变弱;相对于8周组,4周及更短时间组大鼠给予稳态噪声的时间较短,习服效应较弱,对听觉损伤的保护效应就随之减弱。

图3 空白组及实验组不同时间点内耳血管纹和螺旋韧带caspase-3免疫组化染色结果(DAB法×40)
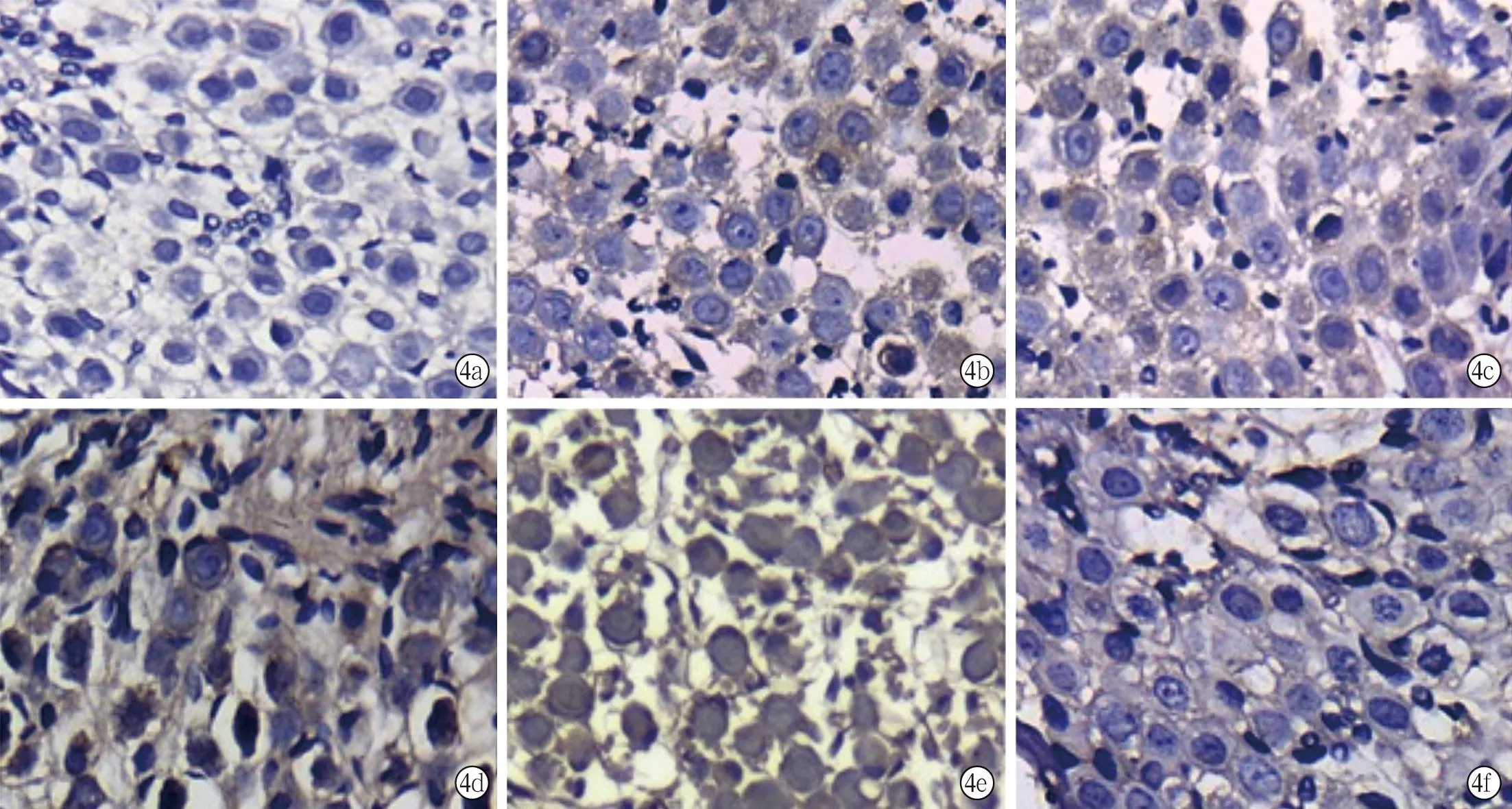
图4 空白组及实验组不同时间点内耳螺旋神经节caspase-3免疫组化染色结果(DAB法×40)
总之,本研究结果显示,模拟中长期微重力和噪声环境下大鼠听力有一定程度的损伤,且在一定时间范围内暴露时间越长的动物听损伤越明显,且ABR反应阈与caspase-3在内耳的表达水平相一致。提示长期暴露于飞船环境中可造成一定程度的听损伤,噪声习服会减轻一部分听觉的损伤,因此,可以考虑合理利用噪声习服的作用减少听觉损害。此类听损伤与内耳毛细胞凋亡有关,可以通过终止或者延缓内耳细胞凋亡减轻听觉的损伤,具有一定的实际意义,但对于听觉损伤的机理及飞船工作人员的保障还有待进一步研究。
参考文献4
1Roller CA, Clark JB. Short-duration space flight and hearing loss[J]. Otolaryngol Head Neck Surg, 2003, 129: 98.
2孙晓飞,廖华,杨琨,等.脉冲噪声暴露后大鼠听皮层神经颗粒素的表达研究[J].听力学及言语疾病杂志, 2012, 20:250.
3Karl N, Sebastien D. Evaluation of hearing protection devices with high-amplitude impulse noise[J].Acoustical Society of America Journal, 2011, 130:2433.
4王方圆, 吴玮, 王鸿南,等. 模拟风洞噪声对豚鼠听功能及内耳细胞凋亡的影响[J]. 听力学及言语疾病杂志,2012,20:565.
5Fumiko N, Motoki K, Akihiko I. Effects of microgravity on blood flow in the upper and lower limbs[J]. Aerospace Science and Technology, 2014,4:20.
6Morey-Holten ER, Globus RK. The hindlimb unloading rodent model:technical aspects [J]. J Appl Physiol, 2002,92:1367.
7何延军,刘亚光,李道德,等. 脉冲与脉冲稳态复合型强噪声对豚鼠听觉器官的影响[J]. 航天医学与医学工程, 2004, 17: 411.
8Sandler H, Vernikos J, Wegmann HM, et al. Introduction to counter measures: extended manned space flight[J]. Acta Astronaut, 1995, 35: 247.
9阎露, 钱维权, 李道德. 噪声、模拟失重复合作用对豚鼠脑干听觉诱发电位的影响[J].航天医学与医学工程, 1994,7(增刊):s52.
10Sandler H, Vernikos J, Wegmann HM, et al. Introduction to counter measures: extended manned space flight[J]. Acta Astronaut, 1995, 35:247.
11吴玮, 韩浩伦, 余萌,等.失重和飞船舱内噪声复合因素对豚鼠内耳Caspase-3表达的影响[J]. 中华耳科学杂志,2013,11:451.
12曲雁, 李云, 丁大连,等.噪声性耳聋的研究进展[J]. 河北医科大学报,2008,4:360.
13程浩, 徐怡萍, 李宏. 噪声对飞行人员听觉系统影响的调查分析[J]. 中国疗养医学, 2011,20:6.
14余萌, 吴玮, 韩浩伦,等. 噪声习服对风洞噪声致听觉损伤的保护作用[J]. 听力学及言语疾病杂志, 2013,21:375.
15Miller JD, Watson CS, Covell WP. Deafening effect of noise on the cat[J]. Acta Tolaryngol (Stockh), 1963,176(Suppl): S544.
16Henderson D, Suramaniam M, Boettcher FA, et al. Individual susceptibility to noise-induced hearing loss:an old topic revisited[J]. Ear Hear, 1993,14:152.
17Huang P, Oliff A. Signaling pathways in apoptosis as potential targets for cancer therapy[J]. Trends Cell Biol, 2001, 11: 343.
18许丽娟, 龚树生, 汪吉宝,等. 内耳免疫反应中细胞凋亡及caspase- 3表达的研究[J]. 中国医师杂志, 2005,7:178.
19Hu BH, Henderson D, Nicotera TM. Involvement of apoptosis in progression of cochlear lesion following exposure to intense noise[J]. Hear Res,2002,166:62.
20吴玮, 韩浩伦, 王方园,等. 习服后风洞噪声相关听力损失易感性及其耳蜗超微结构变化[J]. 中华耳科学杂志, 2013, 11:288.
(2015-03-27收稿)
(本文编辑雷培香)
·实验研究·
The Effects of Mid-long Term Simulated Microgravity and Noises on the Auditory
Functions and the Cell Apoptosis in Inner Ear of Rats
Chen Na*, Wu Wei, Han Haolun, Wang Gang, Zhou Libin,
Wang Hongnan, Li Baowei, Ding Ruiying, Liu Gang
(*The 306thHospital of PLA-Peking University Teaching Hospital, Beijing,100101,China )
【Abstract】ObjectiveTo investigate the effects of mid-long term simulated microgravity and noises on the auditory functions and the cell apoptosis in inner ear of rats. MethodsThirty-six rats were randomly divided into control group(n=6) and experimental group(n=30). The experimental group was exposed to 30°head down tilt as simulated microgravity and noises including steady-state noise which was 72±2 dB SPL and impulse noise up to 160 dB SPL of spaceship environment. The control group was kept in normal conditions without exposure to microgravity and noise. Bilateral auditory brainstem response (ABR) thresholds were tested before and after 3-days, 1-week, 2-weeks, 4-weeks and 8-weeks exposure, respectively, and examine expression of caspase-3(an apoptotic marker) in the inner ear hair cells by immunohistochemical staining.ResultsThe ABR thresholds of all rats had no differents before experiment(P>0.05). The experimental group was significantly higher than those of in control group(P<0.01). The rats exposed to microgravity and noises for 4 weeks showed the highest ABR threshold
△全军十二五重大课题子课题(AWS11J003)资助
1北京大学解放军306医院教学医院(北京100101);2解放军306医院耳鼻咽喉头颈外科;3中国航天员科研训练中心
shifts(86.25±4.83 dB) in the experimental group(P<0.05). After 8-weeks exposure, the rat ABR threshold shifts(74.10±5.45 dB) were lower and significantly lower than 2-weeks and 4-weeks(P<0.01). The damage has the same tendency with the cell apoptosis condition. The caspase-3 expression in the experimental group was positive in the inner ear cells. The expression had a growing tendency with the exposure time, especially after 4 weeks exposure. The expression of caspase-3 after 8-weeks exposure was significantly lower than 4-weeks. The auditory damage of 8-weeks exposure was significantly lower than 4-weeks and sound conditioning or certain recovery might have been involved.ConclusionThe environment of mid-long term simulated microgravity and inboard noises of spaceship leads to obvious damages to the auditory functions of the rats and it may caused by the cell apoptosis in the inner ear .
【Key words】Microgravity;Noise;Auditory brainstem response;Cell apoptosis;Caspase-3
通讯作者:吴玮(Email:entwuwei@126.com)
作者简介:陈娜,女,山东人,硕士研究生,主要研究方向为特种耳科学及临床。
【中图分类号】R764.43+3
【文献标识码】A
【文章编号】1006-7299(2016)01-0039-06
DOI:10.3969/j.issn.1006-7299.2016.01.010
