微量肉汤稀释法比较分析不同培养时间念珠菌属对唑类药物的敏感性
2016-02-22郭莉娜徐志鹏王瑶王贺赵颖肖盟徐英春
郭莉娜 徐志鹏 王瑶 王贺 赵颖 肖盟 徐英春
(中国医学科学院 北京协和医院检验科,北京 100730)
·论著·
微量肉汤稀释法比较分析不同培养时间念珠菌属对唑类药物的敏感性
郭莉娜 徐志鹏 王瑶 王贺 赵颖 肖盟 徐英春
(中国医学科学院 北京协和医院检验科,北京 100730)
目的 探讨微量肉汤稀释法检测念珠菌属对唑类药物的体外敏感性时,培养24 h和48 h读取MIC值的差异。方法 微量肉汤稀释法检测653株念珠菌对氟康唑、伏立康唑和伊曲康唑的体外药物敏感性,分别于24 h和48 h读取MIC值,比较不同孵育时间所得MIC总一致率 (EA)、敏感性判定一致率 (CA)及敏感性判定错误率 (Error)。结果 绝大多数念珠菌培养24 h能够生长充分并进行MIC值读取;孵育24 h和48 h读取MIC值总EA较好,分别为:氟康唑 (91.9%),伏立康唑 (92.0%),伊曲康唑 (95.6%);CA分别为氟康唑 (96.9%),伏立康唑 (90.4%),伊曲康唑 (88.2%),不同菌种类型CA有差异;未发现极严重错误 (VME)的结果,错误多为一般错误 (MiE),653株菌敏感性判定错误率ME/MiE分别为氟康唑 (1.7%/2.9%)、伏立康唑 (2.0%/10.6%)和伊曲康唑 (1.5%/13.0%)。结论 微量肉汤稀释法检测念珠菌属对唑类药物体外敏感性时,孵育24 h与48 h MIC值一致率较好,24 h读取MIC值可缩短药敏报告时间,减少拖尾现象导致的判读错误。
微量肉汤稀释法;药敏试验;念珠菌;唑类;MIC值
[Chin J Mycol,2016,11(6):332-336]
近几十年来,随着侵袭性真菌感染逐年增多,抗真菌药物的选用以及真菌耐药现象已成为临床实际工作中的一个重要难题,特别是对于免疫受损人群[1]。临床微生物实验室积极开展真菌体外药物敏感性检测对临床医生合理使用抗真菌药物、了解本地区真菌耐药特征及流行病学研究均提供了充分的理论依据和数据支撑。真菌体外药物敏感性检测不仅有助于选择临床治疗可能有效的药物,更重要的功能是避开临床极有可能无效的药物,即中介或耐药。
目前多种方法可用于念珠菌体外药物敏感性检测,其中美国临床和实验室标准化委员会 (CLSI)推荐的微量肉汤稀释法被认为是金标准方法,该标准详细规定了微量肉汤稀释法的操作流程及药敏判定折点。早期的标准文件M27-A3[2]指出氟康唑的MIC值读取时间可以是24 h或48 h,但药敏折点是基于48 h MIC值 (CLSI M27-S3)[3],而伏立康唑和伊曲康唑的MIC读取时间是48 h。近来CLSI委员会基于24 h培养制定了新的敏感性判定折点 (CLSI M27-S4)[4]及流行病学折点 (ECVs)[5],推荐对绝大多数念珠菌来说,孵育24 h可以生长充分并进行MIC值读取,这样既可以为临床更快地报告药敏结果,又可以降低实验室工作人员劳动量,提高工作效率。
那么究竟24 h和48 h读取MIC有什么差异?本研究将从以下三个方面对微量肉汤稀释法检测念珠菌对唑类药物体外敏感性时孵育24 h和48 h MIC值进行比较:①MIC值总一致率 (essential agreement,EA)。②敏感性判定一致率 (categorical agreement,CA)。③敏感性判定错误率 (Errors),探讨对于念珠菌属,培养24 h和48 h读取MIC值一致率情况。
1 材料与方法
1.1 菌株来源
2012~2013年从各类临床标本中分离到的念珠菌共653株,其中包括白念珠菌364株,光滑念珠菌89株,热带念珠菌90株,近平滑念珠菌90株,克柔念珠菌8株,葡萄牙念珠菌4株,季也蒙念珠菌8株;质控菌株ATCC22019近平滑念珠菌和ATCC6258克柔念珠菌。
1.2 材料与仪器
氟康唑、伏立康唑、伊曲康唑标准物质 (中国食品药品检定研究院);科玛嘉显色培养基 (法国科玛嘉公司);沙氏培养基 (英国OXOID公司);RPMI 1640培养基,含谷氨酰胺不含碳酸氢盐并以酚红为指示剂,使用0.165 mol/L MOPS缓冲液调pH7.0±0.1 (德国sigma-aldrich公司);无菌U型96孔板 (江苏省海门盛泰实验器材厂);全自动加样仪器Sensititre AIM○R(赛默飞世尔科技公司)。
1.3 方法
菌种鉴定 所有菌株经科马嘉显色培养基传代培养进行初步鉴定,纯培养物采用MALDI-TOF MS (Vitek MS,法国生物梅里埃公司)质谱仪进行准确鉴定,质谱仪鉴定可信度低者或显色表型与质谱仪鉴定结果不一致的菌株采用rDNA内转录间隔区 (internal transcribed spacer,ITS1,5.8S,ITS2)序列分析的方法准确定种,引物序列见文献[6]。
敏感性检测 微量肉汤稀释法操作严格按照美国临床和实验室标准化委员会 (CLSI)推荐的方法M27-A3[2]进行,抗真菌药物浓度范围:氟康唑0.125~64 μg/mL,伏立康唑0.031 3~16 μg/mL,伊曲康唑0.031 3~16 μg/mL,孵育条件为35℃空气培养箱,24 h和48 h各进行一次读数,结果判读与生长对照孔相比50%抑制的MIC值,氟康唑和伏立康唑敏感性判定折点参考文件CLSI M27-S4[4],对于暂无可参考敏感性判定折点的菌种或抗真菌药物参考文献报道的流行病学折点 (ECVs)[5]。
质量控制 每批次微量肉汤稀释法药敏试验,质控菌株ATCC22019近平滑念珠菌和ATCC6258克柔念珠菌随试验菌株平行操作,质控菌株24 h和48 h MIC值范围参考CLSI文件M27-S4[4],质控菌株超出参考范围时的药敏结果不参加最后统计分析。
结果分析 按照文献[7-9]报道的计算方法,培养24 h和48 h MIC值总一致率 (Essential Agreement,EA):对每一种念珠菌类型,24 h和48 h读取的MIC值差异不超过两个稀释度 (包含)的菌株占总测定株数的比例;敏感性判定一致率 (categorical agreement,CA):按照CLSI M27-S4敏感性判定折点及文献中报道的流行病学折点[4-5],对每一种念珠菌类型,24 h和48 h读取的MIC值敏感性判定完全一致 (均为敏感、中介或耐药)的菌株占总测定株数的比率;敏感性判定错误率 (Errors):对每一种念珠菌类型,以培养24 h敏感性判读结果为参考,极严重错误率 (Very Major Errors,VME):24 h检测结果为耐药,48 h为敏感的菌株占总测定株数的比率 (假敏感);严重错误率 (Major Errors,ME):24 h检测结果为敏感,而48 h为耐药的菌株占总测定株数的比率 (假耐药);一般错误率 (Minor Errors,MiE):24 h为耐药或敏感,而48 h为中介 (SDD),或者24 h的结果为中介 (SDD),48 h为敏感或耐药的菌株占总测定株数的比率。参照美国食品药品监督管理局 (FDA)关于抗菌药物敏感性检测系统评价标准[7,10],极严重错误率不超过1.5%,严重错误率不超过3%。
2 结 果
2.1 质控结果
质控菌株ATCC22019近平滑念珠菌和ATCC6258克柔念珠菌随试验菌株平行操作,共测定6次,经24 h和48 h培养,所测得的MIC值均在规定的范围内。
目前,城市轨道交通应急疏散系统的指挥引导,主要依赖指示标志与标志灯来实施。但该系统存在技术缺陷和条件限制,因此亟需采用更好的技术手段来进行突发事件时的应急疏散指挥与引导,以尽可能减少事件发生时造成的人员伤害。大功率参量阵定向扬声器的技术较为成熟,为解决上述问题提供了有效的技术手段。
2.2 MIC值总一致率 (EA)
微量肉汤稀释法检测653株念珠菌对三种唑类药物体外敏感性时,孵育24 h和48 h读取MIC值对不同种念珠菌总一致率 (EA)分别为氟康唑 (74.4%~100%)、伏立康唑 (87.5%~100%),伊曲康唑 (82.2%~100%),结果见表1。对白念珠菌、光滑念珠菌、热带念珠菌和葡萄牙念珠菌,三种唑类药物24 h和48 h读取MIC值差异较小,而对于近平滑念珠菌、克柔念珠菌和季也蒙念珠菌来说,24 h和48 h读取MIC值差异较明显,EA多数低于90%。
表1 微量肉汤稀释法检测653株念珠菌对三种唑类药物的体外敏感性,孵育24 h和48 h后MIC值比较
Tab.1 Susceptibilities of 653Candidaisolates to three azoles as determined by the CLSI broth microdilution method after 24 h and 48 h of incubation
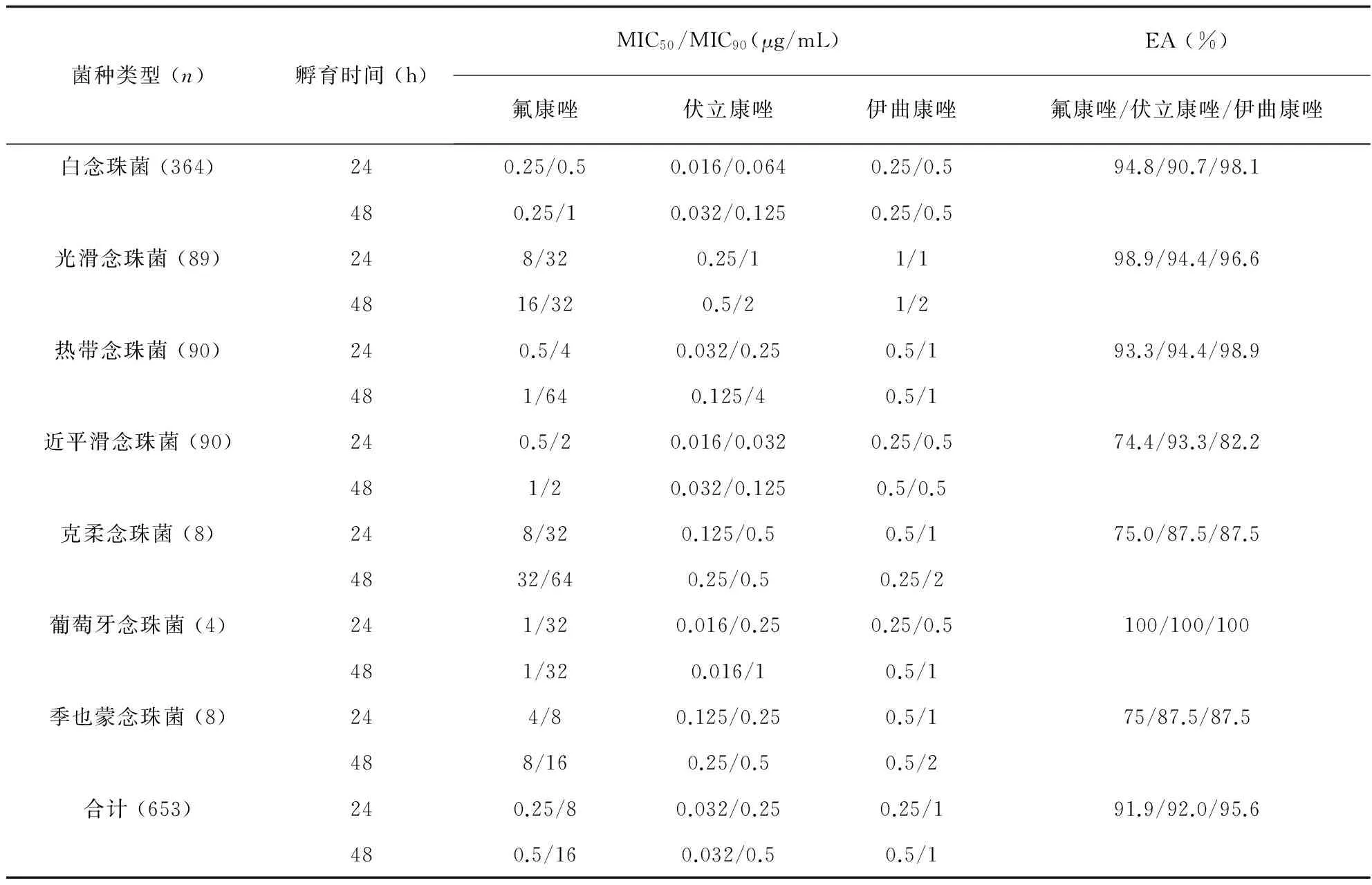
菌种类型(n)孵育时间(h)MIC50/MIC90(μg/mL)EA(%)氟康唑伏立康唑伊曲康唑氟康唑/伏立康唑/伊曲康唑白念珠菌(364)240.25/0.50.016/0.0640.25/0.594.8/90.7/98.1480.25/10.032/0.1250.25/0.5光滑念珠菌(89)248/320.25/11/198.9/94.4/96.64816/320.5/21/2热带念珠菌(90)240.5/40.032/0.250.5/193.3/94.4/98.9481/640.125/40.5/1近平滑念珠菌(90)240.5/20.016/0.0320.25/0.574.4/93.3/82.2481/20.032/0.1250.5/0.5克柔念珠菌(8)248/320.125/0.50.5/175.0/87.5/87.54832/640.25/0.50.25/2葡萄牙念珠菌(4)241/320.016/0.250.25/0.5100/100/100481/320.016/10.5/1季也蒙念珠菌(8)244/80.125/0.250.5/175/87.5/87.5488/160.25/0.50.5/2合计(653)240.25/80.032/0.250.25/191.9/92.0/95.6480.5/160.032/0.50.5/1
注:EA.MIC总一致率
2.3 敏感性判定一致率 (CA)
参考CLSI最新敏感性判定折点及流行病学折点,孵育24 h和48 h后敏感性判定见表2。MIC值差异与敏感性判定未发现确定的相关性,如检测白念珠菌和葡萄牙念珠菌对伊曲康唑以及光滑念珠菌和季也蒙念珠菌对伏立康唑的体外敏感性时,尽管孵育24 h和48 h MIC值一致率 (EA)高达98.1%、100%和94.4%、87.5%,但敏感性判定一致率 (CA)仅79.7%、75%和67.4%、62.5%,孵育48 h后判读结果更耐药;虽然孵育24 h和48 h,近平滑念珠菌对氟康唑和伊曲康唑MIC差异 (EA)较大,但并未影响敏感性判定结果。
2.4 敏感性判定错误率 (Errors)
相对于24 h检测结果,48 h检测结果判定错误率见表3。未发现极严重错误 (VME)的结果,严重错误率除伊曲康唑对光滑念珠菌敏感性检测为3.4%,略高于美国FDA标准外,其余均能满足要求;错误多数为一般错误 (MiE),对白念珠菌和葡萄牙念珠菌,MiE多见于伊曲康唑 (19.0%);对光滑念珠菌,MiE易见于对伏立康唑的体外敏感性 (32.6%);热带念珠菌和季也蒙念珠菌对三种唑类药物严重错误率极低,一般错误率较高;653株菌敏感性判定总错误率最低的为氟康唑 (1.7%/2.9%),其次为伏立康唑和伊曲康唑。
表2 不同孵育时间微量肉汤稀释法检测653株念珠菌对唑类敏感性判定一致率
Tab.2 Categorical agreements between 24 h and 48 h MICs determined by CLSI broth microdilution for three azoles against 653Candidaisolates

菌种类型(n)孵育时间(h)氟康唑伏立康唑伊曲康唑SorWT(%)CA(%)SorWT(%)CA(%)SorWT(%)CA(%)白念珠菌(364)2499.59798.991.812.179.74896.490.711光滑念珠菌(89)2487.696.688.867.494.4914880.956.292.1热带念珠菌(90)2481.185.682.282.284.488.94873.364.478.9近平滑念珠菌(90)2496.797.897.895.61001004894.493.396.7克柔念珠菌(8)240100100100100100480100100葡萄牙念珠菌(4)2475100751001007548757575季也蒙念珠菌(8)2410087.510062.510087.54887.562.587.5合计(653)2494.896.994.990.448.188.24890.782.445.5
注:S.敏感,WT.野生型,CA.敏感性判定一致率
3 讨 论
表3 以孵育24h结果为参照,48h检测念珠菌体外药物敏感性判定错误率(%)
Tab.3 Rates of categorical errors of MICs obtained at 48h compared with 24h incubation
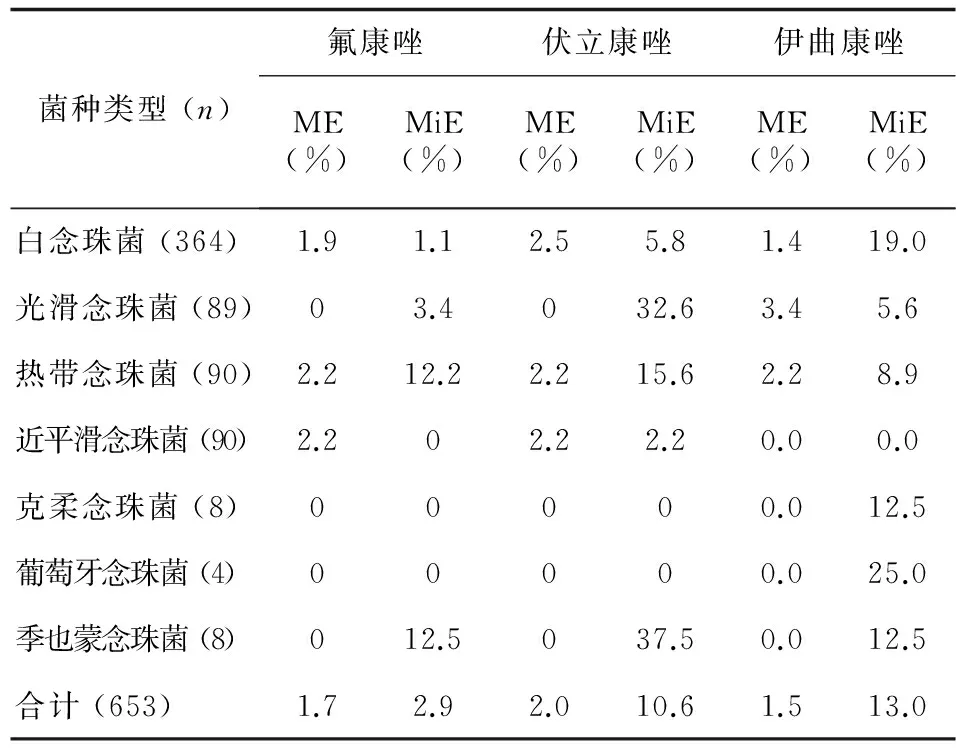
菌种类型(n)氟康唑伏立康唑伊曲康唑ME(%)MiE(%)ME(%)MiE(%)ME(%)MiE(%)白念珠菌(364)1.91.12.55.81.419.0光滑念珠菌(89)03.4032.63.45.6热带念珠菌(90)2.212.22.215.62.28.9近平滑念珠菌(90)2.202.22.20.00.0克柔念珠菌(8)00000.012.5葡萄牙念珠菌(4)00000.025.0季也蒙念珠菌(8)012.5037.50.012.5合计(653)1.72.92.010.61.513.0
注:ME.严重错误,MiE.一般错误
尽管伏立康唑对光滑念珠菌体外药物敏感性检测24 h和48 h EA高达94.4%,但二者CA明显偏低 (67.4%),文献中报道EA和CA分别介于73.3%~99.6%和87.9%~96.0%[7,9,11],较其他菌种类型偏低,差异主要源于48 h MIC值偏高,另外Espinel-Ingroff等[7]认为不同实验室客观条件及对48 h拖尾现象的认知也是造成这种差异的一个因素。既往研究表明拖尾现象已成为检测唑类药物对光滑念珠菌和热带念珠菌体外敏感性时的一个不可忽视的重要问题[12-13],微量肉汤稀释法检测念珠菌对唑类药物的体外敏感性时,约5%的菌株结果判读时会出现拖尾现象[14],即相对于对照孔真菌生长受到抑制但会持续若干个浓度梯度,拖尾严重的情况下可以表现为24 h为敏感,延长培养到48 h为耐药。曾有学者提出疑问,到底“24 h敏感到48 h耐药”这种变化是由于拖尾现象导致的结果判读错误,还是说延长培养可以检测出部分菌株的潜在耐药性[7]。动物试验模型表明,侵袭性念珠菌感染体内疗效与24 h MIC值相关性更好,而且临床证实,对于存在拖尾现象念珠菌导致的口咽部念珠菌病,采用敏感株剂量治疗即有效[13]。
微量肉汤稀释法检测氟康唑、伏立康唑和伊曲康唑对念珠菌属的体外药物敏感性时,大多情况下经24 h培养即可读取MIC值,且24 h和48 h MIC值具有较好的一致率,由于拖尾等原因48 h培养更容易判定为假耐药,与临床疗效不符,建议临床微生物实验室进行唑类药物对念珠菌属的体外药物敏感性检测时应基于培养24 h MIC值,从而更快速地为临床提供有效的药敏信息。
本研究的不足之处,首先克柔念珠菌、葡萄牙念珠菌和季也蒙念珠菌菌株数量偏少,其他一些少见菌种没能全部涵盖,研究结论代表性不足,期待同行专家验证和补充;其次由于CLSI M27-S4仅公布了有限几种念珠菌对氟康唑和伏立康唑的敏感性判定折点,在数据分析时伊曲康唑及其他念珠菌属参考了文献报道中的流行病学判定折点,故而研究结论有待于更进一步完善和改进。
[1] Wang H,Xiao M,Chen S,et al.Invitrosusceptibilities of yeast species to fluconazole and voriconazole as determined by the 2010 National China Hospital Invasive Fungal Surveillance Net (CHIF-NET) Study[J].J Clin Microbiol,2010,50(12):3952-3959.
[2] Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of yeasts;approved standard M27-A3,3rd ed[S].Clinical and Laboratory Standards Institute,Wayne,PA,2007.
[3] Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of yeasts,3rd informational supplement.M27-S3[S].Clinical and Laboratory Standards Institute,Wayne,PA,2009.
[4] Clinical and Laboratory Standards Institute.Reference method for broth dilution antifungal susceptibility testing of yeasts,fourth informational supplement.M27-S4[S].Clinical and Laboratory Standards Institute,Wayne,PA,2012.
[5] Pfaller MA,Diekema DJ.Progress in antifungal susceptibility testing ofCandidaspp. by use of Clinical and Laboratory Standards Institute broth microdilution methods,2010 to 2012[J].J Clin Microbiol,2012,50(9):2846-2856.
[6] Mara RD,Jack F.High-throughput detection of pathogenic yeasts of the genusTrichosporon[J].J Clin Microbiol,2004,42(8):3696-3706.
[7] Espinel-Ingroff A,Canton E,Peman J,et al.Comparison of 24 h and 48 h voriconazole MICs as determined by the Clinical and Laboratory Standards Institute broth microdilution method (M27-A3 document) in three laboratories:results obtained with 2,162 clinical isolates ofCandidaspp. and other yeasts[J].J Clin Microbiol,2009,47(9):2766-2771.
[8] Pfaller MA,Boyken LB,Hollis RJ,et al.Validation of 24 h fluconazole MIC readings versus the CLSI 48 h broth microdilution reference method:results from a globalCandidaantifungal surveillance program[J].J Clin Microbiol,2008,46(11):3585-3590.
[9] Pfaller MA,Boyken LB,Hollis RJ,et al.Validation of 24 h posaconazole and voriconazole MIC readings versus the CLSI 48 h broth microdilution reference method:application of epidemiological cutoff values to results from a globalCandidaantifungal surveillance program[J].J Clin Microbiol,2011,49(4):1274-1279.
[10] Food and Drug Administration.Class II special controls guidance document:antimicrobial susceptibility test systems;guidance for industry[S].Food and Drug Administration,Washington,DC.2003.
[11] Espinel-Ingroff A,Barchiesi F,Cuenca-Estrella M,et al.Comparison of visual 24 h and spectrophotometric 48 h MICs to CLSI reference microdilution MICs of fluconazole,itraconazole,posaconazole,and voriconazole forCandidaspp.:a collaborative study[J].J Clin Microbiol,2005,43(9):4535-4540.
[12] Revankar SG,Kirkpatrick WR,McAtee RK,et al.Interpretation of trailing endpoints in antifungal susceptibility testing by the National Committee for Clinical Laboratory Standards method[J].J Clin Microbiol,1998,36(1):153-156.
[13] Rex JH,Nelson PW,Paetznick VL,et al.1998.Optimizing the correlation between results of testinginvitroand therapeutic outcomeinvivofor fluconazole by testing critical isolates in a murine model of invasive candidiasis[J].Antimicrob.Agents Chemother,1998,42(1):129-134.
[14] Arthington-Skaggs BA,Warnock DW,Morrison CJ.Quantitation ofCandidaalbicansergosterol content improves the correlation betweeninvitroantifungal susceptibility test results andinvivooutcome after fluconazole treatment in a murine model of invasive candidiasis[J].Antimicrob Agents Chemother,2000,44(8):2081-2085.
[本文编辑] 施 慧
Comparison of azoles MICs againstCandidaspp.determined by the broth microdilution method at different incubation time
GUO Li-na,XU Zhi-peng,WANG Yao,WANG He,ZHAO Ying,XIAO Meng,XU Ying-chun
(ChineseAcademyofMedicalSciences,PekingUnionMedicalCollegeHospital,ClinicalMicrobiologyLaboratory,Beijing100730)
Objective To investigate the agreement between the 24 h and 48 h azoles MICs againstCandidaspecies by broth microdilution method.Methods Antifungal susceptibility testing was carried out by broth microdilution method against 653Candidaisolates and MICs were obtained at 24 h and 48 h incubation for assessing of essential agreement (EA),categorical agreement (CA) and categorical error (Error).Results Most ofCandidaisolates tested could obtain sufficient growth after 24 h incubation.The overall EAs of 24 h and 48 h MICs were excellent with the three azoles for most of the species,fluconazole (91.9%),voriconazole (92.0%) and itraconazole (95.6%);the overall CAs were wonderful with fluconazole (96.9%),voriconazole (90.4%) and itraconazole (88.2%),depending on the species type tested.Very major errors (VMEs) were absent in our study,minor errors were reported most of the time.The ME/MiE for the total 653Candidaisolates were fluconazole (1.7%/2.9%),voriconazole (2.0%/10.6%) and itraconazole (1.5%/13.0%).Conclusion These data suggested that the performance 24 h MIC readings gave results similar to those of 48 h MICs and reading MICs at 24 h incubation would shorten the MIC determination of azoles and avoid errors due to trailing misinterpretation.
broth microdilution method;antifungal susceptibility;Candida;triazole;MIC
首都卫生发展科研专项 (2016-1-4013)
郭莉娜,女 (汉族),硕士,助理研究员.E-mail:guo0201205@126.com
徐英春,E-mail:xycpumch@139.com
R 379.4
A
1673-3827(2016)11-0332-05
2016-08-15
