盐酸羟考酮缓释片在癌痛治疗中应用
2016-02-20朱颖刘渤娜
朱颖 刘渤娜
[摘 要] 目的:观察盐酸羟考酮缓释片在癌痛治疗中效果及安全性。方法:选取我院2012年9月至2015年9月收治336例癌痛患者,随机数字表分为观察组及对照组,各168例,分别口服盐酸羟考酮及盐酸曲马多。比较2组患者起效时间、镇痛效果、不良反应及生活质量变化。结果:观察组药物起效时间及持续时间均显著优于对照组(P<0.05)。观察组与对照组镇痛总有效率为92.9%vs85.7%,差异无统计学意义(P>0.05)。观察组生活质量改善率为77.4%,显著高于对照组68.5%(P<0.05)。治疗2周后,2组患者NRS评分均显著降低,KPS评分均显著升高,组间比较差异无统计学意义(P>0.05)。观察组与对照组不良反应发生率分别为60.1%vs57.1%,组间比较差异无统计学意义(P>0.05)。结论:盐酸羟考酮缓释片能够早期改善癌痛患者疼痛症状,对其生活质量改善具有积极意义,其良好安全性和有效性值得肯定。
[关键词] 盐酸羟考酮;癌症;癌痛;疗效;安全性
中图分类号:R441.1 文献标识码:A 文章编号:2095-5200(2016)01-070-03
DOI:10.11876/mimt201601023
癌痛是影响癌症患者生活质量重要因素,数据显示,新发癌症患者中,约有50%以上伴有不同程度疼痛[1],其中80%以上患者为中到重度疼痛[2]。世界卫生组织(WHO)提出,应当规范化治疗,早期、持续、有效地消除疼痛。癌痛三阶梯治疗,第一阶梯,可选择非甾体消炎药,第二阶梯,可选用弱阿片类药物,第三阶梯,建议给予强阿片类药物。降阶梯治疗方案,即第二阶梯应用强阿片类药物,强化镇痛效果[3]。盐酸羟考酮缓释片是一种强效阿片类半合成镇痛药物,为探究其在癌痛治疗中效果及安全性,本文选取我院2012年9月至2015年9月收治336例患者实施前瞻性对照分析如下。
1 一般资料
1.1 病例资料
本临床研究经我院医学伦理委员会审核批准。选取我院2012年9月至2015年9月收治336例癌痛患者,在其签署知情同意书前提下,按照随机数字表法将患者分为观察组及对照组,各168例。2组患者年龄、性别比例、疼痛程度、疼痛性质、肿瘤类型等指标比较,差异无统计学意义(P>0.05),具有可比性。
1.2 选取标准及排除标准
选取标准: 1)经病理组织学检查确认恶性肿瘤[4];
2)合并癌痛症状,疼痛数字分级量表(Numberic rating scale,NRS)评分≥4分;3)卡氏功能状态(Karnofsky performance status,KPS)评分≥50分,适合口服给药;4)预期生存期≥3个月。排除标准:1)非肿瘤相关性疼痛或其他原因不明疼痛;2)入组前1个月内有单胺氧化酶抑制剂类药物使用史;3)有药物滥用史;4)对阿片类药物有过敏史或使用禁忌证;5)合并肝肾功能不全、心血管严重病变等全身其他病变。
2 研究方法
2.1 治疗方法
按照患者组别分别给予相应镇痛药物。观察组:盐酸羟考酮缓释片(商品名奥施康定,英国Bard Pharmaceuticals Limited公司生产,批准文号H20120518,规格10 mg/s)口服,起始剂量10 mg/次,每日2次;对照组:盐酸曲马多缓释片(商品名舒敏,德国Grunenthal GmbH公司生产,批准文号H20100175,规格0.15 g/s)口服,起始剂量50 mg/次,每日2次。若观察组患者用药24 h内出现暴发痛(NRS评分≥7分),则以原有药物用量为基础上调25%~50%予以解救,对照组口服5 mg盐酸吗啡片解救暴发痛[5]。次日药物剂量=前日药物剂量+前日解救量。持续14 d。
2.2 观察指标
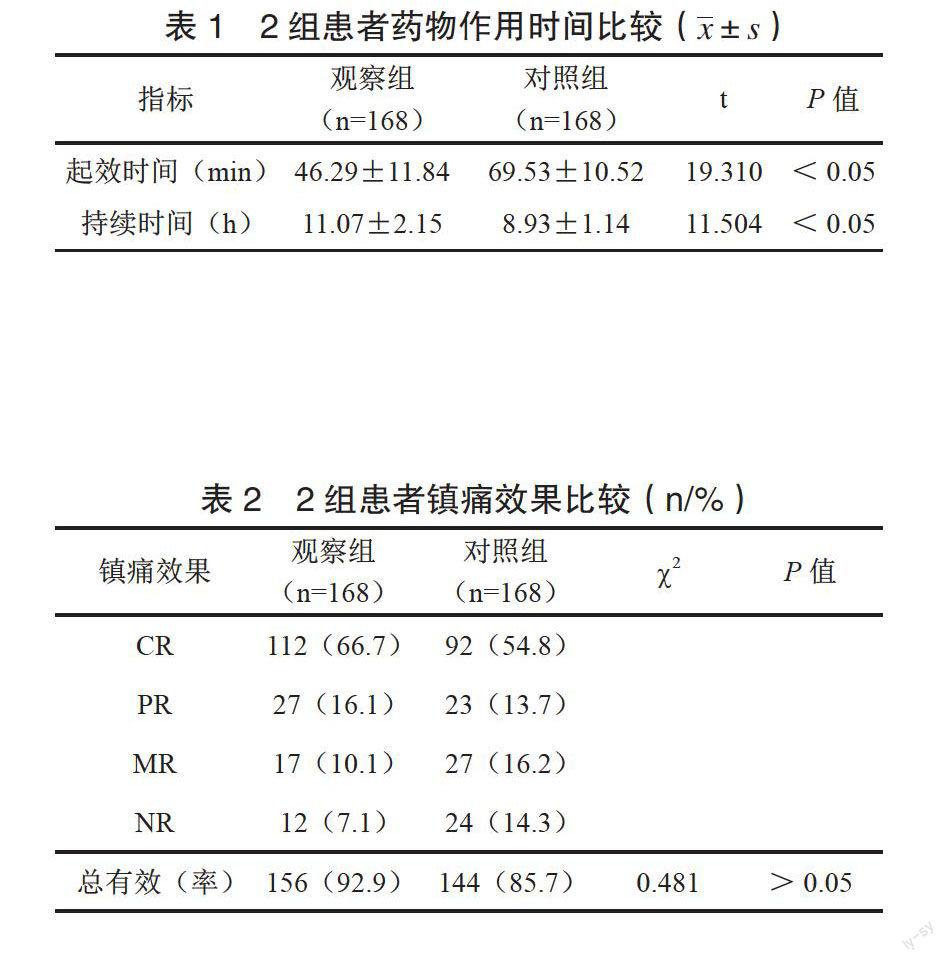
药物作用时间:记录2组患者镇痛起效时间及持续时间,并比较。
镇痛效果评价:参照文献标准,以NRS评分为依据,对患者治疗1周后临床疗效进行评价[6]:完全缓解(CR):NRS 0分,无疼痛感;部分缓解(PR):疼痛明显减轻,生活及睡眠不受影响;轻度缓解(MR):疼痛减轻,但仍存在明显痛感,睡眠受干扰;未缓解(NR):疼痛较治疗前无明显减轻,或显著加重。总有效率=(CR+PR+MR)/总例数×100%。
生活质量评价:参照文献标准,以KPS评分为依据,对患者治疗2周后生活质量进行评价[7]:改善:治疗后KPS评分增加≥10分;稳定:治疗后KPS增加<10分或降低<10分;降低:治疗后KPS评分降低≥10分。
不良反应观察:观察2组患者治疗期间便秘、恶心呕吐、头晕头痛等不良反应发生情况,并比较。
3 统计学分析
对本临床研究所有数据采用SPSS18.0进行分析,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,并采用t检验,检验水准设定为α=0.05,以P<0.05为有统计学意义,以P<0.01为有显著统计学意义。
4 结果
4.1 药物作用时间
观察组药物起效时间及持续时间均显著优于对照组,差异有统计学意义(P<0.05),见表1。
4.2 镇痛效果评价
观察组镇痛总有效率为92.9%,对照组为85.7%,2组患者镇痛效果比较,差异无统计学意义(P<0.05),见表2。
4.3 生活质量评价
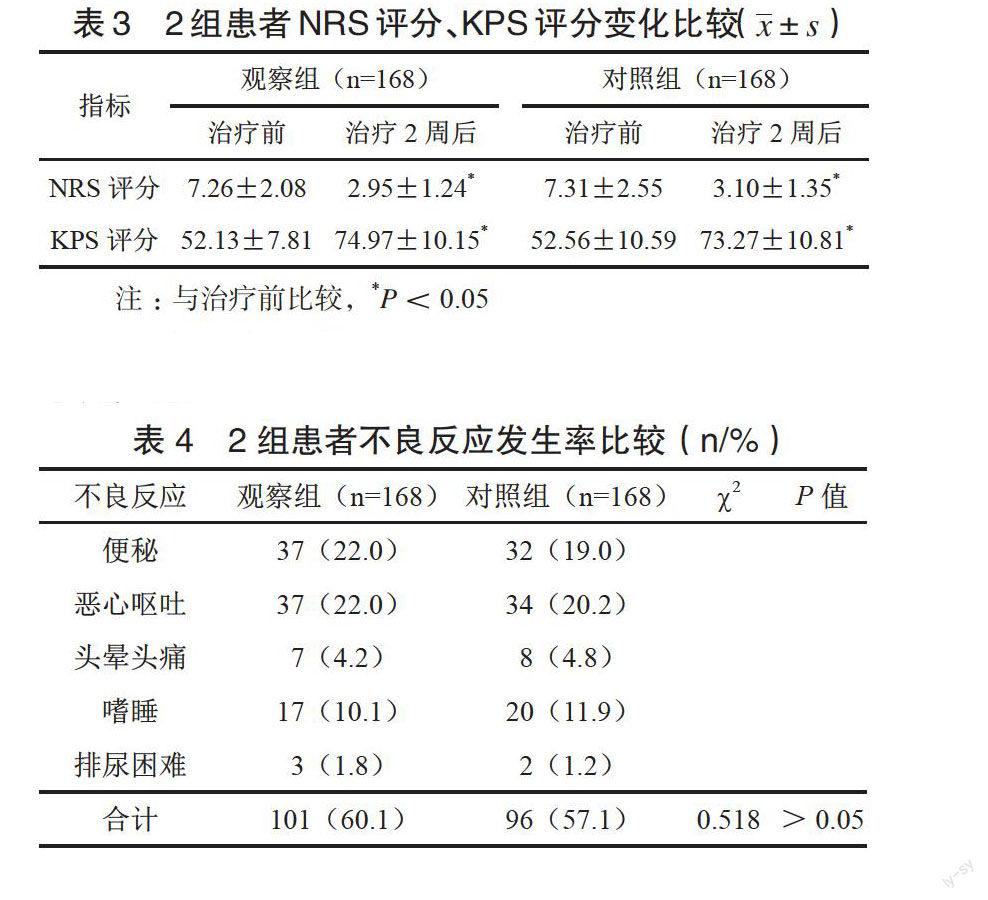
观察组生活质量改善130例,稳定38例,改善率为77.4%,对照组改善115例,稳定44例,降低9例,生活质量改善率68.5%,组间差异有统计学意义(P<0.05)。治疗2周后,2组患者NRS评分均显著降低,KPS评分均显著升高,组间比较差异无统计学意义(P>0.05),见表3。
4.4 不良反应观察
观察组与对照组不良反应发生率分别为60.1%与57.1%,组间比较差异无统计学意义(P>0.05),见表4。患者不良反应程度较轻微,可耐受,未经特殊处理即自行缓解,治疗期间均未见呼吸抑制等严重不良反应。
5 讨论
2002年第十届国际疼痛大会明确指出,疼痛已成为继呼吸、血压、脉搏、体温之后第五大生命指征,也是全球范围内重点关注公共健康问题之一。其中,癌症、癌症相关性病变及抗癌治疗引发疼痛统称为癌痛。癌痛发生机制较为复杂,肿瘤对神经压迫刺激、对痛觉敏感组织刺激、骨骼转移、分泌因子、炎症因素以及外周神经病变、心理因素等,均可导致癌痛发生与发展[8]。
在癌痛治疗五项原则中,首要原则为无创途径给药。盐酸曲马多缓释片属于二阶梯镇痛口服药物,符合癌痛治疗原则,同时,其拥有阿片受体激动剂和中枢神经抑制作用,可延缓去甲肾上腺素和5-羟色胺再摄取,发挥镇痛效果。但有学者指出,盐酸曲马多缓释片存在剂量限制,故一旦镇痛效果欠佳,需换用第三阶梯镇痛药物,不仅导致治疗更为复杂,也导致镇痛效果受到影响[9]。虽然本研究2组患者镇痛总有效率比较无明显差异,但观察组更早起效时间与更长镇痛持续时间在早期改善患者疼痛方面具有更佳作用,在一定程度上降低治疗复杂性。
盐酸羟考酮缓释片是世界卫生组织(WHO)三阶梯治疗方案中最为理想一种药物,在中重度癌痛中已得到广泛应用[10]。作为一种阿片纯受体激动剂,盐酸羟考酮缓释片镇痛作用与吗啡类似,无封顶效应,且其镇痛强度是吗啡2倍以上。与此同时,缓释制剂具有更长作用时间,一般可达8~12 h,且生物利用度在60%~87%以上,故能够减少给药次数,提高患者依从性。此外,夏欣欣等[11]研究发现,缓释药物能够保持药物浓度处于一个较低平稳状态,在保证药物成分缓慢、平稳起效同时,不易造成药物浓度到达峰值,从而避免药物滥用。
得益于盐酸羟考酮缓释片药效特点,患者疼痛状态、精神状态、心理状态均可得到有效改善,并表现为生存质量明显改善[12-13]。本研究观察组患者生存质量改善率达到77.4%,与上述结论相符,表明较快镇痛速度与较低用药有助于患者身心状态改善,并表现为生活质量显著提高。安全性方面,2组患者镇痛治疗期间不良反应发生率均在60%左右,其中便秘、恶心呕吐较为多见,与DeVeaugh-Geiss等[14]研究结论接近,其原因考虑为:一方面恶性肿瘤导致基础疾病可能导致患者对药物反应更为明显,另一方面药物对中枢神经系统抑制作用,可能影响患者代谢,进而引发各类不良反应发生[15]。但总体而言,患者不良反应程度较轻,可耐受,且未见严重不良反应及药物成瘾,安全性值得肯定。在今后用药中,建议嘱患者多进食富含纤维食物,并备好开塞露等缓泻剂,对可预见不良反应加以控制。
综上所述,癌痛治疗中应用盐酸羟考酮缓释片能在保持较快起效时间基础上,有效延长作用时间,可持续减轻疼痛,改善患者生活质量,具有镇痛效果确切、不良反应轻等优势,值得作为中重度癌痛首选治疗药物加以推广。
参 考 文 献
[1] AHMEDZAI S H, NAUCK F, BAR-SELA G, et al. A randomized, double-blind, active-controlled, double-dummy, parallel-group study to determine the safety and efficacy of oxycodone/naloxone prolonged-release tablets in patients with moderate/severe, chronic cancer pain[J]. Palliative medicine, 2012, 26(1): 50-60.
[2] ANDREASSEN T N, EFTEDAL I, KLEPSTAD P, et al. Do CYP2D6 genotypes reflect oxycodone requirements for cancer patients treated for cancer pain? A cross-sectional multicentre study[J]. European journal of clinical pharmacology, 2012, 68(1): 55-64.
[3] 崔南南, 董骏铭. 口服盐酸羟考酮与硫酸吗啡控释片治疗中重度癌痛临床疗效 Meta 分析[J]. 肿瘤学杂志, 2012, 18(2): 134-137.
[4] CARACENI A, HANKS G, KAASA S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC[J]. The lancet oncology, 2012, 13(2): e58-e68.
[5] 丁亚文, 冯刚, 张丽娟, 等. 盐酸文拉法辛胶囊联合羟考酮缓释片治疗中重度癌痛临床研究[J]. 华中科技大学学报: 医学版, 2012, 41(4): 485-489.
[6] AHMEDZAI S H, LEPPERT W, JANECKI M, et al. Long-term safety and efficacy of oxycodone/naloxone prolonged-release tablets in patients with moderate-to-severe chronic cancer pain[J]. Supportive Care in Cancer, 2015, 23(3): 823-830.
[7] MERCADANTE S, FERRERA P, VILLARI P, ET AL. Switching from oxycodone to methadone in advanced cancer patients[J]. Supportive Care in Cancer, 2012, 20(1): 191-194.
[8] NAKAMURA A, HASEGAWA M, MINAMI K, et al. Differential activation of the μ‐opioid receptor by oxycodone and morphine in pain‐related brain regions in a bone cancer pain model[J]. British journal of pharmacology, 2013, 168(2): 375-388.
[9] 李欣.癌痛治疗现状调查及规范化治疗的意义[D].石家庄:河北医科大学,2014.
[10] KING S J, REID C, FORBES K, ET AL. A systematic review of oxycodone in the management of cancer pain[J]. Palliative medicine, 2011, 25(5): 454-470.
[11] 夏欣欣, 韩黎丽, 邓文英, 等. 盐酸羟考酮缓释片治疗中重度癌痛临床观察[J]. 中华实用诊断与治疗杂志, 2014, 28(1): 91-92.
[12] PERGOLIZZI JR J V, TAYLOR JR R, ZAMPOGNA G, et al. Oxycodone Immediate Release for Cancer Pain Management in Turkey: Maximizing Value in Opioid Analgesics[J]. Journal of Cancer Research Updates, 2014, 3(4): 207-217.
[13] 刘君, 肖扬, 马益敏, 等. 氟伏沙明联合羟考酮缓释片治疗中重度癌痛[J]. 实用医学杂志, 2015, 31(12): 2014-2017.
[14] DEVEAUGH-GEISS A, KADAKIA A, CHILCOAT H, et al. Duration of use of extended-release oxycodone and morphine among adults with cancer and non-cancer pain[J]. Journal of Pain, 2013, 4(14): S75.
[15] SCHMIDT-HANSEN M, BENNETT M I, HILGART J. Oxycodone for Cancer Pain in Adult Patients[J]. Oncol, 2012, 13(2): e58-e68.
