黍子的抗氧化活性及其与功能活性成分的关系
2016-02-18郑楠楠綦文涛王春玲允婷婷任贵兴
郑楠楠 綦文涛 王春玲 允婷婷 幺 杨 任贵兴
(1. 天津科技大学,天津 300222;2. 国家粮食局科学研究院,北京 100037;3. 中国科学研究院作物科学研究所,北京 100081)
黍子的抗氧化活性及其与功能活性成分的关系
郑楠楠1,2綦文涛2王春玲1允婷婷2幺 杨3任贵兴3
(1. 天津科技大学,天津 300222;2. 国家粮食局科学研究院,北京 100037;3. 中国科学研究院作物科学研究所,北京 100081)
通过建立C57BL/6肥胖小鼠模型,评价了黍子对小鼠肝脏抗氧化性能的影响。并在分析比较其多酚和黄酮含量的基础上,利用抗氧化化学分析和细胞评价试验,研究了黍子抗氧化活性与其主要功能活性物质含量之间的关系。结果表明:高脂饮食削弱了小鼠肝脏的抗氧化性能,日粮中添加黍子后,高脂饮食小鼠肝脏的抗氧化能力得到了明显的改善。不同黍子品种间多酚和黄酮的含量差异较大。总多酚含量变异系数可达63.61%,变幅为0.78~3.44 mg/g。总黄酮含量变异系数可达68.46%,变幅为0.89~10.17 mg/g。不同品种黍子提取物的总抗氧化能力指数(ORAC)和细胞抗氧化活性(CAA)均存在显著性差异,且黍子提取物的ORAC和CAA值与黄酮和多酚的总含量相关,均呈正向线性关系,相关系数R2分别为0.811和 0.565。
黍子;抗氧化活性;黄酮;多酚;线性相关性
黍子是中国北方干旱或半干旱地区[1-2]主要的粮食作物,也是中国特色的小杂粮作物[3]。中国是目前世界上黍子栽培面积最大的国家,常年种植面积约为100万hm2[4]。黍子有糯性和粳性之分。黍子中富含蛋白质、淀粉、脂肪、维生素和矿物质,近些年研究发现,黍子中还含有丰富的功能性天然活性物质,如多酚[5]、黄酮[5]、生物碱[5-6]等。黍子酚类物质能够明显地抑制血浆和肝脏中胆固醇含量上升,能诱导血管舒张,对降低冠心病、动脉粥样硬化和中风等常见心血管疾病的发病率[5]有重要的作用。另外,黍子多酚对多种细菌、真菌、酵母都能起到抑制作用,尤其能明显抑制霍乱菌、金黄色葡萄球菌和大肠杆菌等常见致病细菌[7]。
目前,中国黍子的研究[6,8]主要集中在新品种选育上。同时,外来种质收集整理和应用也得到了有效开展[9-10]。而关于黍子品质方面的研究较少,且主要集中在黍子蛋白提取、脱色工艺及代谢调节功能等方面[11-12]。而关于黍子抗氧化的研究还不多见,为数不多的报道[13-14]也只涉及体外抗氧化方面。基于此,本研究拟采集了中国黍子主产区的6种代表性黍子品种,其中糯性黍子4种,粳性黍子2种,通过建立高脂日粮C57BL/6雄性小鼠模型,评价了黍子对小鼠肝脏抗氧化性能的影响,并在分析比较其多酚和黄酮含量的基础上,利用抗氧化化学分析和细胞评价试验,研究了黍子抗氧化活性与其主要抗氧化功能活性物质含量之间的关系,以期为黍子的合理加工和消费提供参考。
1 材料与方法
1.1 试验材料
样品制备:分别选取中国主要产区2015年产糯性黍子(4种)和粳性黍子(2种)共6个品种(见表1),经除杂、清洗、干燥、脱壳、粉碎(过60目筛)后得到黍子粉末进行多酚、黄酮检测及体内、体外试验备用;

表1 黍子品种及来源
试验细胞:人肝癌细胞HepG2,天津科技大学食品营养与安全实验室馈赠;
试验动物:5~6周龄健康SPF级C57BL/6雄性小鼠,体重14~16 g,共110只[许可证号:SCXK(京)2015-0001],北京维通利华实验动物技术有限公司。
1.2 试验试剂与设备
Folin-Ciocalten试剂、DPPH(1,1-苯基- 2-苦肼基自由基)、没食子酸标准品、细胞培养基DMEM/HIGH GLUCOSE:美国Sigma公司;
碳酸钠、香草醛、铁氰化钾、硫酸亚铁、水杨酸、三氯乙酸、丙酮:分析纯,北京化工厂;
苯酚、亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、芦丁: 国药集团化学试剂有限公司;
2',7'-二氯荧光黄双乙酸盐(DCFH-DA):美国Sigma公司;
丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GSH-PX)试剂盒、总超氧化物歧化酶(T-SOD)试剂盒:南京建成科技有限公司;
数显示电热恒温水槽:HHS型,上海博迅实业有限公司医疗设备厂;
电子分析天平:ME235S型,德国Sartorius 公司;
真空冷冻干燥机:FD-2型,北京博医康实验仪器有限公司公司;
分光光度计:751型,上海普天公司;
多功能振荡器:WH-4型,天津市威化实验仪器厂;
酶标仪:SpectraMax Plus384型,美国Molecular Devices公司;
高速冷冻式离心机:Eppendorf5810R型,德国Eppend-orf公司;
旋转蒸发仪:RE52-AA型,上海沪西分析仪器厂;
粉碎机:JFSD-100型,上海嘉定粮油仪器有限公司。
1.3 试验方法
1.3.1 多酚含量测定 采用分光光度法[15]。
1.3.2 黄酮含量的测定 采用NaNO2-Al(NO)3比色法[16]。
1.3.3 黍子水提物和醇提物的制备
(1) 水提物:称取50 g黍子粉末,按照1∶15(g/mL)的料液比溶于水中,振荡器搅匀,置于50 ℃水浴锅中浸提2 h,浸提过程中每隔15 min搅匀一次。取上清3 500 r/min离心10 min,50 ℃旋蒸浓缩后冻干。按式(1)计算其提取率:
(1)
式中:
v——提取率,%;
m1——水提物含量,g;
m2——黍子粉的重量,g;
a——水提物中水分含量,%;
b——黍子粉中水分含量,%。
(2) 醇提物:称取50 g黍子粉末,按照1∶10(g/mL)的料液比溶于60%乙醇中,振荡器搅匀,置于50 ℃水浴锅中浸提2 h,浸提过程中每隔15 min搅匀一次。取上清3 500 r/min离心10 min,50 ℃旋蒸浓缩后冻干,计算其提取率。
1.3.4 细胞培养及传代 HepG2细胞在含10%的胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养液,于37 ℃,5%的CO2孵育箱中培养,细胞呈贴壁生长,2~3 d传代1次。
1.3.5 总抗氧化能力的指数(ORAC)测定 根据文献[17]修改如下:首先用75 mmol/L的磷酸缓冲液(pH=7.4)对黍子水提物和醇提物进行稀释,采用荧光96孔板进行测定。每个孔中精确移取20 μL样品提取物或者20 μL Trolox标准品(6.25~50.00 μmol/L)以及200 μL的fluorescein(荧光指示剂,0.96 μmol/L),于37 ℃荧光酶标仪中温育20 min,然后每个孔再加入20 μL,119 mmol/L用磷酸缓冲液配置的偶氮类化合物ABAP(现用现配)。利用荧光酶标仪在波长485 nm处激发,每5 min在波长520 nm处释放测定,立即读数,循环30次。每个样品设3个复孔。试验测得的各微孔不同时间点的绝对荧光强度数据与其初始时间的荧光强度相比,折算成相对荧光强度,相对荧光强度对时间求积分得到净面积。待测样品的ORAC值就是以μmol Trolox/g样品表示,具体计算公式[18]:
(2)
式中:
ORAC——总抗氧化能力指数,μmol Trolox/g;
A1——时间—样品荧光值曲线下完整面积;
A2——时间—Trolox光值曲线下完整面积;
A——时间—对照荧光值曲线下完整面积;
C1——Trolox摩尔浓度;
C2——样品摩尔浓度。

除去空白值和初始荧光值后,每个黍子样品对应时间-荧光值曲线下的积分面积即样品中抗氧化物质的CAA值,黍子提取物的CAA值以每100 g干物质相当于槲皮素(QE)的毫摩尔当量表示,计算公式:
(3)
式中:
CAA——细胞抗氧化活性,mmol QE/100 g;
Sa——时间—样品荧光值曲线下完整面积;
Sb——时间—对照荧光值曲线下完整面积。
1.3.7 小鼠肝脏抗氧化活性检测 建立与人类肥胖最为接近的C57L/6雄性小鼠,普通饲料适应性喂养1周,自由采食和饮水,随机分为正常对照组(饲喂基础饲料)、 模型对照组(饲喂高脂高胆固醇饲料,建立混合型高脂血症动物模型)及6组试验组(10%黍子粉+高脂饲料),每组7只。连续饲喂高脂高胆固醇饲料或含黍子的高脂高胆固醇饲料12周,取小鼠肝组织并在冷生理盐水中漂洗,除去血液,滤纸拭干。称取0.3 g肝组织放入匀浆管中,加入2.7 mL 0.86%冷生理盐水,用组织捣碎机10 000 r/min制备10%匀浆,将制备好的10%匀浆用低温离心机2 000 r/min,离心15 min取上清液,按照试剂盒说明测定小鼠肝脏的总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)活力,以及丙二醛(MDA)含量。
1.4 数据处理
各检测指标分别测定3次,取平均值,采用Excel 2007进行统计分析,利用SPSS 17.0软件进行显著性方差分析,组间比较采用方差齐性检验和单因素方差分析,以P<0.05为差异有统计学意义。数据表现形式为(mean±SD)。
2 结果与分析
2.1 黍子的抗氧化作用效果
高脂饮食已被证明能引起小鼠肝脏抗氧化机能的显著降低[21],因此可用来评价功能性食品或功能因子对肝脏抗氧化作用的影响。由表2可知,高脂日粮条件下,小鼠体重增长率和肝脏指数比对照组显著提高,高脂日粮添加黍子后,小鼠体重增长率和肝脏指数总体上呈现降低趋势,但无显著性差异(P>0.05)。与对照组相比,高脂饮食组中小鼠肝脏的总超氧化物歧化酶(T-SOD)活力降低并不明显(P>0.05),谷胱甘肽过氧化物酶(GSH-PX)活力降低了10%左右(P>0.05),而肝组织中丙二醛(MDA)含量则显著提高了2.6倍(P<0.05)。这些结果表明了高脂饮食条件下,小鼠肝脏的抗氧化机能明显降低。
在高脂日粮中添加黍子后,小鼠肝脏的抗氧化指标因品种的不同而差异较大。与单纯高脂日粮组相比,除了宁糜9号和晋黍5号组外,添加黍子组的T-SOD活性呈现增加趋势,且黄糜子和宁糜11号组为显著提高(P<0.05)。GSH-PX活性的增加趋势更为明显,且有宁糜9号、黄糜子、晋黍8号和晋黍5号4个黍子组的GSH-PX活性得到显著提高(P<0.05)。黍子对小鼠肝脏MDA含量的降低效果不佳,差异也较大,只有黄糜子和红糜子组的MDA浓度呈现降低趋势,但降低程度不显著(P>0.05),说明黍子降低小鼠肝脏MDA含量的效果不佳。上述结果表明,黍子可通过影响T-SOD和GSH-PX活性,起到改善高脂饮食条件下小鼠肝脏抗氧化能力的作用,但这种影响作用会因为黍子不同的品种而差异较大,这种差异与不同的黍子品种,功能活性物质的含量不同有关。

表2 黍子对高脂日粮C57 BL/6小鼠肝脏抗氧化性能的影响†
† 用Duncan法进行多重比较。同列中肩部有相同字母代表无显著性差异(P>0.05);标有不同字母者代表组间差异显著(P<0.05)。
2.2 黍子的黄酮和多酚含量
作为一种全谷物食品,黍子功能活性物质种类和含量复杂,其中黄酮和多酚是与其抗氧化活性相关的两种主要功能物质。Zhang Li-zhen等[22]曾分析了3个品种的黍子中所含的植物化学成分,表明黍子籽粒和壳粉均含有丰富的多酚类物质,并提出黍子可以作为天然抗氧化剂的来源之一。本研究结果(图1)表明不同品种黍子,其黄酮和多酚的含量均存在显著性差异(P<0.05),黄糜子多酚含量为(3.44±0.07) mg/g,比含量最低的晋黍8号(0.78±0.03) mg/g高出4倍,总多酚含量变异系数可达63.61%,变幅为0.78~3.44 mg/g。总黄酮含量以晋黍5号最高为(10.17±0.45) mg/g,红糜子含量最低为(0.89±0.08) mg/g,前者约为后者的11倍,变异系数可达68.46%,变幅为0.89~10.17 mg/g。图1结果还表明,多酚含量高的黍子品种,其黄酮含量相对较低;而多酚含量低的黍子品种,其黄酮含量相对较高;即两者存在某种程度的负相关。
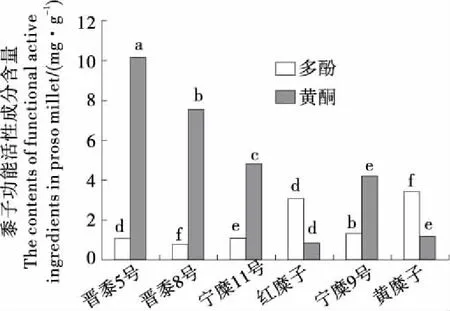
不同小写字母者表示差异显著(P<0.05)
Figure 1 The flavonoids and polyphnols contents in different breeds of proso millets
2.3 黍子提取物的总抗氧化能力指数和细胞抗氧化活性分析
由于黄酮水溶性较差,而多酚的水溶性较好,因此本研究分别检测了黍子水提物和醇提物的抗氧化能力指数(ORAC)。由表3可知,不同品种黍子提取物,其ORAC值差异显著。红糜子水提物的ORAC值高于或显著高于其它黍子品种,而其醇提物抗氧化能力却显著较低。晋黍5号、晋黍8号及宁糜11号乙醇提取物的ORAC值显著较高(P<0.05)。总ORAC值以晋黍5号为最高,红糜子最低,两者相差达1.57倍。多酚含量较高,而黄酮含量较低的红糜子水提物的ORAC值高于或显著高于其它黍子品种,而其醇提物ORAC值却最低;表明黍子水提物的抗氧化活性以多酚为主,而醇提物的抗氧化活性则以黄酮为主,而黍子总抗氧化能力则取决于多酚和黄酮的总含量。
本研究进一步采用细胞内抗氧化活性试验(CAA试验)对不同品种黍子的抗氧化活性进行了研究,由表4可知,所采集6种黍子水提物的细胞抗氧化能力依次为:晋黍5号>晋黍8号>宁糜11>宁糜9号>黄糜子>红糜子,红糜子和黄糜子CAA值显著低于其他几个品种(P<0.05)。6种黍子醇提物的细胞抗氧化能力依次为:晋黍8号>晋黍5号>宁糜子9号>宁糜11>红糜子>黄糜子。黍子的总CAA值同样以红糜子和黄糜子最低(P<0.05)。且除红糜子和黄糜子外,其他品种黍子,其水提物CAA值均低于醇提物。这与黍子的ORAC试验得出的结论一致。
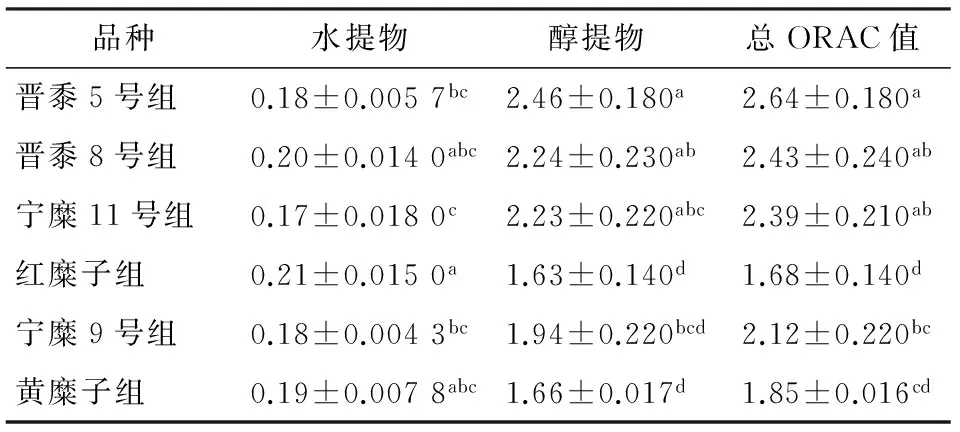
表3 不同品种黍子的ORAC值†
† 肩部有相同字母代表无显著性差异(P>0.05);肩部不同字母代表两者有显著差异(P<0.05)。

表4 不同品种黍子的CAA值†
† 肩部有相同字母代表无显著性差异(P>0.05);肩部不同代表两者有显著差异(P<0.05)。
2.4 黍子抗氧化性能与其黄酮和多酚含量之间的关系
如何正确评价谷物的健康功效,一直是众多消费者和研究人员感兴趣的问题。谷物中功能活性物质的含量常常被用作评价其具有某种健康功效重要依据,然而谷物健康功效往往是多种成分协同作用的结果,很难依据某个单一的组分进行其功能的判定,必须通过体外、离体细胞和体内等多种试验,进行结论的判定。本研究主要研究了基于ORAC和CAA法得到的黍子抗氧化活性与其主要抗氧化物质黄酮和多酚含量之间的关系。由图2可知,黍子粗提物,包括乙醇提取物和水提物的总抗氧化能力指数(ORAC)随黄酮和多酚含量的增加而增加,且具有较高的线性相关性(R2=0.811);黍子提取物的抗氧化活性随黄酮和多酚含量的增加也呈线性增加的趋势(R2=0.565),但相关性不是很强。黍子的ORAC和CAA均与多酚和黄酮的总含量线性相关,而与单纯的多酚和黄酮含量之间关系并不显著(R2<0.5,图省略)。此外,本研究未发现粳性品种和糯性品种黍子在抗氧化活性和多酚及黄酮含量方面的规律性差异。
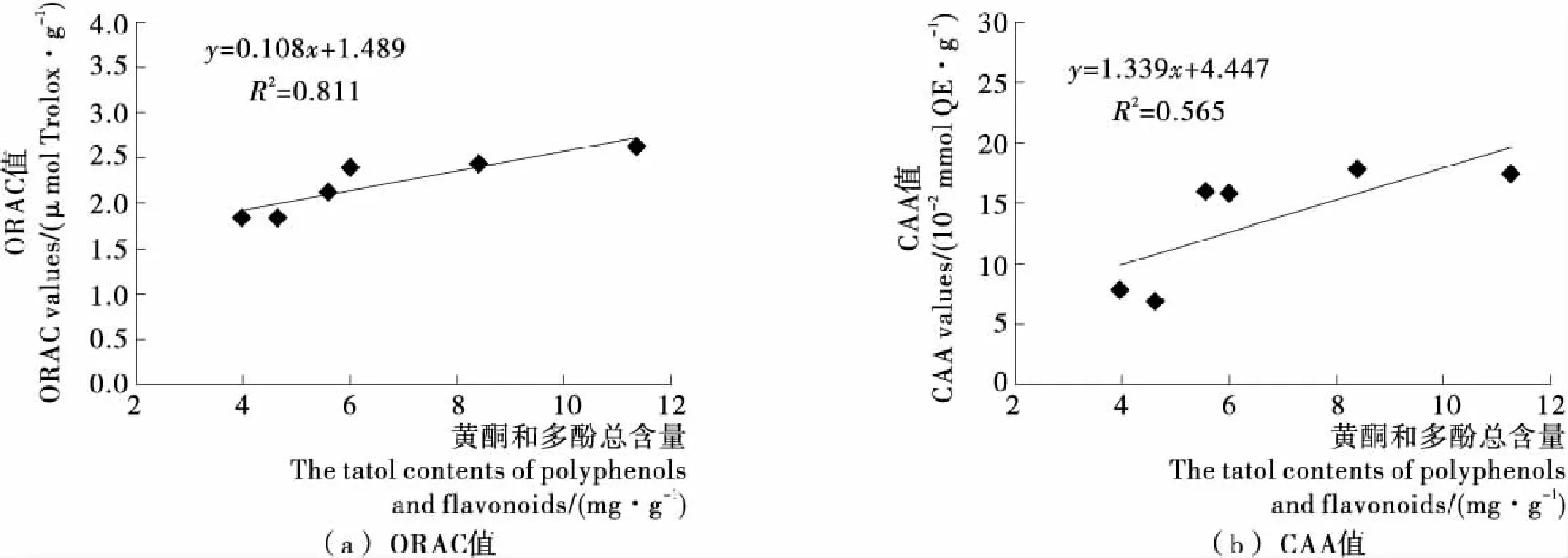
图2 黄酮和多酚含量与黍子抗氧化性能之间的关系
3 结论
C57BL/6肥胖小鼠模型试验表明,黍子的添加对小鼠肝脏的抗氧化能力起到了明显的改善作用,且不同黍子品种影响的程度不同。不同黍子品种间多酚和黄酮的含量差异较大,尤其是黄酮含量的种间差异最大。ORAC 和CAA试验结果发现,黍子的多酚和黄酮的总含量与其抗氧化活性线性相关,可作为黍子抗氧化能力的判定依据。黍子作为小杂粮品种,具有超强的抗逆性、较短的生长周期、低廉的价格及潜在的生理活性等特点,然而相对燕麦、荞麦和大麦等杂粮品种,黍子并未受到应有的重视。充分利用黍子资源开发各种功能性食品与保健食品应是黍子开发的一个重要方向。
[1] 王纶, 王星玉, 温琪汾, 等. 中国黍稷种质资源研究与利用[J]. 植物遗传资源学报, 2005, 6(4): 474-477.
[2] 胡兴雨, 王纶, 张宗文, 等. 中国黍稷核心种质的构建[J]. 中国农业科学, 2008, 41(11): 3 489-3 502.
[3] 王星玉, 王纶, 温琪汾. 黍稷的名实考证及规范[J]. 植物遗传资源学报, 2010, 11(2): 132-138.
[4] 郑璐, 王兴国, 韩飞, 等. 发芽对糜子酚类化合物及抗氧化活性的影响[J]. 食品工业科技, 2015, 36(16): 124-128.
[5] 林松. 茶多酚在抗心脑血管疾病上的开发[J]. 广东茶业, 2001(1): 33-34.
[6] 赵敏, 李书田, 于占斌, 等. 内蒙古糜子资源与综合利用[J]. 内蒙古农业科技, 2007(6): 101-102.
[7] 赵扬帆, 郑宝东. 植物多酚类物质及其功能学研究进展[J]. 福建轻纺, 2006(11): 107-110.
[8] 刘正理, 夏雪岩. 关于糜子育种和产业发展策略的商榷[J]. 农学学报, 2009(9): 17-20.
[9] 乔治军. 糜子产业发展现状与思路[J]. 作物杂志, 2013(5): 25-27.
[10] 盖琼辉, 王百姓, 王东. 16个糜子新品种在陇东干旱地区的应用评价[J]. 种子, 2015, 34(5): 103-106.
[11] 门果桃, 陈强, 范挨计, 等. 内蒙古糜子产业发展现状与对策[J]. 内蒙古农业科技, 2009(2): 79-82.
[12] 刘勇, 姚惠源, 王强. 黄米醇溶蛋白对小鼠胆固醇代谢的调节作用[J]. 华东理工大学学报: 自然科学版, 2007, 33(2):195-199.
[13] 徐元元, 国旭丹, 贺丽霞, 等. 常见6种杂粮与2种主粮的抗氧化活性比较研究[J]. 食品科学, 2012, 33(7): 20-25.
[14] 郑璐, 王兴国, 韩飞, 等. 发芽对糜子酚类化合物及抗氧化活性的影响[J]. 食品工业科技, 2015, 36(16): 124-128.
[15] 刘清, 李玉, 姚惠源. Folin-Ciocalteu比色法测定大麦提取液中总多酚的含量[J]. 食品科技, 2007, 32(4): 175-177.
[16] 张素斌, 廖燕婷. 4种甜荞麦黄酮提取方法的比较研究[J]. 食品与机械, 2012, 28(6): 150-153.
[17] 徐维盛, 李东, 刘静, 等. ORAC法对12种水果总抗氧化能力评价研究[J]. 食品工业, 2014(1): 247-250.
[18] 王立峰. 薏米中多酚类物质对抗氧化、抗肿瘤和降血脂作用的评价研究[D]. 无锡: 江南大学, 2012: 3-7.
[19] WOLFE Kelly L, KANG Xin-mei, HE Xiang-jiu, et al. Cellular antioxidant activity of common fruits[J]. Journal of Agricultural & Food Chemistry, 2008, 56(18): 8 418-8 426.
[20] SONG Wei, DERITO Christopher M, LIU M Keshu, et al. Cellular antioxidant activity of common vegetables[J]. Journal of Agricultural & Food Chemistry, 2010, 58(11): 6 621-6 629.
[21] 张泽生, 侯冬梅, 贺伟, 等. 植物甾醇对高血脂大鼠血脂水平的影响[J]. 食品科学, 2011, 32(11): 306-309.
[22] ZHANG Li-zhen, LIU Rui-hai, NIU Wei. Phytochemical and antiproliferative activity of proso millet[J]. Plos One, 2014, 9(8): 327-343.
The antioxidant activity and its relationship with the functional components in proso millet
ZHENG Nan-nan1,2QIWen-tao2WANGChun-ling1YUNTing-ting2YAOYang3RENGui-xing3
(1.TianjinUniversityofScience&Technology,Tianjin300222,China; 2.AcademyofStateAdministrationofGrain,Beijing100037,China; 3.InstituteofCropSciencesofCAAS,Beijing100081,China)
The effects of proso millets on the antioxidant activity of liver were evaluated by the high-fat diet C57BL/6 mice model, and the relationship of antioxidants with the contents of main bioactive compounds in proso millets were also studied based on the chemical and cellular analyses of the polyphenols and flavonoids contents. The results showed that the high-fat diet reduced the hepatic antioxidant capacity of liver, while the addition of proso millets could improve it significantly with a high-fat diet. The contents of both polyphenols and flavonoids were significantly different among different breeds of proso millets. The variation coefficient of total polyphenol was 63.61%, ranging from 0.78 to 3.44 mg/g, while that of the total flavonoid content was 68.46%, ranging from 0.89 to 10.17 mg/g. The Oxygen Radical Absorbance Capacity (ORAC) and cellular antioxidant activity (CAA) of different breeds of proso millets were found different. Moreover, both of the ORAC and CAA of proso millet were correlated with the total contents of polyphenols and flavonoids, shown a positive linear relationship, and the linear coefficients (R2) were 0.81 and 0.57, respectively.
proso millet; antioxidant activity; polyphenols; flavonoids; linear relationship
10.13652/j.issn.1003-5788.2016.12.030
粮食公益性行业科研专项(编号:201313006-5)
郑楠楠,女,天津科技大学在读硕士研究生。
綦文涛(1977—),男,国家粮食局科学研究院副研究员,博士。E-mail:qwt@chinagrain.org
2016—11—28
