α-半乳糖苷酶辅助饱和硫酸铵法制备IgG及其活性研究
2016-02-18肖雪莉张盛贵徐荣荣吕锦第
肖雪莉 张 珍 张盛贵 徐荣荣 狄 蕊 吕锦第 刘 雅
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
α-半乳糖苷酶辅助饱和硫酸铵法制备IgG及其活性研究
肖雪莉 张 珍 张盛贵 徐荣荣 狄 蕊 吕锦第 刘 雅
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
以新鲜牦牛血为原材料,采用α-半乳糖苷酶辅助饱和硫酸铵盐析处理获得免疫球蛋白G(immunoglobulin G,IgG),选取酶解时间、酶解pH、酶解温度、酶添加量4个因素,在4个单因素的基础上,利用响应面分析法,得到α-半乳糖苷酶辅助饱和硫酸铵法制备IgG的最佳酶解条件。并采用ELISA方法检测经过酶处理后样品IgG活性含量。结果表明,酶解时间2 h、酶解pH 4.4、酶解温度39 ℃、酶添加量5 mL(467.5 U),在该工艺条件下,IgG的含量最高,可达27.13 mg/mL,比不加酶处理IgG含量(22.35 mg/mL)提高了21.39%(P<0.05)。经过酶处理后样品IgG活性含量为15.92 mg/mL,比不加酶处理IgG活性含量(16.07 mg/mL)下降了0.93%。
牦牛血;α-半乳糖苷酶;饱和硫酸铵;免疫球蛋白G(IgG);活性
牦牛血液中有丰富的蛋白质,全血中蛋白含量为(15.5±0.8)%(其中:血浆中为6.9%±0.7%,血细胞中32.7%±0.9%),是非常理想的蛋白质资源[1-2]。哺乳动物和人类的血液、组织液等液体中普遍存在IgG,IgG具有重要的免疫和生理调节作用[3]。目前甘肃等西部地区牦牛屠宰后牦牛血液直接排放,不但污染环境,也浪费了资源。
传统提取IgG的方法主要有盐析法[4]、有机溶剂沉淀法[5]、双水相法[6]3种,但3种方法只能提取IgG粗品。IgG作为一种糖蛋白,其表面糖基决定了特异性抗原决定簇引起的免疫排斥效应[7]。采用α-糖基转移酶去除IgG表面的聚糖,断裂非还原末端的α-D-半乳糖苷键,水解成为D-半乳糖、D-甘露糖等单糖[8],暴露了与抗原结合部位,使之更易与抗原发生特异性结合,或与之结合得更紧密[9]。可有效降低免疫排斥效应从而增强免疫反应[10],同时IgG在去糖基化酶处理后是否保持活性以及含量准确性的变化等问题也值得深入研究。在常规盐析法基础上去除糖基后探讨对IgG含量和活性的影响,在国内外相关文献中未见报道。
本试验拟以牦牛血液为原料,在饱和硫酸铵盐析处理基础上结合α-半乳糖苷酶酶解去除IgG表面聚糖,研究去糖基化对IgG含量及活性的影响,以期为今后IgG免疫排斥方面提供一定的理论支持
1 材料与方法
1.1 材料与仪器
牦牛血:甘肃甘南玛曲屠宰厂;
α-半乳糖苷酶:酶活93.5 U/mL,美国Sigma公司;
牛IgG对照品、羊抗牛IgG抗体:抗体效价比1∶16~1∶32,北京金生科技有限公司;
牛血清白蛋白:纯度98%,上海中秦化学试剂有限公司;
酶联免疫试剂盒:美国Wksu-BIO公司;
高速冷冻离心机:H-1850R型,长沙湘仪离心机仪器有限公司;
紫外分光光度计:UV722S型,北京普析通用仪器有限责公司;
酶标分析仪:RT 6000型,美国Thermo公司。
1.2 试验方法
1.2.1 工艺流程

1.2.2 牦牛血清预处理 参照岳喜庆等[11]的方法,略有改动:新鲜牦牛血中加入1/10原血液体积浓度为3.8%的柠檬酸钠作为抗凝剂,混匀后,将已抗凝的血液于4 ℃、5 000 r/min 条件下,离心处理20 min,沉降血细胞,上清液即为血清,-20 ℃下冷藏备用。
1.2.3α-半乳糖苷酶溶液的配置 将a-半乳糖苷酶溶于50 mL 3.5 mol/L(NH4)2SO4、CH3COONa缓冲液中,调整pH到5.5,酶溶液的酶活为93.5 U。
1.2.4 盐析 参照金晶[12]27的方法。

1.2.6 IgG含量测定 参照郭斌等[14]的方法。
1.2.7 IgG活性的测定 参照任杰等[9]的方法,修改如下:样本孔中加入待测样本50 μL(稀释500倍的样本改为稀释600倍)。
1.2.8 单因素试验设计
(1) 酶解pH 对IgG含量的影响:取5 mL牦牛血清经过预处理与饱和硫酸铵盐析后的样液,在酶解温度45 ℃,酶解时间3 h,酶的添加量7 mL,酶解pH为4.0,4.5,5.0,5.5,6.0的条件下,进行酶解处理,确定最佳酶解pH。
(2) 酶解温度对IgG含量的影响:取5 mL牦牛血清经过预处理与饱和硫酸铵盐析后的样液在pH 4.5,酶解时间3 h,酶的添加量7 mL,酶解温度为35,40,45,50,55 ℃的条件下,进行酶解处理,确定最佳酶解温度。
(3) 酶解时间对IgG含量的影响:取5 mL牦牛血清经过预处理与饱和硫酸铵盐析后的样液在pH 4.5,酶解温度45 ℃,酶的添加量7 mL,酶解时间为1,2,3,4,5 h的条件下,进行酶解处理,确定最佳酶解时间。
(4) 酶解添加量对IgG含量的影响:取5 mL牦牛血清经过预处理与饱和硫酸铵盐析后的样液在pH 4.5,酶解温度45 ℃,酶解时间3 h,酶的添加量为1,3,5,7,9 mL的条件下,进行酶解处理,确定最佳酶解添加量。
1.2.9 响应面试验设计 试验中将酶解温度、酶解时间、pH、酶添加量关键工艺参数进行优化。通过单因素试验确定各因素的影响范围,并确定各试验因素的中心水平值,采用四因素五水平二次回归正交旋转组合试验设计,以酶解温度、酶解时间、pH、酶添加量为自变量,IgG浓度响应值,设计4 因素29 组试验的回归正交旋转组合的分析试验。
2 结果与讨论
2.1 IgG含量的标准曲线
由图1可知,可见分光光度法测得IgG标准曲线为:y=0.171 0x+0.100 0,R2=0.999 0;IgG的含量在0.5~3.0 mg/mL 时,吸收度和含量呈良好的线性关系。
2.2 IgG活性标准曲线的绘制
由图2可知,可见分光光度法测得IgG活性标准曲线为:y=0.073 53x+0.044 9,R2=0.999 4;IgG活性含量在4~20 μg/mL时,吸收度和含量呈良好的线性关系。

图1 IgG含量的标准曲线
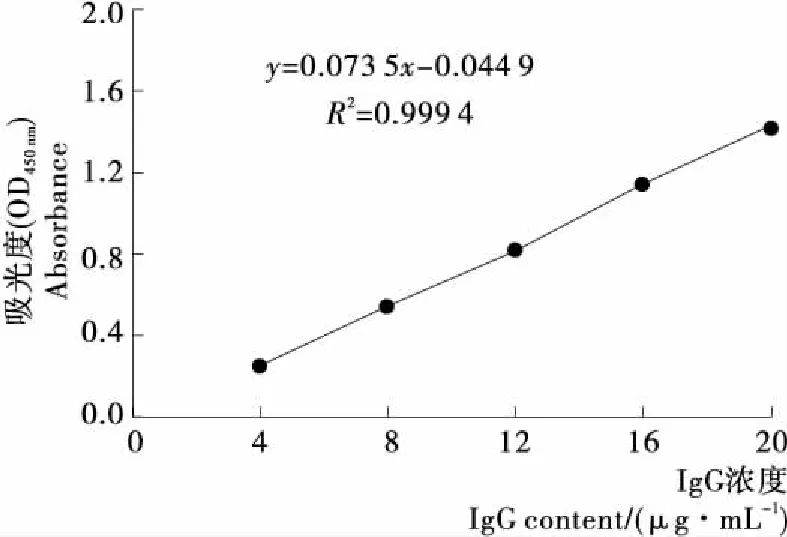
图2 ELISA试剂盒测定牦牛血中IgG的标准曲线
Figure 2 ELISA kit was developed for the determination of IgG in yak blood standard curve
2.3 单因素试验结果
2.3.1 酶解pH 对IgG含量的影响 由图3可知,IgG含量随着pH的增加呈现先增大后减小的趋势,在pH为4.5时,IgG含量达到最大,IgG含量为27.19 mg/mL,并与其他水平有显著性差异(P<0.05),在pH 5.0,5.5,6.0时IgG含量分别比pH为4.5降低了20.47%,16.30%,15.90%,IgG在pH 4.0,IgG结构变化,会发生部分变性[15]。由于pH在过高条件下,α-半乳糖苷酶的(His、Asp、Cys)极性氨基酸基团被修饰,酶活损失,影响α-半乳糖苷酶的酶解IgG速率以及甘露糖半乳糖释放速率,综上所述,选用pH 4.5是较优选择。
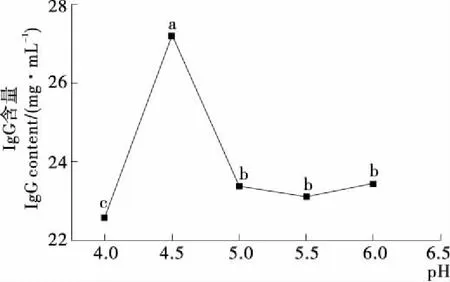
不同字母表示a值在0.01条件下差异显著(P≤0.05);相同字母表示a值在0.01条件下差异不显著(P>0.05)
图3 酶解pH 对IgG含量的影响
Figure 3 Effect of enzymatic hydrolysis pH on the IgG content
2.3.2 酶解温度对IgG含量的影响 由图4可知,IgG含量随着温度的提高呈现先升高后降低的趋势,温度40 ℃时,IgG浓度达到最大,IgG含量为26.62 mg/mL并与其他水平有差异。在温度35 ℃时,IgG含量最低,这是因为在酸性环境中,IgG对于温度更加敏感,开始失活的温度有所降低[16]。在温度40 ℃时,IgG含量提高了17.37%,这是因为温度增高,分子运动加快,溶解、扩散程度也加快,有利于有效成分的提出。但温度过高,有些有效成分被破坏,酶的活性降低,甚至失活。当温度为45,50,55 ℃时,IgG含量相比40 ℃时分别下降了5.05%,12.61%,16.75%,由于随着温度的进一步升高,α-半乳糖苷酶的变性程度进一步加大,不利于反应的进行,酶解温度以40 ℃为宜。

不同字母表示a值在0.01条件下差异显著(P≤0.05);相同字母表示a值在0.01条件下差异不显著(P>0.05)
图4 酶解温度对IgG含量的影响
Figure 4 Effect of enzymatic hydrolysis temperature on the IgG content
2.3.3 酶解时间对IgG含量的影响 由图5可知,IgG含量随着酶解时间的延长呈现先增大后降低的趋势,在酶解时间为2 h时,IgG浓度达到最大,IgG含量为26.32 mg/mL,在酶解时间为1 h时,IgG含量较低,这是因为酶解时间过短,反应不充分,不能完全酶解IgG。当酶解时间为2 h时,IgG含量提高了17.76%,当酶解3 h时,IgG含量下降0.84%(P>0.05),与2 h时没有显著性差异。这是因为底物与产物已经达到溶解平衡,水解时间过长,作用底物被消耗水解度随之下降。在酶解时间为4,5 h时,IgG含量分别下降了4.44%,6.52%,这是因为随着酶解产物的增加,加快了逆反应的进行,反应速率随之下降,所以IgG含量也会下降,酶解时间以2 h为宜。
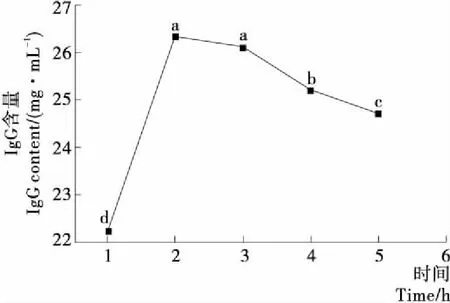
不同字母表示a值在0.01条件下差异显著(P≤0.05);相同字母表示a值在0.01条件下差异不显著(P>0.05)
图5 酶解时间对 IgG含量的影响
Figure 5 Effect of enzymatic hydrolysis time on the IgG content
2.3.4 酶添加量对IgG含量的影响 由图6可知,IgG含量随着酶添加量的加入呈现先增大后降低的趋势,在酶添加量为5 mL时,IgG含量达到最大,IgG含量为26.27 mg/mL。酶添加量为1 mL,IgG含量相比5 mL时分别下降了11.17%,有显著性差异(P<0.05),这是因为随着酶添加量的升高,与底物的接触面积增大。当酶的添加量达到饱和时,继续添加酶时,底物浓度相对较低,酶与底物竞争,会对酶产生抑制作用。当酶的添加量为7 mL和9 mL时,IgG含量分别降低了0.42%,1.08%,同时酶解中间产物会改变盐溶液的构成,影响IgG的析出与酶的接触面积、副产物会导致逆反应的发生不利于IgG含量的进一步提高,综上所述,选用5 mL的酶添加量为宜。

不同字母表示a值在0.01条件下差异显著(P≤0.05);相同字母表示a值在0.01条件下差异不显著(P>0.05)
图6 酶添加量对IgG含量的影响
Figure 6 Effect of add the amount of enzymeon the IgG content
2.4 响应面法确定α-半乳糖苷酶酶解IgG的最佳工艺
通过单因素试验结果,选择IgG含量影响较大的4个因素时间、温度、pH、酶添加量四个因素,根据中心组合试验设计的方案及试验结果见表1。
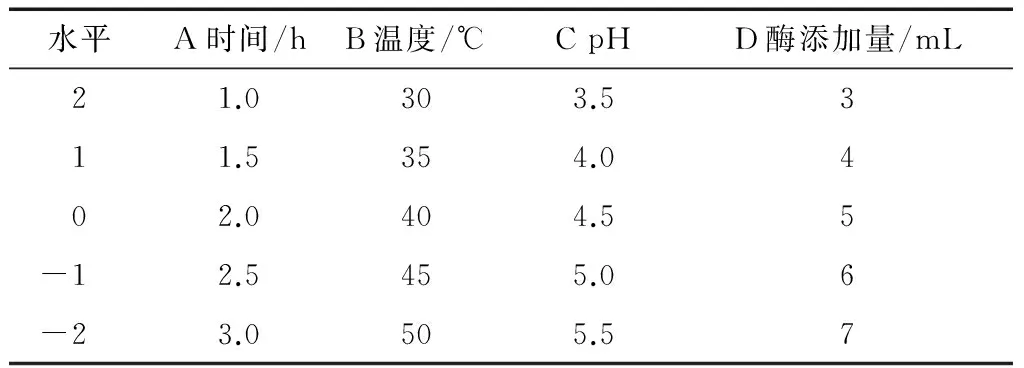
表1 试验编码水平
根据Box-Behnken的统计设计原理,以酶解温度、时间、pH以及酶添加量对IgG浓度影响见表2。以IgG含量值为响应值,得出酶解温度、时间、pH以及酶添加量的编码值为自变量的四元二次回归方程:
Y=29.51-0.23A-0.12B-0.33C-0.042D-0.039AB-0.11AC+0.034AD+7.50E-003BC-0.069BD-0.053CD-0.42A2-0.45B2-0.66C2-0.57D2。
(1)

2.4.1 响应面分析 由表3可知,交互作用中,时间和pH的交互作用对IgG浓度有显著影响,其他P值均大于0.05,说明其显著性不明显。图7显示了当酶解时间一定时,随着酶解pH的增大,IgG浓度呈现先增大后降低的趋势。当酶解pH 4.30~4.50时,IgG浓度最大。当酶解pH一定时,酶解时间1.8~2.0 h时,IgG浓度最大。
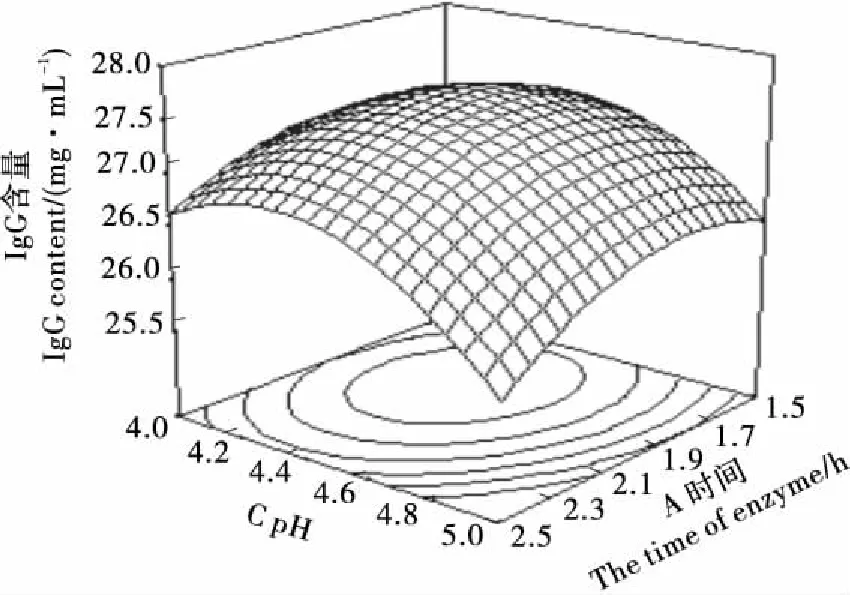
图7 酶解pH、酶解时间对IgG浓度的响应面图

试验号ABCDIgG浓度/(mg·mL-1)11.001.001.001.0025.992-1.001.001.001.0025.7331.00-1.001.001.0025.884-1.00-1.001.001.0025.4451.001.00-1.001.0025.396-1.001.00-1.001.0024.9071.00-1.00-1.001.0025.648-1.00-1.00-1.001.0024.3991.001.001.00-1.0026.23101.001.001.00-1.0025.87111.00-1.001.00-1.0025.7312-1.00-1.001.00-1.0025.50131.001.001.00-1.0025.5414-1.001.001.00-1.0024.79151.00-1.001.00-1.0025.0016-1.00-1.001.00-1.0024.44172.000.000.000.0026.1118-2.000.000.000.0025.53190.002.000.000.0025.79200.00-2.000.000.0025.60210.000.002.000.0025.28220.000.00-2.000.0024.47230.000.000.002.0025.42240.000.000.00-2.0025.05250.000.000.000.0027.37260.000.000.000.0027.60270.000.000.000.0027.46280.000.000.000.0027.57290.000.000.000.0027.54
2.4.2 验证实验 通过对IgG浓度取最大值,由软件自动分析可得到IgG提取工艺最佳理论值;酶解时间1.88 h、酶解温度39.41 ℃、pH 4.39、酶添加量4.97 mL时,IgG浓度为27.58 mg/mL。考虑实际操作的方便,选取酶解时间2 h、酶解温度40 ℃、pH 4.4、酶添加量5.0 mL,进行3次平行实验,最终IgG浓度为27.13 mg/mL,与理论值较为接近,实际值比理论值降低了1.63%,说明该数学模型的建立对牦牛血IgG的获取具有可行性。
2.5 未加酶处理与加酶处理提取IgG含量活性的对比结果
由表4可知,加酶处理后IgG含量显著提高。IgG活性在加酶处理后未有显著性的变化,原因就在于α-半乳糖苷酶是一种外切糖苷酶,酶解只能切除肽链两端的聚糖,酶解程度不大,α-半乳糖苷酶酶解IgG表面少部分聚糖以后,对活性影响不大。

表3 响应面模型的方差分析†
† **表示极显著,P<0.01;*表示显著,P<0.05;-表示不显著,P>0.05。
表4 加酶与未加酶处理IgG含量与活性变化†
Table 4 Changes on IgG contents and activity between enzemy treatment and no enzemy treatment mg/mL

样品IgG含量IgG活性加酶处理27.13b15.92a空白对照22.35a16.07a
† 同列不同字母表示在a=0.05显著水平差异显著(P≤0.05);相同字母表示在a=0.05显著水平差异不显著(P>0.05)
3 结论
不同的酶解条件下,添加α-半乳糖苷酶对 IgG表面聚糖进行酶解,当酶解pH为4.4,酶解温度为39 ℃,酶解时间为2 h,酶解添加量为5 mL(酶活467.5 U)时,IgG含量为27.13 mg/mL,比不加酶含量提高了21.38%,应用ELISA方法检测经过酶处理后样品IgG活性含量为15.92 mg/mL,比不加酶处理IgG(活性含量16.07 mg/mL)活性下降了0.93%(P>0.05)。综上所述,糖基转移酶a-半乳糖苷酶在酶解糖蛋白IgG表面聚糖提高IgG含量以及对活性有所影响。至于IgG表面聚糖去糖基化以后稳定性等问题还有待进一步研究。
[1] 于海燕, 罗永康. 牦牛血理化特性的研究[J]. 肉类研究, 2007(6): 33-36.
[2] 朱森阳, 汪国和, 王志鹏. 畜禽血液资源的开发利用进展[J]. 养殖与饲料, 2007(1): 67-69.
[3] SASAKI M, DAVIS C L, LARSON B L. Production and turnover of IgG1 and IgG2 immunoglobulins in the bovine around parturition.[J]. Journal of Dairy Science, 1977, 59(12): 2 046-2 055.
[4] 照日格图, 敖长金, 斯日古楞. 羊IgG粗品提取方法的研究[J]. 中国饲料, 2009(12):26-27.
[5] 田明玉. 双水相萃取白蛋白和酶的初步研究[D]. 大连: 大连理工大学, 2009: 5-8.
[6] 杜雨. 超声波辅助盐析法提取及双水相法提取纯化牦牛血IgG的工艺条件研究[D]. 兰州: 甘肃农业大学, 2015: 6-8.
[7] 章晓联. 糖基化与免疫[J]. 生命科学, 2011(7): 685-694.
[8] 李孝辉, 陈声明. 微生物源α-半乳糖苷酶的研究进展[J]. 微生物学通报, 2002(2): 71-75.
[9] 任杰, 胡志和, 吴子健, 等. 超高压处理对牛初乳中IgG活性的影响[J]. 食品工业科技, 2013, 34(20): 280-283.
[10] 陈仁芳, 邢益平, 林艳, 等. 乙型肝炎病毒表面抗原中蛋白去糖基化对体液免疫应答的影响[J]. 南京医科大学学报: 自然科学版, 2007, 27(11): 1 209-1 212.
[11] 岳喜庆, 冯巧萍, 张和平, 等. 牛血清免疫球蛋白的盐析法提取与纯化[J]. 中国乳品工业, 2005(3): 16-21.
[12] 金晶. 牦牛血IgG分离纯化工艺研究[D]. 兰州: 甘肃农业大学, 2010.
[13] 刘红霞, 苏卫, 张连峰.α-半乳糖苷酶研究进展[J]. 中国比较医学杂志, 2006, 16(11): 697-720.
[14] 郭斌. 牛初乳免疫球蛋白G的规模化提取关键技术及活性保持技术的研究[D]. 合肥: 安徽农业大学, 2011: 18-19.
[15] 罗磊, 武涛, 丁霄霖. 猪血G型免疫球蛋白稳定性研究[J]. 食品与机械, 2006, 22(6): 20-22.
[16] 庞晨. 牦牛血IgG分离纯化工艺及其稳定性研究[D]. 兰州: 甘肃农业大学, 2011: 32-34.
The preparation of IgG combining the method of Alpha galactose glucoside enzyme with saturated ammonium sulfate and its activity research
XIAO Xue-liZHANGZhenZHANGSheng-guiXURong-rongDIRuiLVJin-diLIUYa
(CollegeofFoodScienceandTechnology,GansuAgricultureUniversity,Lanzhou,Gansu730070,China)
The optimized preparation conditions of the concentration of IgG in yak blood after salting out of saturated ammonium sulfate by single factor experiments, including the selection of the hydrolysis time, pH, temperature and the amount of enzyme, as well as the Central Composite experiment, was investigated in this study. The activity of IgG was detected by ELISA and analyzed by using the Response Surface analysis (RSA). The results showed that the optimal concentration of IgG was 27.13 mg/mL when hydrolyzed for at 39 ℃ for 2 h, and enzymolyzed at pH 4.4, using an enzyme dosage 5 mL (467.5 U), and the content of IgG was 22.35 mg/mL improve 21.28% (P<0.05) under this condition. Moreover, it was also found that the activated content of IgG was changed from 16.07 mg/mL to 15.92 mg/mL, decreased by 0.93%, after the treatment of enzyme.
yak blood;a-galactosidase; saturated ammonium sulfate; immunoglobulin G; activity
10.13652/j.issn.1003-5788.2016.12.008
甘肃省财政厅高校基本业务项目(编号:1011JKCA179);甘肃省农牧厅生物技术专项(编号:GNSW-2013-22);甘肃农业大学导师基金项目;甘肃省自然基金(编号:1107RGZA23)
肖雪莉,女,甘肃农业大学在读硕士研究生。
张珍(1971—),女,甘肃农业大学副教授,博士,硕士生导师。E-mail: 332037918@qq.com
2016-08-13
