外周血单个核细胞hMLH1启动子甲基化与类风湿关节炎发生发展的关系
2016-02-18甄艳凤刘兴宇周云涛丛斌付丽红李淑瑾马春玲倪志宇姚玉霞
甄艳凤,刘兴宇,周云涛,丛斌,付丽红,李淑瑾,马春玲,倪志宇,姚玉霞
外周血单个核细胞hMLH1启动子甲基化与类风湿关节炎发生发展的关系
甄艳凤,刘兴宇,周云涛,丛斌,付丽红,李淑瑾,马春玲,倪志宇,姚玉霞
目的探讨错配修复基因-hMLH1启动子甲基化及基因失活在类风湿关节炎(RA)发生发展中的作用。方法选取2006年4月—2007年4月河北医科大学附属第二医院及第三医院新诊断的RA患者33例为病例组,另选择同期河北省血液中心提供的健康人群38例为对照组。取受试者外周血,以密度梯度离心法分离外周血单个核细胞。分别以RT-PCR法、蛋白印迹法检测外周血单个核细胞hMLH1 mRNA、蛋白相对表达量。经亚硫酸氢钠修饰后,分别设计hMLH1启动子甲基化和非甲基化的DNA引物,检测病例组和对照组患者hMLH1启动子甲基化结果。结果病例组hMLH1 mRNA相对表达量为0.56(0.24,0.69),低于对照组的0.80(0.68,0.93),差异有统计学意义(Z=-3.98,P<0.05)。病例组hMLH1蛋白相对表达量为0.70(0.62,0.76),低于对照组的0.80(0.68,0.94),差异有统计学意义(Z=-2.23,P<0.05)。病例组hMLH1启动子甲基化阳性率为90.9%(30/33),高于对照组的13.2%(5/38),差异有统计学意义(χ2=42.72,P<0.05)。hMLH1启动子甲基化程度与mRNA、蛋白相对表达量呈负相关(rs=-0.866、-0.541,P<0.01)。类风湿因子阳性患者hMLH1 mRNA、蛋白相对表达量低于阴性患者,差异有统计学意义(P<0.05);两者hMLH1启动子甲基化阳性率比较,差异无统计学意义(P>0.05)。结论hMLH1启动子甲基化可能是hMLH1基因失活的重要机制,hMLH1异常高甲基化可能参与了RA的发生发展。
类风湿,关节炎;DNA错配修复;hMLH1;DNA甲基化
甄艳凤,刘兴宇,周云涛,等.外周血单个核细胞hMLH1启动子甲基化与类风湿关节炎发生发展的关系[J].中国全科医学,2016,19(7):808-812.[www.chinagp.net]
Zhen YF,Liu XY,Zhou YT,et al.hMLH1 promoter methylation from peripheral blood mononuclear cells of patients with newly diagnosed rheumatoid arthritis[J].Chinese General Practice,2016,19(7):808-812.
类风湿关节炎(RA)为全身性自身免疫性疾病,患病率为0.3%~0.4%[1],其具体发病机制尚不明确。DNA错配修复(MMR)系统是重要的突变避免系统,通过校正正常DNA代谢中产生的碱基错配及调节DNA损伤所诱导的凋亡来维持基因组的稳定性。MMR为细胞准确复制和增殖的必要手段,若MMR系统异常,细胞突变频率可增加100倍以上[2]。hMLH1基因是维持MMR基因完整性和稳定性的重要基因,其易发生启动子甲基化。hMLH1基因启动子超甲基化普遍存在,并伴有hMLH1蛋白的低表达[3-4]。研究发现,由于MMR基因的缺失,导致结直肠癌、胃癌细胞中的微卫星不稳定性(MSI)[5-6]。RA患者也存在MSI,且其关节内MMR酶合成增加[7-8]。然而,RA患者hMLH1基因启动子甲基化状态如何,与RA发病是否有相关性,国内外尚罕见报道,为此,本研究对其进行了探讨。
1 对象与方法
1.1 研究对象 选取2006年4月—2007年4月河北省第二医院及第三医院新诊断的RA患者33例为病例组,其中男8例,女25例;平均年龄(46±12)岁,均符合1987年美国风湿病协会RA诊断标准[9],并排除已接受药物治疗、非新诊断RA及合并其他疾病者。另选择同期河北省血液中心提供的健康人群38例为对照组,其中男10例,女28例;平均年龄(45±10)岁。两组性别、年龄比较,差异均无统计学意义(=0.04、 t年龄=0.54,P>0.05)。
1.2 方法
1.2.1 主要试剂 hMLH1鼠抗人单克隆抗体购自美国ZYMED公司,亚硫酸氢钠和对苯二酚购自美国New Jersey公司,Sss-1酶购自美国NEB公司,UltraPureTM基因组DNA快速提取试剂盒、RT-PCR、MSP反应体系及TaqDNA聚合酶、引物购自北京赛百盛基因技术有限公司,淋巴细胞分离液购自上海恒信化学试剂有限公司,Tris饱和酚购自武汉博士德生物工程公司,蛋白酶K、RNA酶抑制剂、HEPES购自美国Promega公司。
1.2.2 密度梯度离心法分离外周血单个核细胞[10]取受试者外周血,4 h内从下层吸出全血2 ml,与2 ml 0.9%氯化钠溶液充分吹打混匀,余全血-70℃备用;将充分吹打混匀的混合液用滴管逐滴平铺于2 m l淋巴细胞分离液(比重=1.077 g/cm3)上,二者界面不能打散。4℃条件下密度梯度离心,离心加速度为265×g,2 000 r/min离心20 min;吸出白色膜状的单个核细胞层于EP管中,即得单个核细胞。
1.2.3 RT-PCR法检测外周血单个核细胞hMLH1 mRNA表达 Trizol一步法提取外周血单个核细胞RNA,cDNA合成反应体系20μl,其中5×RT buffer 4.0μl,dNTP 0.8 mmol/L,AMV(1 U/μl)2.0μl,模板RNA 10μl,随机引物(100 pmol/μl)0.5μl。循环参数:30℃预变性10 min,42℃反转录1 h,95℃灭活反转录酶5 min,-20℃备用。hMLH1引物序列参考文献[11],上游:5′-GTGCTGGCAATCAAGGGACCC-3′,下游:5′-CACGGTTGAGGCAATGGGTAG-3′,扩增产物215 bp。根据引物设计原则,应用Primer 5引物设计软件设计内参β-actin引物序列,上游:5′-CATCCTGCGTCTGGACCT-3′,下游:5′-TCAGGAGCAATGATCTTG-3′,扩增产物480 bp。RT-PCR反应体系20μl,其中10×PCR buffer 2.0μl,dNTP 0.2 mmol/L,二氯化镁(MgCl2)2.0 mmol/L,TaqE(1 U/μl)1.0μl,模板DNA 3.3μl,上下游引物(100 pmol/μl)各0.3μl。RT-PCR循环参数:95℃预变性5 min,94℃变性45 s,55℃(hMLH1)/57℃(β-actin)退火1 min,72℃延伸45 s,共35个循环,72℃继续延伸5 min。取10μl PCR反应产物经1.5%琼脂糖凝胶(含溴化乙锭)100 V恒压电泳50 min后,紫外灯下观察结果,拍照,扫描至计算机中。用Gel-pro凝胶分析软件对电泳谱带进行半定量分析,以hMLH1与β-actin凝胶谱带的面积×荧光强度值的比值表示hMLH1 mRNA相对表达量。
1.2.4 蛋白印迹法检测外周血单个核细胞hMLH1蛋白表达 提取外周血单个核细胞核蛋白,hMLH1抗体稀释度为1∶150。阴性对照以PBS代替一抗,以β-actin为参照。将显色条带扫描至计算机中,用UVP凝胶图像分析管理系统对结果进行半定量分析,以hMLH1与β-actin凝胶谱带的面积×荧光强度值的比值表示hMLH1蛋白相对表达量。
1.2.5 hMLH1启动子甲基化检测[12]
1.2.5.1 亚硫酸氢钠修饰 取2~5μg DNA去离子水定容至50μl,加入终浓度为0.2 mol/L的氢氧化钠(NaOH)5.5μl,37℃水浴30 min;加30μl的10 mmol/L对苯二酚,3 mol/L的重亚硫酸钠(pH=5.0)520μl,混匀后,其上覆盖200μl液状石蜡,50℃水浴18 h。按说明书使用基因组DNA快速提取试剂盒纯化去盐,50μl TE buffer洗脱DNA,加入终浓度为0.3 mol/L的NaOH 5.5μl,室温5 min终止反应。加1/10体积的乙酸钠和2倍体积的无水乙醇,-70℃保存1 h;离心加速度为1 879×g,14 000 r/min离心10 min;加入1/3体积70%乙醇溶液洗涤1次,再次离心获得沉淀。所得DNA溶于20μl高压去离子水中,-20℃保存或直接进行PCR扩增。
1.2.5.2 hMLH1启动子甲基化分析 分别设计hMLH1启动子甲基化和非甲基化的DNA引物[13],其中甲基化特异性引物序列上游:5′-TATATCGTTCGTAGTATTCGTGT-3′,下游:5′-TCCGACCCGAATAAACCCAA-3′,扩增产物153 bp;非甲基化特异性引物序列上游:5′-TTTTGATGTAGATGTTTTATTAGGGTTGT-3,下游:5′-ACCACCTCATCATAACTACCCACA-3′,扩增产物124 bp。反应体系25μl,其中10×PCR buffer 5.0μl,dNTP 0.2 mmol/L,MgCl22.0 mmol/L,TaqE(1 U/μl)2.0μl,亚硫酸氢钠修饰的模板DNA 5μl,甲基化或非甲基化特异性上下游引物(100 pmol/μl)各0.5μl。循环参数:97℃预变性3 min,94℃变性45 s,44℃退火1 min,72℃延伸45 s,共35个循环,72℃继续延伸5 min。用胎盘DNA经Sss-1酶催化,亚硫酸氢钠处理后作为阳性对照PCR模板,阴性对照采用去离子水代替模板DNA进行PCR。扩增所得hMLH1甲基化和非甲基化产物,经6%非变性聚丙烯酰胺凝胶电泳进行分析。甲基化特异性引物扩增产物存在判定为甲基化阳性;甲基化特异性引物扩增产物不存在且非甲基化特异性引物扩增产物存在判定为甲基化阴性。
1.3 统计学方法 采用SPSS 11.5统计软件进行统计学分析,正态分布的计量资料以(±s)表示,组间比较采用t检验;非正态分布的计量资料以〔M(P25,P75)〕表示,组间比较采用秩和检验;计数资料的分析采用χ2检验,采用Spearman等级相关分析hMLH1启动子甲基化与hMLH1 mRNA、蛋白的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 外周血单个核细胞hMLH1 mRNA表达比较 病例组hMLH1 mRNA相对表达量为0.56(0.24,0.69),低于对照组的0.80(0.68,0.93),差异有统计学意义(Z=-3.98,P<0.05,见图1)。
2.2 外周血单个核细胞hMLH1蛋白表达比较 病例组hMLH1蛋白相对表达量为0.70(0.62,0.76),低于对照组的0.80(0.68,0.94),差异有统计学意义(Z=-2.23,P<0.05,见图2)。

图1 病例组和对照组hMLH1 mRNA凝胶谱带Figure 1 hMLH1 mRNA gel bands from the case group and the control group
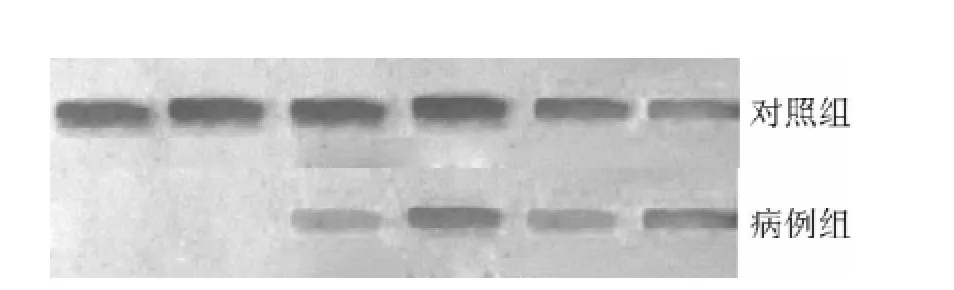
图2 病例组和对照组hMLH1蛋白凝胶谱带Figure 2 hMLH1 protein gel bands from the case group and the control group
2.3 hMLH1启动子甲基化 病例组hMLH1启动子甲基化阳性率为90.9%(30/33),高于对照组的13.2%(5/38),差异有统计学意义(χ2=42.72,P<0.05)。hMLH1启动子甲基化程度与mRNA、蛋白相对表达量呈负相关(rs=-0.866、-0.541,P<0.01)。
2.4 病例组不同临床特征患者hMLH1 mRNA、蛋白相对表达量及其启动子甲基化阳性率比较 病例组不同性别、年龄、C反应蛋白(CRP)与红细胞沉降率(ESR)水平患者hMLH1 mRNA、蛋白相对表达量及启动子甲基化阳性率比较,差异均无统计学意义(P>0.05)。类风湿因子(RF)阳性患者hMLH1 mRNA、蛋白相对表达量低于阴性患者,差异有统计学意义(P<0.05);两者hMLH1启动子甲基化阳性率比较,差异无统计学意义(P>0.05,见表1)。
3 讨论
证据显示,类风湿性滑膜细胞慢性炎症可能导致体细胞突变,使滑膜细胞变形形成攻击性滑膜,侵略骨和软骨,并从其上脱离[14]。而类风湿性滑膜细胞中存在的DNA损伤和突变[15],常伴有错配修复酶变化及MSI现象[7-8]。
hMLH1位于染色体3p21-23,其基因组DNA全长约58 kb,含19个外显子,cDNA有2 268 bp的开放阅读框架,编码蛋白含756个氨基酸[16]。hMLH1基因是错配修复系统的重要组成成分,在错配修复过程中具有识别错配的重要功能,其功能缺陷使DNA复制时出现的错配难以得到有效修复,常表现为MSI的发生[17-18]。
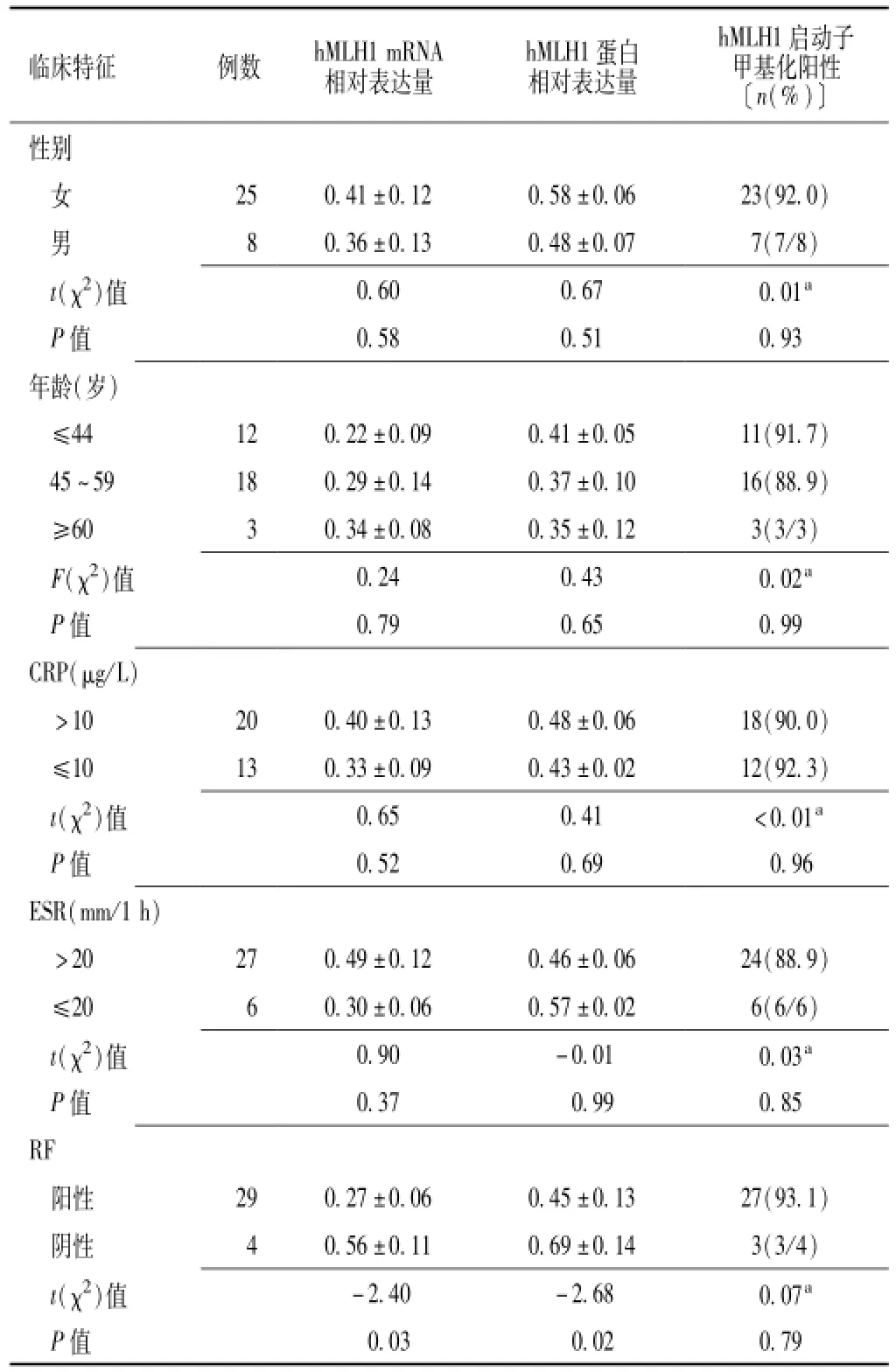
表1 病例组不同临床特征患者hMLH1 mRNA、蛋白相对表达量及其启动子甲基化阳性率比较Table 1 Comparison of hMLH1 mRNA,protein relative expression and promoter methylation positive rate among patients with different clinical features in the case group
本研究发现,RA患者外周血hMLH1启动子甲基化阳性率为90.9%,明显高于健康人群的13.2%。hMLH1启动子的异常甲基化与hMLH1 mRNA及蛋白表达呈负相关,提示甲基化可能是导致hMLH1蛋白表达缺失的重要机制之一。当hMLH1启动子发生异常甲基化时,在细胞传递信号的影响下转录激活复合物呈分散状态,无法作用于DNA分子,导致转录失活,因此不能表达错配修复蛋白,使其错配修复基因功能丧失,最终导致RA的发生及发展。
hMLH1启动子异常甲基化导致hMLH1蛋白表达减少或缺失,影响hMLH1错配修复功能的发挥,可能导致单核苷酸多态位点的出现。已有研究显示,RA患者存在MSI现象,hMLH1基因的功能缺陷使DNA复制时出现的错配难以得到有效修复,常表现为MSI[7-8],而hMLH1表达的缺失与该基因启动子胞嘧啶甲基化直接有关。推测hMLH1启动子甲基化可能参与或影响RA的发生发展。本研究发现,RF阳性患者hMLH1 mRNA、蛋白表达均低于RF阴性患者,RF阳性与阴性患者间hMLH1基因启动子甲基化阳性率无差异,提示hMLH1 mRNA、蛋白表达减少参与RA疾病过程,但未发现hMLH1启动子甲基化与RA病情活动和严重程度存在相关性,hMLH1启动子甲基化可能只是RA发病的早期事件,参与了RA疾病的发生。本研究样本较少,也可能没有足够的证据证明hMLH1基因启动子甲基化与RF的关系。
综上所述,RA患者外周血hMLH1启动子呈异常超甲基化状态,其影响hMLH1转录和蛋白表达,可能参与了RA疾病的发生发展。
作者贡献:甄艳凤进行课题设计与实施、资料收集整理、撰写论文、成文并对文章负责;付丽红、李淑瑾、马春玲、倪志宇、姚玉霞协助进行课题实施、评估、资料收集;刘兴宇、周云涛、丛斌进行质量控制及审校。
本文无利益冲突。
[1]Wu ZB,Wang HK,Zheng CH,et al.Prevalence of rheumatoid arthritis in Chinese army force[J].Journal of the Fourth Military Medical University,2004,25(24):2190-2192.(in Chinese)吴振彪,王宏坤,郑朝晖,等.我军不同兵种在不同地区类风湿性关节炎患病的流行病学调查[J].第四军医大学学报,2004,25(24):2190-2192.
[2]Marinus MG.DNA mismatch repair[J].Ecosal Plus,2012,5(1).doi:10.1128/ecosalp lus.7.2.5.
[3]CoppedèF,Migheli F,Lopomo A,etal.Gene promotermethylation in colorectal cancer and healthy adjacent mucosa specimens:correlation with physiologicaland pathological characteristics,and with biomarkers of one-carbon metabolism[J].Epigenetics,2014,9(4):621-633.
[4]Sakata K,Tamura G,Endoh Y,et al.Hypermethylation of the hMLH1 gene promoter in solitary and multiple gastric cancers with microsatellite instability[J].Br J Cancer,2002,86(4):564-567.
[5]Woerner SM,Tosti E,Yuan YP,et al.Detection of coding microsatellite frameshiftmutations in DNA mismatch repair-deficient mouse intestinal tumors[J].Mol Carcinog,2015,54(11):1376-1386.
[6]Lee HJ,Jang YJ,Lee EJ,etal.The significance ofmismatch repair genes in gastric cancer[J].JCancer Res Ther,2013,9(1):80-83.
[7]Kullmann F,Widmann T,Kirner A,etal.Microsatellite analysis in rheumatoid arthritis synovial fibroblasts[J].Ann Rheum Dis,2000,59(5):386-389.
[8]Lee SH,Chang DK,Goel A,et al.Microsatellite instability and suppressed DNA repair enzyme expression in rheumatoid arthritis[J]. J Immunol,2003,170(4):2214-2220.
[9]Amett FC,Edworthy SM,Bloch DA,et al.The America rheumatoid association 1987 revised criteria for the classification of rhanmatoid arthdtis[J].Arthritis Rheum,1988,31(3):315-324.
[10]Deringer JR,Ely RJ,Monday SR,et al.Vbeta-dependent stimulation ofbovine and human T cells by hostspecific staphylococcal enterotoxins[J].Infect Immun,1997,65(10):4048-4054.
[11]Herman JG,Graff JR,Myohanen S,et al.Methylation-specific PCR:a novel PCR assay formethylation status of CpG islands[J]. Proc Natl Acad Sci USA,1996,93(18):9821-9826.
[12]Nagy G,Koncz A,Telarico T,et al.Central role of nitric oxide in the pathogenesis of rheumatoid arthritis and sysemic lupus erythematosus[J].Arthritis Res Ther,2010,12(3):210.
[13]Sakurai H,KohsakaM,Liu F,et al.Nitric oxide production and inducible nitricoxide synthase expression in inflammatory arthritides[J].JClin Invest,1995,96(5):2357.
[14]Mukai T,Gallant R,Ishida S,et al.SH3BP2 gain-of-function mutation exacerbates inflammation and bone loss in amurine collagen-induced arthritis model[J].PLoS One,2014,9(8):e105518.
[15]Viatte S,Plant D,Raychaudhuri S.Genetics and epigenetics of rheumatoid arthritis[J].Nat Rev Rheumatol,2013,9(3):141-153.
[16]Veigl ML,Kasturi L,Olechnowicz J,et al.Biallelic inactivation of hMLH1 by epigenetic gene silencing,a novel mechanism causing human MSI cancers[J].Proc Natl Acad Sci USA,1998,95(15):8698-8702.
[17]Kane MF,Loda M,Gaida GM,et al.Methylation of the hMLH1 promoter correlateswim lack of expression ofhMLH1 in sporadic colon tumors and mismatch repair defecfive human tumor cell lines[J]. Cancer Res,1997,57(5):808-811.
[18]Psofaki V,Kalogera C,Tzambouras N,et al.Promotermethylation status of hMLH1,MGMT,and CDKN2A/p16 in colorectal adenomas[J].World J Gastroenterol,2010,16(28):3553-3560.
hMLH1 Promoter Methylation From Peripheral Blood Mononuclear Cells of PatientsW ith New ly Diagnosed Rheumatoid Arthritis
ZHEN Yan-feng,LIU Xing-yu,ZHOU Yun-tao,et al.The Second Department of Endocrine,Tangshan Gongren Hospital,Tangshan 063000,China
ObjectiveTo explore promotermethylation and gene inactivation ofmismatch repair gene-hMLH1 in the genesis and developmentof rheumatoid arthritis(RA).MethodsA total of 33 RA patients diagnosed in the second and third hospital of HebeiMedical University from April2006 to April2007 were enrolled as the case group and at the corresponding period another 38 healthy persons from Hebei Province Blood Center were recruited as the control group.Peripheral blood mononuclear cells from subjects were separated by density gradient centrifugation.hMLH1 mRNA and protein relative expression of peripheral blood mononuclear cells were detected by RT-PCR and Western-blotting.DNA primers of promoter methylation and nonmethylation were designed respectively after sodium bisulfite modification.Promoter methylation of patients in two groups were detected.ResultshMLH1 mRNA relative expression of the case group was 0.56(0.24,0.69),lower than 0.80(0.68,0.93)of the control group(Z=-3.98,P<0.05).hMLH1 protein relative expression of case group was 0.70(0.62,0.76),lower than 0.80(0.68,0.94)of the control group(Z=-2.23,P<0.05).hMLH1 promotermethylation positive rate of the case group was 90.9%(30/33),higher than 13.2%(5/38)of the control group(χ2=42.72,P<0.05). hMLH1 promotermethylation was negatively correlated withmRNA and protein relative expression(rs=-0.866,-0.541,P<0.01).hMLH1mRNA and protein relative expression of patientswith positive rheumatoid factorswere lower than those of the patients with negative rheumatoid factors(P<0.05).The difference of hMLH1 promoter methylation positive rate between patients with positive and negative rheumatoid factors was not significant(P>0.05).ConclusionhMLH1 promoter methylation may be a crucial mechanism of hMLH1 gene inactivation.hMLH1 promoter abnormal hypermethylation may be involved in the occurrence and development of RA.
Rheumatoid,arthritis;DNA mismatch repair;hMLH1;DNA methylation
R 593.22
A
10.3969/j.issn.1007-9572.2016.07.015
2015-09-21;
2015-12-29)
(本文编辑:吴立波)
河北省自然科学基金资助项目(H2014105040)
063000河北省唐山市,唐山市工人医院内分泌二科(甄艳凤),神经外科(刘兴宇),中心实验室(周云涛);河北医科大学法医学系(丛斌,付丽红,李淑瑾,马春玲,倪志宇,姚玉霞)
丛斌,050017河北省石家庄市,河北医科大学法医学系;E-mail:jane791115@126.com
