慢病毒介导核转录因子-κB诱导激酶和IκB激酶连接蛋白基因沉默对人结肠癌细胞上皮-间质转化的影响▲
2016-02-17梁梦紫黄杰安刘诗权覃蒙斌诸葛春凤徐春燕陈楚杰
梁梦紫 黄杰安 刘诗权 覃蒙斌 彭 鹏 诸葛春凤 徐春燕 李 倩 陈楚杰
(广西医科大学第一附属医院西院消化内科,南宁市 530007,E-mail:337001572@qq.com)
论著·基础研究
慢病毒介导核转录因子-κB诱导激酶和IκB激酶连接蛋白基因沉默对人结肠癌细胞上皮-间质转化的影响▲
梁梦紫 黄杰安 刘诗权 覃蒙斌 彭 鹏 诸葛春凤 徐春燕 李 倩 陈楚杰
(广西医科大学第一附属医院西院消化内科,南宁市 530007,E-mail:337001572@qq.com)
目的 探讨慢病毒介导的核转录因子-κB诱导激酶 和 IκB 激酶连接蛋白(NIBP)基因沉默后对人结肠癌HCT116细胞上皮-间质转化(EMT)的影响。方法 通过DNA重组技术,进行设计并构建人NIBP基因的慢病毒载体以及无关序列的Lenti-EGFP慢病毒载体,感染HCT116细胞后分别为转染组(NIBP-RNAi组)和阴性对照组(NC组),而未予转染处理的HCT116细胞则为空白对照组(CON组)。将实验分为非肿瘤坏死因子-α(TNF-α)组和TNF-α组:非TNF-α组包括NIBP-RNAi组、NC组、CON组,TNF-α组包括NIBP-RNAi+TNF-α组(NIBP-RNAi+组)、NC+TNF-α组(NC+组)、CON+TNF-α组(CON+组),其中TNF-α组均予TNF-α进行干预。检测非TNF-α组NIBP mRNA及蛋白的表达情况,以及各组上皮性钙黏附分子(E-cadherin)和神经性钙黏附分子(N-cadherin) mRNA及蛋白的表达;采用倒置相差显微镜观察各组细胞形态的变化。结果 NIBP-RNAi组NIBP的mRNA 及蛋白表达均显著低于NC组及CON组(P<0.05);与CON组比较,CON+组、NC+组的细胞发生明显的EMT,E-cadherin的mRNA和蛋白的表达均明显降低、N-cadherin的mRNA和蛋白的表达均明显上升(P<0.05),NIBP-RNAi组及NIBP-RNAi+组的细胞由间质细胞形态转变为上皮细胞形态,E-cadherin的mRNA和蛋白的表达均明显上升、N-cadherin的mRNA和蛋白的表达均明显降低(P<0.05);而CON组和NC组比较,以及CON+组和NC+组E-cadherin及N-cadherin 的mRNA和蛋白表达比较,差异均无统计意义(P>0.05)。结论 靶向下调NIBP基因表达可抑制人结肠癌HCT116细胞EMT的发生。
结肠癌;核转录因子-κB诱导激酶 和 IκB 激酶连接蛋白;肿瘤坏死因子-α;上皮-间质转化;慢病毒
结肠癌是一种常见的消化道恶性肿瘤,其发生发展是一个多因素相互作用的结果,预后主要与侵袭转移与否有关。因此,早期防治结肠癌的侵袭转移是改善预后的关键。目前研究发现, 核转录因子-κB诱导激酶和IκB 激酶连接蛋白(nuclear factor κB-inducing kinase and Iκβ kinase binding protein,NIBP)基因,是核转录因子-κB诱导激酶(nuclear factor κB-inducing kinase,NIK)/IκB 激酶(Iκβ kinase,IKK)/转录因子-κB(nuclear factor κB,NF-кB)信号通路中的一类可将NF-кB的非经典途径关键酶-NIK与经典途径关键激活子-IKKβ连接成三聚体的支架蛋白。NIBP在NF-кB经典通路的激活剂肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作用下可增强肿瘤细胞的侵袭能力[1-2]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞通过特定的程序转化为间质细胞样表型的生物学过程[3]。近年来研究发现,EMT是许多恶性肿瘤侵袭转移的重要机制[4]。
国外研究报告,NF-кB信号通路可通过诱导转录因子Snail的表达从而抑制细胞上皮标志物上皮细胞钙黏附分子(E-cadherin)的表达,使细胞间黏附缺失,促进肿瘤细胞的侵袭和转移[5]。 人肾皮质近曲小管上皮细胞HK-2和单核细胞共培养后,可通过NF-кB信号通路上调细胞间黏附分子-1的表达,使E-cadherin的表达下降,纤维连接蛋白(Fibronectin)表达增加,从而诱导HK-2细胞EMT的发生[6]。Zhu等[7]通过研究发现,在人胃癌细胞中用南蛇藤提取物进行干预后,能有效抑制由转化生长因子-β1(transforming growth factor-β1,TGF-β1)诱导的EMT现象,同时在TNF-α作用下的NF-кB信号通路的活化程度也受到抑制。我们的前期研究也发现,NF-кB在不同活化状态下可影响结肠癌细胞的EMT发生[8]。而有关NIBP基因沉默后在人结肠癌细胞EMT中的作用和机制的研究尚未见报告。因此,我们拟通过慢病毒介导NIBP基因沉默,观察NIBP基因沉默后对人结肠癌HCT116细胞株 EMT的影响,为结肠癌的靶向治疗提供新的线索。
1 材料与方法
1.1 材料
1.1.1 细胞系及实验分组:人结肠癌HCT116细胞购自上海中国科学院;实验分为非TNF-α组和TNF-α组,非TNF-α组包括未转染处理的HCT116细胞组(CON组)、以无关序列的Lenti-EGFP慢病毒载体感染HCT116细胞的阴性对照组(NC组)以及含有人NIBP基因的慢病毒载体感染HCT116细胞的转染组(NIBP-RNAi组);TNF-α组包括CON加TNF-α组(CON+组)、NC加TNF-α组(NC+组)以及NIBP-RNAi加TNF-α组(NIBP-RNAi+组),TNF-α的终浓度为20 ng/mL,均培养4 d。1.1.2 实验试剂:重组慢病毒载体均由美国Invitrogen公司构建;TNF-α购自美国Sigma-Aldrich公司(批号:SLBJ0062V);兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(批号:0112)、NIBP(批号:0003)、E-cadherin(批号:0020)和神经性钙黏附分子(N-cadherin,批号:0001)单克隆抗体均购自美国Cell Signaling Technology公司;IRDye800标记的羊抗兔二抗购自LI-COR公司;RNAsio、反转录试剂盒和SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)均购自日本TaKaRa Biotechnology公司(批号:AK6503);PCR引物设计及合成由TaKaRa Biotechnology公司合成;胎牛血清购于美国ExCell公司(批号:420820);杜氏改良Eagle培养基(Dulbecco′s modified Eagle′s medium,DMEM)购于美国Gibco公司(批号:8114437)。
1.2 方法
1.2.1 细胞培养:人结肠癌HCT116细胞株用含10%胎牛血清的DMEM培养基,在5% CO2、37℃、饱和湿度条件下传代培养,并选用对数生长期的细胞进行实验。
1.2.2 慢病毒介导稳定下调NIBP表达:取对数生长期人结肠癌HCT116细胞按5×104个/孔接种于24孔板,另取一孔加入HEK293T细胞(购自上海中国科学院)作为对照,取出低温保存的病毒液溶化后与培养基混合,加入培养孔内,同时加入8 μg/ml聚凝胺提高感染效率,第2天后开始观察细胞的感染效率。加入杀稻瘟菌素(blasticidin,BSD)筛选,挑选单克隆进行传代培养,建立稳定干扰的NIBP表达的HCT116细胞,再进行后续实验。1.2.3 荧光实时定量-PCR检测:检测非TNF-α组NIBP mRNA的表达情况,以评价NIBP的沉默效率,同时检测各组细胞E-cadherin和N-cadherin基因mRNA的相对表达量。非TNF-α组加等量的培养基,TNF-α组加含TNF-α的等量培养液,TNF-α的终浓度为20 ng/ml,均培养4 d后将细胞收集,并采用RNAsio试剂法提取各组细胞总RNA,采用分光光度计检测RNA浓度及纯度。均各取1 μg总RNA按反转录说明书合成cDNA备用。各基因根据GenBank(http://www.ncbi.nlm.nih.gov/genbank/)提供的序列,设计引物见表1。QRT-PCR反应条件为95℃ 30 s,95℃ 5 s,60℃ 34 s,72℃ 45 s,40个循环,72℃ 7 min,荧光信号检测。以GAPDH作为内参照,每个基因的每个样品设3个重复扩增管。实验重复3次,数据采用相对双△Ct法,按公式2-△△Ct行定量分析。

表1 相关基因的引物序列
1.2.4 Western Blot检测:检测非TNF-α组NIBP蛋白表达情况,以评价NIBP的沉默效率,同时检测各组细胞E-cadherin和N-cadherin基因蛋白的表达量。非TNF-α组加等量的培养基,TNF-α组加含TNF-α的等量培养液,TNF-α的终浓度为20 ng/ml,均培养4 d后将细胞收集,加入蛋白裂解液及苯甲基磺酰氟,冰上静置30 min。4℃、12 000 r/min离心10 min,取上清移至新的离心管中,聚氰基丙烯酸正丁酯法测蛋白浓度, 沸水煮5 min后每孔上样300 ng,经10% 十二烷基硫酸钠-聚丙酰胺凝胶电泳分离后转移至聚偏(二)氟乙烯膜,用5%脱脂牛奶封闭1 h,再分别加兔抗人NIBP、E-cadherin、N-cadherin单克隆抗体(1 ∶1 000)、兔抗人GAPDH抗体(1 ∶1 000) 4 ℃过夜,吐温磷酸缓冲盐溶液(Tween 20-phosphate-buffered saline,TBST)洗涤后,IRDye 800标记的羊抗兔二抗(1 ∶5 000)室温孵育1 h。TBST洗涤后,采用LI-COR公司 Odyssey双色红外荧光成像系统采集图像,以GAPDH为内参照对E-cadherin、N-cadherin进行灰度值分析。
1.2.5 倒置相差显微镜观察细胞形态:取对数生长期的细胞,0.25%胰蛋白酶消化后制成合适浓度的细胞悬浮液,并接种至6孔板中,贴壁后按实验设计,非TNF-α组加等量的培养基,TNF-α组加含TNF-α的等量培养液,TNF-α的终浓度为20 ng/ml,均培养4 d,采用倒置相差显微镜观察细胞形态变化并拍照。
1.3 统计学分析 采用SPSS 16.0软件进行统计学分析,以上实验均重复3次,计量数据以(x±s)表示,比较采用t检验或单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 非TNF-α组NIBP mRNA及蛋白的表达情况 转染细胞后,NIBP-RNAi组细胞中NIBP的mRNA相对表达量及蛋白表达水平均显著低于CON组及NC组(P<0.05),见表2、3及图1。

表2 CON组、NC组、NIBP-RNAi组的NIBP基因mRNA相对表达量(n=3,x±s)
注:与NIBP-RNAi组比较,*P<0.05。

表3 CON组、NC组、NIBP-RNAi组的NIBP基因蛋白的表达量(n=3, x±s)
注:与NIBP-RNAi组比较,*P<0.05。

图1 HCT116细胞中NIBP基因蛋白的表达
2.2 各组细胞E-cadherin和N-cadherin基因mRNA相对表达量的比较 与CON组比较,经20 ng/ml TNF-α干预后的CON+组、NC+组E-cadherin的mRNA表达量明显降低、N-cadherin的mRNA表达量明显上升(P<0.05),NIBP-RNAi组及NIBP-RNAi+组E-cadherin的mRNA表达量上升、N-cadheri的mRNA表达量降低(P<0.05),其中NIBP-RNAi组的表达上升或降低尤为明显;而CON组和NC组比较,以及CON+组和NC+组比较,差异均无统计意义(P>0.05),见表4。

表4 各组细胞中E-cadherin和N-cadherin在mRNA水平的相对表达量(x±s)
注:与CON组相比,*P<0.05、#P>0.05;与CON+组相比,△P>0.05。
2.3 各组细胞中E-cadherin和N-cadherin基因蛋白表达量的比较 与CON组比较,经20 ng/ml TNF-α干预后的CON+组、NC+组E-cadherin的蛋白表达量明显降低、N-cadherin的蛋白表达量明显上升(P<0.05),NIBP-RNAi组及NIBP-RNAi+组E-cadherin的蛋白表达量上升,N-cadherin的蛋白表达量降低(P<0.05),其中NIBP-RNAi组的表达上升或降低尤为明显;而CON组和NC组比较,以及CON+组和NC+组比较,差异均无统计意义(P>0.05),见图2、表5。
2.4 倒置相差显微镜观察在TNF-α干预前后细胞的形态变化 倒置相差显微镜显示,CON组和NC组的细胞大多数呈多边形,可见丝状伪足,细胞间连接较疏松但仍存在一定的紧密连接;而NIBP-RNAi组的细胞形态变圆,丝状伪足明显减少,细胞间连接紧密;经TNF-α干预后,可明显促进细胞的EMT形态的发生,CON+组和NC+组的细胞为细长形,可见细长的丝状伪足增多,细胞间排列更疏松;而NIBP-RNAi +组中可见有伪足不明显、多角形、细胞间排列紧密的细胞,也可见少量具有细长丝状伪足的细胞。见图3。
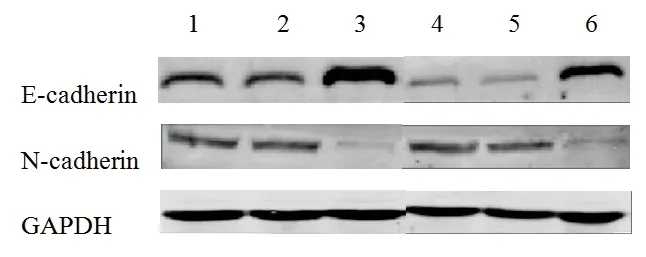
图2 各组细胞E-cadherin、N-cadherin蛋白水平的相对表达量
注:1、CON组;2、NC组;3、NIBP-RNAi组;4、CON+组;5、NC+组;6、NIBP-RNAi+组。

表5 各组细胞中E-cadherin和N-cadherin蛋白的表达量(x±s)
注:与CON组相比,*P<0.05、#P>0.05;与CON+组相比,△P>0.05。
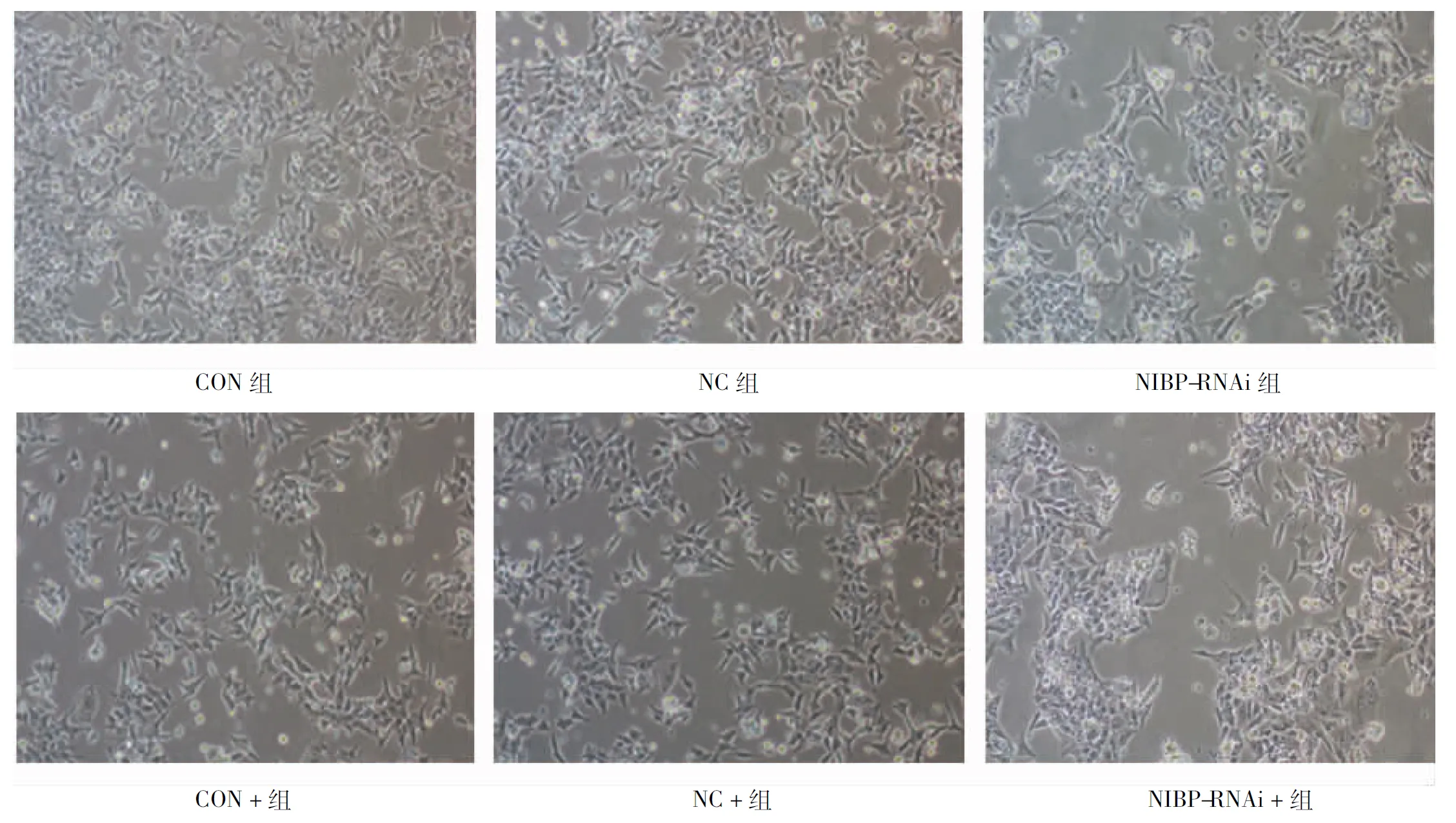
图3 倒置相差显微镜观察各组HCT116细胞的形态(×100)
3 讨 论
结肠癌的发病率分别居于男、女性恶性肿瘤的第三位及第二位[9]。随着生活水平的提高及人们饮食结构的改变,我国结肠癌的发病率呈逐年增长的趋势,给人们的健康与生命带来严重威胁。影响结肠癌预后的最主要的因素为是否转移,然而目前能预测结肠癌发生转移的临床指标尚未明确。
NIBP基因是2005年在人神经细胞中检测出的一种NF-кB信号通路的调节因子,能将NIK与IKK结合成三聚体从而增强NF-кB的活性作用[1]。研究发现,NIK/IKK/NF-кB信号通路在许多肿瘤的发生发展及侵袭转移中均起着重要作用[10-11]。其目前公认的激活途径主要为两条途径,即在外部刺激因子如TNF-α作用下,NIK促使IKKβ磷酸化后进一步使NF-кB二聚体得以释放,从而启动核转录程序的经典途径[12];以及通过NIK与IKKα结合并磷酸化后将p100加工成p52,再进入细胞核发挥作用的非经典途径[13]。NIK对促进这两条途径的激活至关重要。而IKK是NF-кB信号通路的关键激酶,其包括的两个催化亚基IKKα和IKKβ均与NIK结合后而发挥激活作用。最新研究表明,NIBP广泛表达于大多数肿瘤组织中,特别是在乳腺癌和结肠癌,并可能通过NF-кB信号通路的活化促进肿瘤的发生[14]。在NF-кB经典途径激活剂TNF-α的作用下,NIBP还可增强肿瘤细胞的侵袭能力[1,13-14]。此外,在人结肠癌组织中NIBP表达明显上调并参与腺瘤发展为腺癌的过程[15]。本课题组前期采用免疫组化方法检测人结肠癌、结肠腺瘤和正常结肠黏膜组织中的NIBP、p-p100、p52、CD44、波形蛋白和E-cadherin的表达情况,结果发现NIBP、p-p100、p52、CD44、波形蛋白在人结直肠癌组织中的表达均高于结肠腺瘤及正常肠黏膜,而E-cadherin表达结果相反,因此,我们推测NIBP可能也通过激活NF-кB信号非经典途径诱导EMT的发生[16]。本文主要针对NIBP与人结肠癌细胞EMT的关系进行探讨。
EMT是上皮细胞通过特定的程序转化为间质细胞样表型的生物学过程。近年来研究表明,EMT是肿瘤细胞具有迁移、侵袭能力的重要基础[17-18]。EMT在胚胎发育、创伤愈合、肿瘤的侵袭转移等过程中发挥着重要作用,其具有高抗凋亡能力并能使细胞内相关蛋白表达的改变[3,7,19]。EMT最基本的特征是上皮组织细胞的特征性丢失,同时伴有间质细胞的特征性存在。发生EMT后,表现为上皮细胞的细胞间紧密连接消失,细胞由多边形鹅卵石样变为梭形的纤维细胞样形态;细胞失去极性,黏附能力下降,具有较强的侵袭、转移能力[20-21];细胞的上皮标志物如E-cadherin表达下降;而细胞的间质标志物如N-cadherin、波形蛋白等表达增加,转录因子Snail、Slug、ZEB、Twist等表达上调[22]。其中E-cadherin是影响肿瘤侵袭转移较重要的一种蛋白,同时也是EMT的关键分子。其表达下调或抑制和功能丧失都可以启动EMT[23],而EMT早期最重要的过程,是钙黏素E-cadherin和N-cadherin之间的转换。
在本研究中,转染细胞后,NIBP-RNAi组细胞中NIBP的mRNA相对表达量及蛋白表达水平均显著低于CON组及NC组(P<0.05),提示了通过慢病毒载体可有效地介导人结肠癌HCT116细胞NIBP基因的沉默。同时也发现,NIBP-RNAi组细胞下调NIBP表达后,人结肠癌HCT116细胞由轻微的EMT形态,即多边形或梭形、可见丝状伪足、细胞间连接较为疏松但仍存在一定紧密连接的过渡期细胞形态,转变为圆形、丝状伪足明显减少、细胞间连接紧密的上皮细胞形态;而NC组的细胞形态与CON组比较无明显改变。目前已知,TNF-α是NF-кB经典通路的激活剂,其可通过促进NF-кB的激活,进而诱导许多肿瘤EMT的发生。我们的前期研究也证实了TNF-α可活化NF-кB,使P-p65表达增加,从而促进结肠癌细胞的EMT[10]。本实验采用TNF-α进行干预后,CON+组和NC+组均出现明显的EMT现象,细胞呈现间充质样的细长纺锤形、可见明显的细长形丝状伪足增多,细胞散在生长;而NIBP-RNAi +组中伪足不明显、类圆形、排列紧密的上皮样细胞以及少量具有细长丝状伪足的间质样细胞并存着。我们还采用荧光实时定量-PCR和Western Blot分别检测各组细胞的上皮标志物E-cadherin和间质标志物N-cadherin的mRNA及蛋白的表达情况,结果显示,与CON组及NC组对比,经TNF-α干预后的CON+组、NC+组E-cadherin的明显减少、N-cadherin明显增加(P<0.05);而无论有无TNF-α干预的影响,下调NIBP表达后的NIBP-RNAi组及NIBP-RNAi+组细胞的E-cadherin均显著上升,N-cadherin均显著降低(P<0.05),其中在未进行TNF-α干预的NIBP-RNAi组的表达上升或降低尤为明显,可能与TNF-α还可通过p38/激活丝裂酶原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)[24]以及蛋白激酶B(protein kinase B,Akt)/糖原合成酶激酶-3(glycogen synthase kinase-3,GSK-3β)[25]等信号通路促进结肠癌细胞的EMT和侵袭转移有关。以上结果提示,沉默NIBP基因的表达在一定程度上可逆转HCT116细胞的EMT现象。目前研究发现,在小鼠肠道神经细胞中沉默NIBP的表达后可抑制由TNF-α诱导的NF-кB的活化[4]。而增加NIBP在人乳腺癌或人结肠癌细胞中的表达可增强TNF-α诱导激活NF-кB的能力;反之,下调NIBP的表达后明显抑制了肿瘤细胞生长及TNF-α诱导的凋亡[14]。因此我们推测,NIBP可能通过激活NF-кB经典信号通路从而促进结肠癌细胞EMT的发生。
综上所述,应用慢病毒靶向介导沉默NIBP表达可抑制结肠癌EMT的发生,在某种程度上可能减弱由EMT引起的肿瘤侵袭转移能力,且下调NIBP表达可能在抑制由TNF-α诱导NF-кB信号通路的活化从而引起EMT发生的过程中发挥重要作用。这一发现可能为寻找抑制结肠癌侵袭转移的分子靶点及临床治疗提供新的思路。
[1] Hu WH,Pendergast JS,Mo XM,et al.NIBP,a novel NIK and IKK beta-binding protein that enhances NF-kappa B activation[J].J Biol Chem,2005,280(32):29 233-29 241.
[2] Zhang Y,Bitner D,Pontes Filho AA,et al.Expression and function of NIK-and IKK2-binding protein (NIBP) in mouse enteric nervous system[J].Neurogastroenterol Motil,2014,26(1):77-97.
[3] Zhang Z,Liu ZB,Ren WM,et al.The miR-200 family regulates the epithelial-mesenchymal transition induced by EGF/EGFR in anaplastic thyroid cancer cells[J].Int J Mol Med,2012,30(4):856-862.
[4] Chen X,Halberg RB,Burch RP,et al.Intestinal adenomagenesis involves core molecular signatures of the epithelial-mesenchymal transition[J].J Mol Histol,2008,39(3):283-294.
[5] Wellner U,Schubert J,Burk UC,et al.The EMT-activator ZEB1 promotes tumorigenicity by repressing stemness-inhibiting microRNAs[J].Nat Cell Biol,2009,11(12):1 487-1 495.
[6] Li Q,Liu BC,Lv LL,et al.Monocytes induce proximal tubular epithelial-mesenchymal transition through NF-kappa B dependent upregulation of ICAM-1[J].J Cell Biochem,2011,112(6):1 585-1 592.
[7] Zhu Y,Liu Y,Qian Y,et al.Research on the efficacy of Celastrus Orbiculatus in suppressing TGF-β1-induced epithelial-mesenchymal transition by inhibiting HSP27 and TNF-α-induced NF-κ B/Snail signaling pathway in human gastric adenocarcinoma[J].BMC Complement Altern Med,2014,14:433.
[8] 刘宝玉,黄杰安,刘诗权,等.NF-κB对人结肠癌细胞上皮间质转化及侵袭转移的影响[J].世界华人消化杂志,2014,22(23):3 403-3 409.
[9] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[10]Staudt LM.Oncogenic activation of NF-kappa B[J].Cold Spring Harb Perspect Biol,2010,2(6):a000109.
[11]Wu Y,Zhou BP.TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion[J].Br J Cancer,2010,102(4):639-644.
[12]Malinin NL,Boldin MP,Kovalenko AV,et al.MAP3K-related kinase involved in NF-kappaB induction by TNF,CD95 and IL-1[J].Nature,1997,385(6616):540-544.
[13]Xiao G,Harhaj EW,Sun SC.NF-kappaB-inducing kinase regulates the processing of NF-kappaB2 p100[J].Mol Cell,2001,7(2):401-409.
[14]Zhang Y,Liu S,Wang H,et al.Elevated NIBP/TRAPPC9 mediates tumorigenesis of cancer cells through NFκB signaling[J].Oncotarget,2015,6(8):6 160-6 178.
[15]Kim JC,Kim SY,Roh SA,et al.Gene expression profiling:canonical molecular changes and clinicopathological features in sporadic colorectal cancers[J].World J Gastroenterol,2008,14(43):6 662-6 672.
[16]谭 林,刘诗权,覃蒙斌,等.NIBP在结肠癌NF-κB非经典激活通路中的作用及其临床意义[J].世界华人消化杂志,2015,23(8):1 238-1 246.
[17]Bonnomet A,Brysse A,Tachsidis A,et al.Epithelial-to-mesenchymal transitions and circulating tumor cells[J].J Mammary Gland Biol Neoplasia,2010,15(2):261-273.
[18]De Craene B,Berx G.Regulatory networks defining EMT during cancer initiation and progression[J].Nat Rev Cancer,2013,13(2):97-110.
[19]Yang J,Weinberg RA.Epithelial-mesenchymal transition:at the crossroads of development and tumor metastasis[J].Dev Cell,2008,14(6):818-829.
[20]Micalizzi DS,Farabaugh SM,Ford HL.Epithelial-mesenchymal transition in cancer:parallels between normal development and tumor progression[J].J Mammary Gland Biol Neoplasia,2010,15(2):117-134.
[21]Tam WL,Weinberg RA.The epigenetics of epithelial-mesenchymal plasticity in cancer[J].Nat Med,2013,19(11):1 438-1 449.
[22]Sleeman JP,Thiery JP.SnapShot:The epithelial-mesenchymal transition[J].Cell,2011,145(1):162.
[23]Gravdal K,Halvorsen OJ,Haukaas SA,et al.A switch from E-cadherin to N-cadherin expression indicates epithelial to mesenchymal transition and is of strong and independent importance for the progress of prostate cancer[J].Clin Cancer Res,2007,13(23):7 003-7 011.
[24]Bates RC,Mercurio AM.Tumor necrosis factor-alpha stimulates the epithelial-to-mesenchymal transition of human colonic organoids[J].Mol Biol Cell,2003,14(5):1 790-1 800
[25]Wang H,Wang HS,Zhou BH,et al.Epithelial-mesenchymal transition (EMT) induced by TNF-α requires AKT/GSK-3β-mediated stabilization of snail in colorectal cancer[J].PLoS One,2013,8(2):e56 664.
Effect of lentivirus-mediated nuclear factor κB-inducing kinase and Iκβ kinase binding protein gene silencing on epithelial-mesenchymal transition of human colon cancer cells
LIANGMeng-zi,HUANGJie-an,LIUShi-quan,QINMeng-bin,PENGPeng,ZHUGEChun-feng,XUChun-yan,LIQian,CHENChu-jie
(DepartmentofGastroenterology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the effect of lentivirus-mediated nuclear factor κB-inducing kinase and Iκβ kinase binding protein(NIBP) gene silencing on epithelial-mesenchymal transition(EMT) of human colon cancer cell line HCT116.Methods Using recombination DNA technique,NIBP gene lentivirus vector and unrelated sequence lentivirus vector(Lenti-EGFP) were designed and established,and then were transfected into HCT116 cells,which were defined as transfection group(NIBP-RNAi group) and negative control(NC) group.The HCT116 cells without transfection were enrolled as blank control group(CON group).This experiment consisted of non-tumor necrosis factor-α(TNF-α) group and TNF-α group.Non-TNF-α group included NIBP-RNAi group,NC group and CON group,and TNF-α group included NIBP-RNAi+TNF-α group(NIBP-RNAi+group),NC+TNF-α group(NC+group) and CON+TNF-α group(CON+group).And TNF-α group was treated with TNF-α.The expressions of NIBP mRNA and protein were detected in non-TNF-α group.And the mRNA and protein expressions of E-cadherin and N-cadherin were detected in each group.Phase-contrast microscope was used to observe the changes of cell morphology in each group.Results The expressions of NIBP mRNA and protein in NIBP-RNAi group were significantly lower than those in NC group or CON group(P<0.05).CON+group and NC+group obtained obvious EMT in the cells,significantly lower expressions of E-cadherin mRNA and protein,and significantly higher expressions of N-cadherin mRNA and protein compared to CON group(P<0.05).In NIBP-RNAi group and NIBP-RNAi+group,the shape of cells changed from the shape of mesenchymal cell to the shape of epithelial cell,and the expressions of E-cadherin mRNA and protein significantly increased,and the expressions of N-cadherin mRNA and protein significantly reduced compared to CON group(P<0.05).But there were no significant differences in mRNA and protein expressions of E-cadherin and N-cadherin between CON+group and NC+group,or CON group and NC group(P>0.05).Conclusion Targeted down-regulation of NIBP expression can inhibit the incidence of EMT in human colon cancer cell line HCT116.
Colon carcinoma,Nuclear factor κB-inducing kinase and Iκβ kinase binding protein,Tumor necrosis factor-α,Epithelial-mesenchymal transition,Lentivirus
国家自然科学基金(81260365)
梁梦紫(1989~),女,在读硕士研究生,研究方向:消化道肿瘤分子机制。
黄杰安(1965~),男,博士,教授,研究方向:消化道肿瘤分子机制,E-mail:1404991727@qq.com。
R 34;R 735.3
A
0253-4304(2016)06-0753-06
10.11675/j.issn.0253-4304.2016.06.01
2016-02-24
2016-04-30)
