雷帕霉素对肝脏缺血再灌注中线粒体DNA聚合酶γ的调控作用
2016-02-17张莹余曦
张莹 余曦
(1.贵州省人民医院肝胆外科;2.贵州省人民医院急诊外科,贵州 贵州 550002)
雷帕霉素对肝脏缺血再灌注中线粒体DNA聚合酶γ的调控作用
张莹1余曦2
(1.贵州省人民医院肝胆外科;2.贵州省人民医院急诊外科,贵州 贵州 550002)
目的 研究大鼠肝缺血再灌注损伤中mtDNA聚合酶γ的表达情况,以及雷帕霉素对其的调控作用。方法 SD大鼠60只,制作大鼠肝脏缺血再灌注模型,分四组:A组:肝脏缺血30 min无干预组;B组:缺血50 min无干预组;C组:缺血50 min雷帕霉素干预组;D组:假手术组。分别于术后24 h、第3天、第5天处死各组大鼠,取肝组织进行病理检测;采用RT-PCR检测mtDNA聚合酶γ mRNA的表达。结果 C组肝组织病理损害和mtDNA聚合酶γ mRNA表达明显低于B组(P<0.01),术后A组、B组mtDNA聚合酶γ mRNA的表达逐渐降低,C组则一直维持在同一水平。结论 雷帕霉素能够减轻肝脏缺血再灌注损伤,抑制HIRI中mtDNA聚合酶γ mRNA的过度表达,从而对肝脏缺血再灌注损伤起保护作用。
大鼠; 肝脏; 缺血再灌注损伤; 线粒体DNA聚合酶γ; 雷帕霉素
肝脏缺血再灌注损伤(hepatic ischemia-reperfusion injur,HIRI)是临床上肝脏外科常见的病理生理过程,如何减轻HIRI对肝细胞的损伤,保护肝功能,防止肝衰竭一直是国内外研究者十分关注的课题[1]。现有研究[2]已表明,HIRI过程中存在mtDNA损伤,在线粒体DNA(mitochondrial DNA,mtDNA)损伤修复机制中,线粒体DNA聚合酶γ(mitochondrial DNA polymerase γ,mtDNA pol γ)是位于线粒体内唯一的DNA聚合酶,对mtDNA的复制、合成、修复有着重要作用。我们通过建立大鼠HIRI模型,并给予雷帕霉素干预,了解在肝脏缺血再灌注中修复肝脏损伤时mtDNA pol γ的表达情况,并探讨雷帕霉素对HIRI中mtDNA polγ的调控作用 。
1 材料与方法
1.1 材料 由第三军医大学实验动物中心提供SPF级雄性SD大鼠(n=60),体质量200~250g,术前12 h禁食,自由饮水。以灭菌药用蓖麻油配制浓度为0.345 mg/mL的雷帕霉素溶液用于灌胃。总RNA提取及cDNA合成试剂盒由北京天根生物有限公司提供。
1.2 实验动物与制模 60只动物随机分为四组,乙醚气体麻醉,无菌条件下参照Pringle’s[3]法制作大鼠肝脏缺血再灌注模型,切开腹壁后找到第一肝门,以血管夹夹闭,以肝脏表面出现瘀斑为缺血成功表现。A组(18只):肝脏缺血30 min恢复血供;B组(18只):肝脏缺血50 min恢复血供;C组(18只):肝脏缺血50 min恢复血供;D组(6只):假手术对照组:仅翻动肝脏随即关腹。其中C组在术前3 d和术后每日用雷帕霉素[1.5 mg/(kg·d)]灌胃,而A组和B组在术前3 d和术后每日仅用灭菌药用蓖麻油1 mL灌胃一次。各组大鼠于术后24 h、第3天、第5天三个时间点分别处死1/3。
1.3 各组大鼠mtDNA pol γ mRNA的表达 采用RT-PCR方法:提取各组大鼠肝组织总RNA并合成cDNA。mtDNA pol γ mRNA引物设计:F∶5’-TCAAGGAAGTCACGATGG-3’;R∶5’-AGGCACTGGTCAATGTCTAC-3’,扩增长度480 bp;由上海生工提供内参β-actin引物:扩增长度165 bp。PCR反应体:dd H2O 10 μL Mix(含Mg2+)13μL 上、下游引物(0.5 μg/μL)各1 μL ,cDNA 1 μL, 94℃ 3 min;94℃ 30sec, 55℃ 30sec, 72℃ 1 min, 30个循环,72℃延伸10 min,4℃终止。制备2%琼脂凝胶,点样, 120V电泳,40 min后置凝胶成像仪下成像。用Quantity One 4.6.2软件测定各泳道条带面积光密度值(OD),其mRNA相对表达量=目的条带与其相应β-actin的面积光密度比值;用SPSS19.0行单因素方差分析。
1.4 肝脏组织病理学检查 在大鼠处死后快速取部分肝叶修剪为15 mm×15 mm×3 mm大小,于10%中性福尔马林溶液中固定,常规石蜡切片,HE染色,400倍光镜下观察、拍照。
2 结 果
2.1 各组大鼠术后肝组织中mtDNA pol γ mRNA
的表达情况 mtDNA pol γ mRNA及β-actin PCR产物分别于480bp和165bp处显示出清晰单一的条带(图1),各组大鼠mtDNA pol γ mRNA相对表达量经统计学分析,术后24h及术后第3天,A组、B组和C组mtDNA pol γ mRNA表达量均有所升高,其中以B组升高最为显著(P<0.01),至术后第5天 A组、B组mtDNA pol γ mRNA表达量较术后第3天时明显降低(P<0.01,P<0.05),而C组与同组内前一时间点比较均无明显差异(P>0.05)。

注:M.marker.1~4:分别为术后第5天A、B、C、D 4组条带;5~8:分别为术后第3天A、B、C、D 4组条带;9~12:分别为术后第1天A、B、C、D 4组条带。图1 RT-PCR mtDNA pol γ mRNA表达凝胶成像图
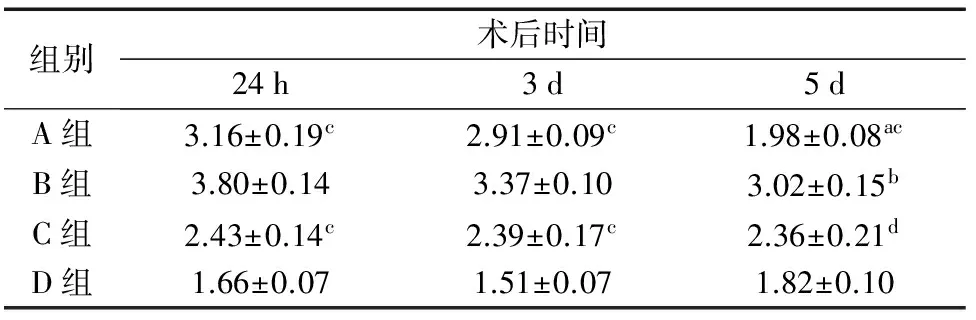
组别术后时间24h3d5dA组3.16±0.19c2.91±0.09c1.98±0.08acB组3.80±0.143.37±0.103.02±0.15bC组2.43±0.14c2.39±0.17c2.36±0.21dD组1.66±0.071.51±0.071.82±0.10
注:与组内前一时间点比较,aP<0.01,bP<0.03;与B组比较,cP<0.01,aP<0.05。
2.2 各组大鼠术后肝脏组织病理变化 各组大鼠肝脏组织HE染色病理切片可见:A组大鼠术后24小时可见肝细胞水肿变性,并可见少许空泡样变,少量炎性细胞浸润,未见坏死细胞,细胞结构完整,(图2A);而同一时间点B组切片可见大面积的细胞坏死,细胞形态亦消失,汇管区有较多的炎性细胞浸润(图2B);C组大鼠术后24 h在靠近汇管区部分肝细胞可见多发性坏死(图2C),但肝细胞索尚存在,与B组比较明显减轻;D组肝细胞结构未见明显异常。
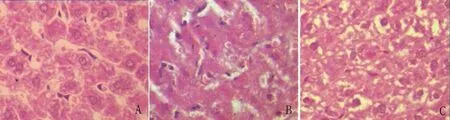
图2 术后24 h、A、B、C组大鼠肝脏组织病理变化(HE×400)
3 讨 论
现有研究[4]表明,组织和细胞的缺血、缺氧会引起线粒体氧化磷酸化过程中的各种载体和呼吸酶的损伤,导致细胞内能量代谢障碍,所产生的过高的氧自由基可对mtDNA带来损害,包括点突变、缺失和插入。研究[5]显示,脑组织缺氧时组织中mtDNA片段缺失率升高。机体对DNA损伤的修复有多条途径,而线粒体内,mtDNA pol γ是唯一的DNA修复酶[6],在mtDNA修复过程中,损伤碱基位点的5’磷酸二脂键由核酸内切酶切割,形成游离的DNA片段,由mtDNA pol γ来填补缺失的碱基空隙,再由DNA连接酶闭合缺口,从而完成DNA的修复[2]。氧化损伤等原因可引起mtDNA pol γ结构、功能的改变,从而影响mtDNA的复制[7]
本研究中我们发现,在再灌注后24 h各组大鼠mtDNA polγmRNA表达升高,其表达强度与肝脏病理损伤程度呈正相关,表明mtDNA pol γ在mtDNA受损早期就已经启动修复,mtDNA pol γ mRNA表达水平及病理损害程度也随着时间延长而逐渐下降。实验中我们还发现,B组大鼠术后24 h mtDNA pol γ mRNA虽然较其它组的表达量明显增高,但病理损害却较重,原因可能是因细胞能量代谢障碍导致其存在较高浓度的氧自由基,影响mtDNA pol γ的活性;另外研究[8]还显示,若mtDNA修复酶表达过高反而会引起恶性病理改变,所以本实验中,我们推测B组大鼠由于其mtDNA pol γ的表达过度升高,影响mtDNA修复系统的动态平衡,从而导致mtDNA进一步的损伤,同时肝脏病理损害重这一现象。
雷帕霉素目前作为免疫抑制剂广泛应用于临床,其可抑制淋巴细胞的增殖[9],并且对线粒体的损伤具有保护作用[10],Y.Dai等[11]发现雷帕霉素可用于治疗mtDNA突变的相关疾病,但在缺血再灌注损伤中是否存在保护机制尚有争论。
本研究中,雷帕霉素干预组肝脏的病理损伤程度明显较轻,表明雷帕霉素能够减轻HIRI损伤。A组、B组及C组术后mtDNA pol γ mRNA表达量较对照组均升高,表明在HIRI后,mtDNA的损伤可直接调控mtDNA pol γ的表达,从而修复受损的mtDNA,而C组始终较B组表达量低,说明雷帕霉素可降低HIRI后mtDNA pol γ mRNA的过度表达,避免产生更严重的病理损害,促进受损mtDNA的修复,维持线粒体的正常功能,减轻HIR的损伤。
[1] Rao J, Qin J, Qian X, et al. Lipopolysaccharide preconditioning protects hepatocytes from ischemia/reperfusion injury (IRI) through inhibiting ATF4-CHOP pathway in mice[J]. LoS ONE, 2013, 8(6) :e65568.
[2] Holt IJ, Reyes A. Human mitochondrial DNA replication[J]. Cold Spring Harbor perspectives in biology, 2012, 4(12): 12971.
[3] Pannen BH, Al-Adili F, BauerM, et al. Role of endothelinsand nitric oxide in hepatic reperfusion injury in the rat[J]. Hepa-tology, 1998, 27(3): 755-764.
[4] 张彦春, 戚豫. 线粒体DNA缺失与疾病[J]. 中华医学杂志, 2013, 93(38):3086-3088.
[5] 李晓峰, 张媚, 郭远瑾,等. 脑出血后神经细胞线粒体DNA缺失的实验研究[J]. 中华老年心脑血管病杂志, 2011, 13(2):168-171.
[6] Lodi T, Dallabona C, Nolli C, et al. DNA polymerase γ and disease: what we have learned from yeast[J]. Frontiers in Genetics, 2015, 6:106.
[7] 丁一宗,李稻.DNA聚合酶γ基因突变研究进展[J].医学综述,2012,18(3):344-347.
[8] 侯伊玲, 薄海, 刘子泉,等.白藜芦醇下调线粒体DNA修复酶对重症急性胰腺炎大鼠胰腺腺泡细胞凋亡的影响[J].世界华人消化杂志,2009,17(28):2892-2898.
[9] 陈广顺,司中洲,李杰群,等.雷帕霉素对大鼠肝脏缺血再灌注损伤的保护作用[J].西安交通大学学报(医学版),2014,35(1):85-88.
[10]McCormick MA,Tsai SY,Kennedy BK.TOR and ageing:a complex pathway for a complex process[J].Philos Trans R Soc Lond B Biol Sci,2011,366(1561):17-27.
[11]Dai Y, Zheng K, Clark J.Rapamycin?drives selection against a pathogenic heteroplasmic mitochondrial DNA mutation[J]. Hum Mol Genet,2014,23(3):637-647.
Regulation & control roles of rapamycin to mitochondrial DNA polymerase γ in hepatic ischemia reperfusion
ZhangYing1,YuXi2.
1.DepartmentofHepatobiliarySurgery; 2.DepartmentofEmergencySurgery,GuizhouProvincialPeople'sHospital,Guiyang,550002,China.
Objective To investigate the regulation & control effects of rapamycin on mitochondrial DNA polymerase γ in hepatic ischemia-reperfusion injury in rats. Methods 60 SD rats were divided into 4 groups for the preparation of whole liver ischemia-reperfusion injury rats model: group A (30min hepatic ischemia without any intervention), group B(50min hepatic ischemia without any intervention), group C (50min hepatic ischemia with preoperative rapamycin lavage), and group D (control group). The execution of rats in each group was done 24h, 3d, and 5d respectively after the operation,then pathological examination of partial liver tissues was performed and RT-PCR was used to detect liver mitochondria DNA polymerase γ mRNA in the specimen. Results The pathological injury of liver tissue and mitochondrial DNA polymerase γ mRNA in group C was evidently lower than that in group B (P< 0.01). After the operation, mitochondrial DNA polymerase γ mRNA decreased gradually in group A and group B and maintained at the same level in group C. Conclusion Rapamycin can alleviate liver ischemia-reperfusion injury, inhibit the excessive expression of mitochondrial DNA polymerase γ mRNA in HIRI, and protect oxidative damage
Rats; Liver; Ischemia-reperfusion injury; Mitochondrial DNA polymerase γ; Rapamycin
贵州省科技厅专项基金[黔科合J(2008)-2302];贵州省优秀青年科技人才基金[黔科合人字(2011)29]
R-332,R575
A
1000-744X(2016)01-0013-03
2015-10-17)
