黑羽鹌鹑ESRβ基因外显子多态性及其与产蛋性状的相关性分析
2016-02-16谢三磊文凤云李俊强刘艺婷
谢三磊,文凤云,李俊强,王 晴,梁 钰,刘艺婷,李 磊,陈 艺
(河南科技大学动物科技学院,洛阳471003)
黑羽鹌鹑ESRβ基因外显子多态性及其与产蛋性状的相关性分析
谢三磊,文凤云*,李俊强,王 晴,梁 钰,刘艺婷,李 磊,陈 艺
(河南科技大学动物科技学院,洛阳471003)
摘 要:试验旨在研究鹌鹑雌激素受体β亚基(ESRβ)基因外显子多态性及其与产蛋性能的关联性,为鹌鹑产蛋性能候选基因的确立及分子标记辅助选育提供理论依据。选取健康蛋用黑羽鹌鹑为研究对象,开产后进行生产性能的持续统计(60d),采用PCR-SSCP法对鹌鹑ESRβ基因多态性进行检测,并运用SPSS 13.0统计软件进行ESRβ基因多态性与生产性能的相关性分析。PCR-SSCP检测结果发现,ESRβ基因外显子1、3、4、5、6、7和8均存在单核苷酸多态性。相关性分析结果表明,在开产蛋质量上,外显子3CD基因型与CC和DD基因型有显著性差异(P<0.05);在开产日龄上,外显子5DD基因型与CD和CC基因型有显著性差异(P<0.05);在平均蛋质量上,外显子7CD基因型与CC和DD基因型有显著性差异(P<0.05)。表明ESRβ基因与蛋用黑羽鹌鹑产蛋性状有一定关联性。
关键词:鹌鹑;ESRβ基因;外显子;SNPs;产蛋性能
鹌鹑蛋营养丰富,相比乌鸡蛋和普通鸡蛋,其蛋白质含量最高,且磷脂含量也较高[1],故有“卵中佳品”之美称[2]。鹌鹑还具有较高的药用价值,对高血压、结核和代谢障碍等疾病有一定的治疗作用[3]。然而影响鹌鹑生产性能与繁殖性能的因素很多,其遗传力低[4],通过常规选育进展较为缓慢。在分子标记基础上建立新一代分子育种技术已成为提高动物生产性能的重要研究方向之一。1940年,日本学者Shimakura首次对鹌鹑形态遗传标记进行了研究,报道了鹌鹑的羽色突变遗传现象。Masaoke-Tsudzuke[5]则对鹌鹑毛色、喙形、脚趾形状及蛋壳颜色等形态标记进行了报道。付晶等[6]以北京白羽蛋用鹌鹑为研究对象,筛选出了能够准确鉴定鹌鹑性别的CHD基因标记。王旭等[7]利用生物信息学方法开发出鹌鹑的6个EST-SSR新的分子标记,并在北京白羽鹌鹑和朝鲜鹌鹑中检测其多态性,结果表明6个标记均可用于鹌鹑的遗传多样性分析。目前,在鹌鹑遗传分析方面虽然取得了一些成果,但相比之下,中国对鹌鹑的遗传研究报道数量仍然较少,且研究进展缓慢,研究内容尚不够深入,尤其是在分子遗传研究领域还存在大量的研究工作有待开展。
雌激素受体(estrogen receptor,ESR)基因广泛存在于各种动物体中,是一种配体激活转录因子家族中的核酸受体[8],能够与特异激素应答DNA元件相结合,进而改变雌激素调控的基因转录,影响动物的繁殖性状及其他生产性能[9]。ESR基因主要有3种亚型:ESRα、ESRβ和ESRγ,分别由不同的基因编码[10]。本研究选择与雌性繁殖周期中卵泡生长发育密切相关的ESRβ基因,以蛋用黑羽鹌鹑作为试验动物,采用PCR-SSCP方法检测单核苷酸多态性,建立鹌鹑ESRβ基因外显子多态性与产蛋性状的相关性,旨在探讨ESRβ基因是否为鹌鹑产蛋性状的主效基因或主效基因的连锁基因,从而利用ESRβ基因进行标记辅助选择,为培养出产蛋性能更高的新型母本群体、提高其繁殖性能提供依据。
1 材料与方法
1.1鹌鹑饲养及产蛋情况记录
蛋用黑羽鹌鹑,共60只,由河南科技大学庞有志老师友情馈赠。鹌鹑饲养采取个体笼养方式。采用鲲鹏饲料有限公司提供的蛋用鹌鹑产蛋后期配合饲料饲喂。
鹌鹑孵化饲养,从开产(7周龄左右)时对鹌鹑群体进行产蛋记录,持续记录2个月(4月16日—6月16日),以获取开产日龄、开产蛋质量、60d产蛋数和60d平均蛋质量等表型数据。
1.2基因组DNA提取
采用禽类全血基因组DNA提取试剂盒(北京鼎国生物技术有限公司)提取蛋用黑羽鹌鹑全血基因组,-20℃保存备用。
1.3引物设计
根据GenBank中鹌鹑ESRβ基因全序列(登录号:AF045149)信息,用在线软件(http://genome.ucsc.edu/cgi-bin/hgBlat?command=start)进行外显子序列查找。应用Primer Premier 5.0设计引物,引物信息见表1。

表1 鹌鹑ESRβ基因各外显子的引物序列Table 1 Primer sequences ofESRβgene exons in quail
1.4 PCR扩增
PCR反应体系为20μL:模板DNA 1μL,10× Buffer 2μL,2.5mmol/L dNTP 1μL,上、下游引物各1μL,TaqDNA聚合酶1μL,ddH2O补足20μL。PCR反应条件:95℃预变性5min;94℃变性30s,退火(退火温度见表1)45s,72℃延伸50s,30个循环;72℃延伸5min;4℃保存。PCR产物经1.5%琼脂糖凝胶电泳检测。
1.5PCR-SSCP分型
将鉴定正确的PCR产物,加入10μL变性上样缓冲液,煮沸10min,迅速冰浴10min,12%聚丙烯酰胺凝胶电泳后,银染,拍照保存结果。根据PCR-SSCP电泳图谱,确定纯合子及杂合子带型。
1.6统计分析
统计鹌鹑ESRβ基因各外显子的不同基因型检出个数,计算基因频率和基因型频率。运用SPSS 13.0统计软件进行基因型与产蛋性状关联分析,结果以平均值±标准误表示,以P<0.05为差异显著性判断标准。
2 结果与分析
2.1鹌鹑ESRβ基因外显子PCR扩增
分别对鹌鹑ESRβ基因外显子1、3、4、5、6、7、8序列进行PCR扩增,扩增片段与预期片段大小一致,部分扩增结果见图1,PCR产物经琼脂糖凝胶试剂盒回收纯化后直接进行PCR-SSCP电泳分析。

图1 鹌鹑ESRβ基因外显子PCR扩增结果Fig.1 PCR amplification ofESRβgene exons in quail
2.2鹌鹑ESRβ基因外显子PCR-SSCP结果
鹌鹑ESRβ基因各外显子基因型均有3种:CC、CD、DD。外显子1的PCR-SSCP检测结果见图2。
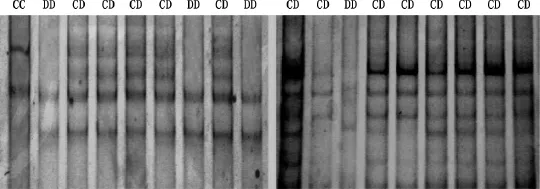
图2 鹌鹑ESRβ基因外显子1PCR-SSCP结果Fig.2 PCR-SSCP result ofESRβgene exon 1in quail
2.3 鹌鹑ESRβ基因外显子基因频率与基因型频率
鹌鹑ESRβ基因各外显子基因频率及基因型频率计算结果见表2。由表2可知,ESRβ基因外显子1两个等位基因C和D频率分别为0.56和0.44;外显子4各基因型频率基本相等;外显子5中CD基因型频率为优势基因型;外显子3、6、7中等位基因C占绝对优势;外显子8中等位基因C、D基因频率分别为0.517和0.483。
经卡方检验表明,鹌鹑外显子3、5达到显著水平(P<0.05),外显子7达到极显著水平(P<0.01),处于Hardy-Weinberg不平衡状态。表明由于长期有目的的人工选育,使群体处于Hardy-Weinberg不平衡状态。
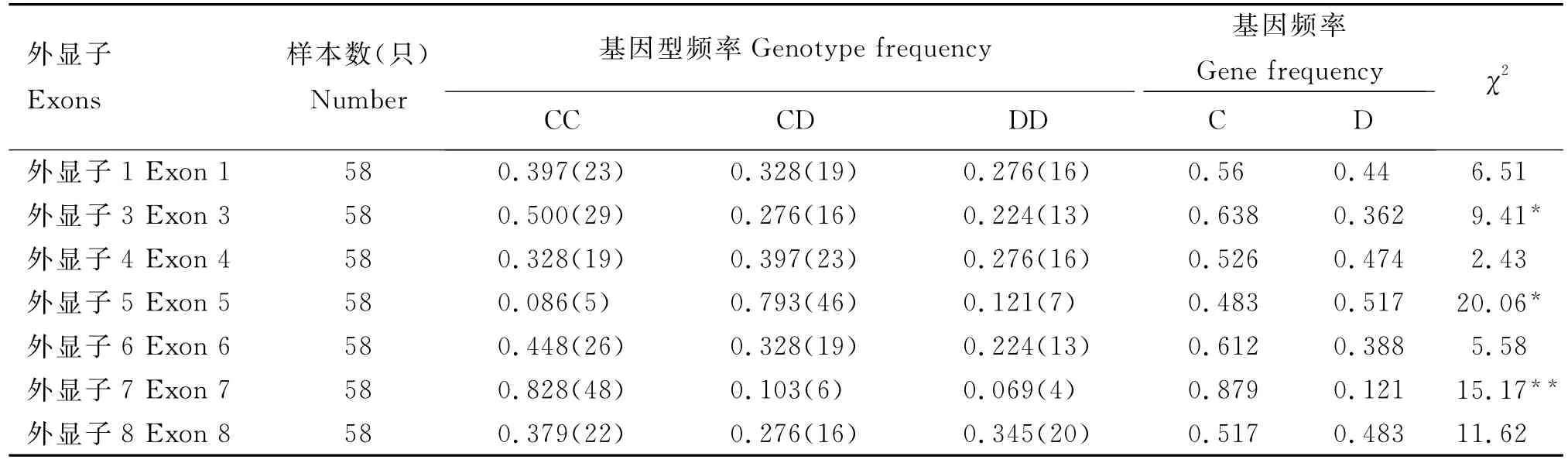
表2 鹌鹑ESRβ基因外显子基因频率及基因型频率Table 2 The gene frequency and genotype frequency ofESRβgene exons in quail
2.4鹌鹑ESRβ基因外显子多态性与产蛋性状的相关性
通过SPSS 13.0软件对黑羽鹌鹑的开产日龄、开产蛋质量、60d平均蛋质量等产蛋相关性状进行分析,获得黑羽鹌鹑不同基因型与早期产蛋性状间相关分析结果见表3。由表3可知,ESRβ基因外显子1、4、6和8多态性位点在开产蛋质量、平均蛋质量、蛋形指数及开产日龄上,3种基因型均没有显著差异(P>0.05);外显子3多态性与鹌鹑产蛋性状的关系中,CD基因型开产蛋质量与CC和DD基因型有显著性差异(P<0.05);外显子5多态性与鹌鹑产蛋性状关系中,DD基因型在开产日龄上与CD和CC基因型有显著性差异(P<0.05);外显子7多态位点与鹌鹑产蛋性状关系中,CD基因型在平均蛋质量上与CC和CD基因型有显著性差异(P<0.05)。另外,外显子1在开产日龄上DD基因型较CC和CD基因型占优势;外显子3在平均蛋质量上CD基因型略大于CC和DD基因型,但差异不显著(P>0.05);外显子4在开产蛋质量上CD基因型略大于CC和DD基因型,而外显子6在开产蛋质量上则是DD基因型略大于CC和CD基因型,但差异均不显著(P>0.05);外显子8在开产日龄上为DD基因型占有优势,但差异不显著(P>0.05)。
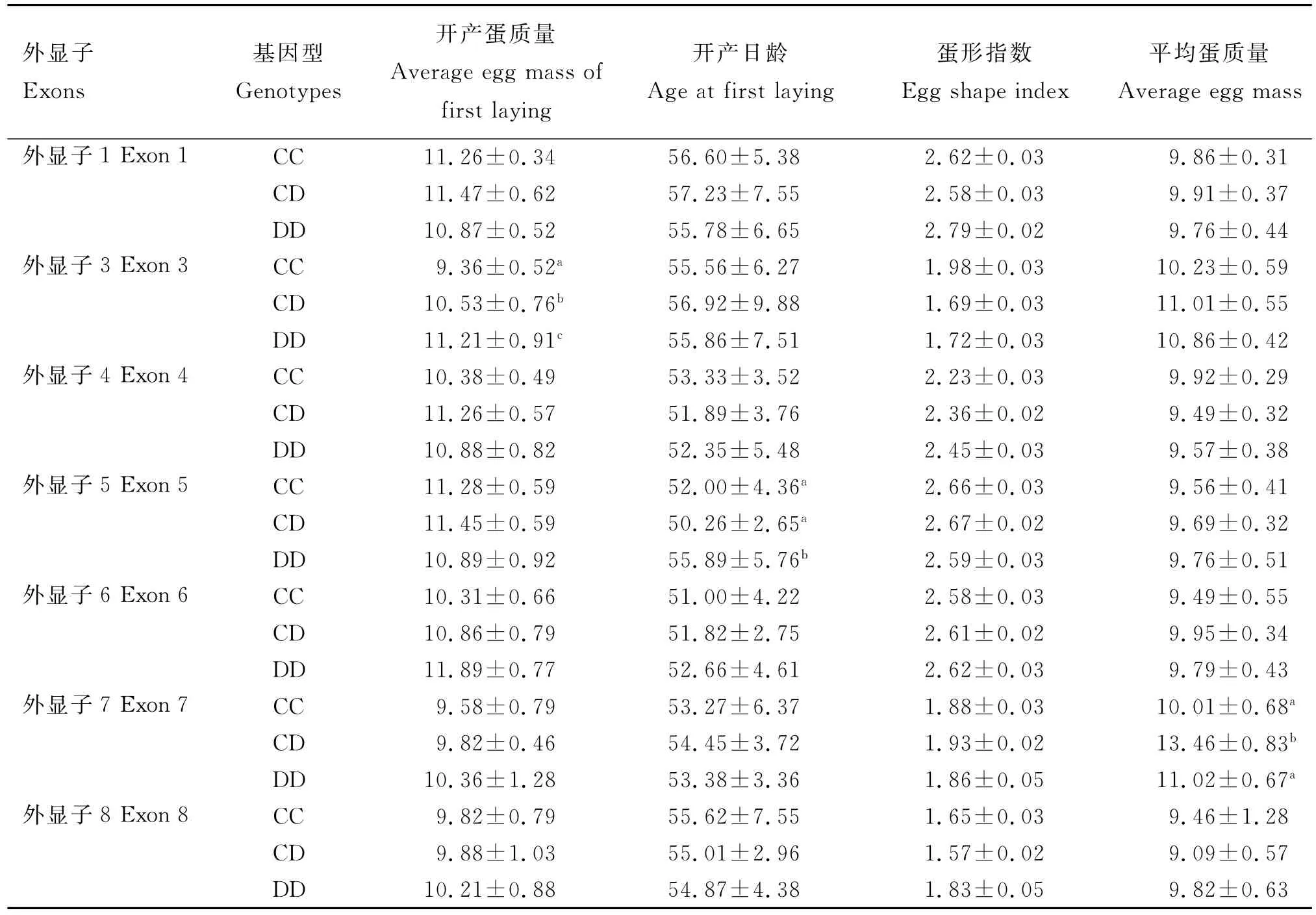
表3 ESRβ基因外显子多态性与鹌鹑产蛋性状相关性分析Table 3 Association between polymorphisms and laying performance ofESRβgene exons in quail
3 讨 论
为了从分子水平上揭示朝鲜鹌鹑、中国黄羽鹌鹑和中国黑羽鹌鹑3个群体遗传结构和亲缘关系,白俊艳等[11]对3个群体进行了微卫星标记的多态性分析,结果发现,中国黄羽鹌鹑群体遗传多样性最为丰富。庞有志等[12]对北京白羽鹌鹑群体的9个微卫星标记遗传多样性分析结果表明,在9个微卫星标记中共存在43个等位基因,有8个微卫星基因座为高度多态性标记,可作为北京白羽鹌鹑群体遗传多样性分析的有效遗传标记。吴胜军等[13]利用微卫星标记技术对朝鲜鹌鹑群体的9个微卫星座位进行了遗传多样性分析,结果共检测出了44个等位基因,表明朝鲜鹌鹑也是遗传多样性较为丰富的群体。基因单核苷酸多态性(single nucleotide polymorphism,SNP)是指基因组中单个核苷酸变异引起的DNA序列多态性[14]。SNP作为第3代分子标记在分子遗传学方面发挥着重要的作用[15]。SNP具有数量多、分布广和稳定遗传等特点[16],与人类的许多疾病、动物的生产性能[17]等密切相关。本研究通过对蛋用黑羽鹌鹑ESRβ基因外显子进行SNP分析,统计鹌鹑的产蛋性状,探讨鹌鹑ESRβ基因外显子与黑羽鹌鹑产蛋性能的相关性,为新型蛋用鹌鹑品系的培育工作提供理论依据。
ESR具有转录调控蛋白质的功能[18],影响着雌激素基因在雌性脊椎动物组织的表达与调控,在胚胎的生长发育中发挥着重要作用[19]。美国IOWA州立大学Rothschild研究组发现,ESRβ基因的PvuⅡ酶切位点多态性,BB基因型比AA基因型母猪产活仔数/胎多0.44~1.15头[9],陈克飞等[20]也得到同样的研究结果。徐宁迎等[21]发现,ESR基因和催乳素受体基因(prolactin receptor,PRLR)对金华母猪所有胎次的总产仔数和产活仔数有显著的交互作用,对经产的初生仔重有极显著的交互作用。Wu等[22]研究结果也表明,ESR基因可以作为长白猪同胎产仔数的选育标记。对小尾寒羊ESR基因的研究结果也提示,ESR基因可能是控制小尾寒羊多胎性能的一个主效基因或与之存在紧密的遗传连锁[23]。在家禽方面,ESR基因也表现出与生产性能密切的关联性。周俊等[24]对ESR基因与绿壳蛋鸡早期产蛋性能相关性研究发现,ESR基因5′侧翼调控区的CC和CD基因型36周平均产蛋量差异显著。王洪才等[25]对庄河大骨鸡研究结果表明,ESR基因各基因型在产蛋数和蛋料比上存在显著差异。于吉英等[26]对文昌鸡繁殖性状与ESR基因多态性关系研究结果表明,ESR基因多态性与300日龄产蛋数相关性显著,与个体平均连产天数的相关性极显著。汤青萍等[27]在海南文昌鸡的研究中得到一致结果,ESR基因多态与产蛋性状中的300日龄产蛋数显著相关,与平均连产天数极显著相关,与400日龄产蛋数、双黄蛋数相关性不显著。以上研究结果表明,ESR基因存在单核苷酸多态性,且与畜禽生产性状密切相关。本研究结果发现,ESRβ基因外显子3与开产蛋质量显著相关;外显子5各基因型与开产日龄显著相关;外显子7与平均蛋质量显著相关。表明ESRβ基因对蛋用黑羽鹌鹑产蛋性状有一定作用。但由于试验个体数目及统计时长等的局限性,仅仅关联性分析的结果还不能确定该基因是否可以作为影响鹌鹑产蛋性状的主效基因或与主效基因紧密连锁的标记基因而起作用,有待进一步研究证实。
4 结 论
本研究在蛋用黑羽鹌鹑群体中分析ESRβ基因外显子多态性与产蛋性能的相关性,发现ESRβ基因与鹌鹑产蛋性能有一定的相关性,但是否可以利用ESRβ基因进行标记辅助选择,还需要进一步验证。
参考文献:
[1] 程瑛琨,鄂晨光,刘明石,等.鸡蛋、乌鸡蛋、鹌鹑蛋营养成分的测定比较[J].饲料工业,2005,26(7):10-12.
[2] 赵国燕.吃香的鹌鹑蛋[J].农产品加工,2009,6:32.
[3] 皮劲松,杜金平,申 杰,等.鹌鹑研究进展[J].安徽农业科学,2007,35(10):2926-2927.
[4] 彭勇博,杜金平,申 杰,等.黄羽鹌鹑产蛋性状遗传参数的估计[J].安徽农业科学,2010,38(2):742-743.
[5] Masaoke-Tsudzuke,陈 蓉,秦玉蓉.鹌鹑形态学和行为学突变以及分子遗传研究进展[J].中国家禽,2009,31(17):47-51.
[6] 付 晶,孙洪霞,白秀娟.鹌鹑性别鉴定的分子标记方法[J].东北农业大学学报,2010,41(1):77-80.
[7] 王 旭,白俊艳,张小辉,等.不同鹌鹑群体EST-SSR标记多态性分析[J].中国家禽,2016,38(3):46-48.
[8] Benita S.Estrogen receptor:Bioactivities and interactions with cell signaling pathways[J].Biologyof Reproduction,1996,54:287-293.
[9] Rothschild M,Jacobson C,Vaske D,et al.The estrgen receptor locus is associated with a major gene influencing litter size in pigs[J].ProceedingsoftheNationalAcademyofScience,1996,93(1):201-205.
[10] Kuiper G G,Enmark E,Pelto-Huikko M,et al.Cloning of a novel receptor expressed in rat prostate and ovary[J].ProceedingsoftheNationalAcademyof Sciences,1996,93(12):5925-5930.
[11] 白俊艳,庞有志,张小辉,等.3个鹌鹑群体的微卫星标记多态性分析[J].中国畜牧兽医,2015,42(9):2444-2452.
[12] 庞有志,白俊艳,张小辉,等.北京白羽鹌鹑微卫星多态性分析[J].江苏农业科学,2015,31(5):1110-1114.
[13] 吴胜军,庞有志,赵淑娟,等.朝鲜鹌鹑微卫星多态性分析[J].河南农业科学,2010,10:112-115.
[14] 唐立群,肖层林,王伟平.SNP分子标记的研究及其应用进展[J].中国农学通报,2012,28(12):154-158.
[15] 史亚兴,卢柏山,宋 伟,等.基于SNP标记技术的糯玉米种质遗传多样性分析[J].华北农学报,2015,30(3):77-82.
[16] 曲娟娟,于 敏,董 蕾,等.SNP在动植物遗传育种中的应用[J].东北农业大学学报,2011,42(12):9-13.
[17] 康静婷,梁前进.单核苷酸多态性的研究及其生物学意义[J].生物学通报,2012,47(3):15-18.
[18] Palshof T,Blichert-Toft M,Daehnfeldt J L,et al.Estradiol binding protein in cystosarcoma phyllodes of the breast[J].EuropeanJournalofCancer,1980,16(5):591-593.
[19] Green S,Walter P,Kumar V,et al.Human estrogen receptor cDNA:Sequense,expression and homology to v-erb-A[J].Nature,1986,320(13):134-139.
[20] 陈克飞,黄路生,李 宁,等.猪雌激素受体(ESR)基因对产仔数性状的影响[J].遗传学报,2000,27(10):853-857.
[21] 徐宁迎,章胜乔,彭淑红.金华猪3个繁殖性状主基因的分布及其效应的研究[J].遗传学报,2003,30(12):1090-1096.
[22] Wu Z F,Liu D W,Wang Q L,et al.Study on the association between estrogen receptor gene(ESR)and reproduction traits in Landrace pigs[J].ActaGeneticaSinica,2006,33(8):711-716.
[23] 毕晓丹,储明星,金海国,等.小尾寒羊高繁殖力候选基因ESR的研究[J].遗传学报,2005,32(10):1060-1065.
[24] 周 俊,虞德病,洪坤月,等.鸡FSHβ和ESRβ基因SNPs分析与早期产蛋性能关系[J].华北农学报,2008,23(5):49-52.
[25] 王洪才,宋天玉,袁晓春.庄河大骨鸡ESR基因多态性及其与产蛋性能关联的分析研究[J].中国农学通报,2012,28(20):43-46.
[26] 于吉英,陈宽维,肖小君,等.ESR、NPY基因对文昌鸡繁殖性状的遗传效应分析[J].畜牧与兽医,2008,40(4):49-51.
[27] 汤青萍,朱文奇,吴 旭,等.ESR基因与文昌鸡产蛋性状的关联性研究[J].云南农业大学学报,2009,24(1):67-70.
(责任编辑 晋大鹏)
中图分类号:S813.3
文献标识码:A
文章编号:1671-7236(2016)12-3293-07
doi:10.16431/j.cnki.1671-7236.2016.12.031
收稿日期:2016-05-18
基金项目:国家自然科学基金(31301940);河南科技大学研究训练计划(SRTP)项目(2009100)
作者简介:谢三磊(1987-),男,河南许昌人,学士,研究方向:兽药残留的快速检测,E-mail:xiesanlei@163.com
通信作者:*文凤云(1979-),女,陕西咸阳人,博士,讲师,研究方向:动物生物化学与分子生物学,Tel:0379-64282341;E-mail:newwfyun@163.com
Single Nucleotide Polymorphisms inESRβGene of Black Plumage Quail and Its Association with Egg Production
XIE San-lei,WEN Feng-yun*,LI Jun-qiang,WANG Qing,LIANG Yu,LIU Yi-ting,LI Lei,CHEN Yi
(CollegeofAnimalScienceandTechnology,HenanUniversityof ScienceandTechnology,Luoyang471003,China)
Abstract:This study aimed to investigate the correlation betweenESRβgene exon polymorphism and egg production of Black plumage egg quail,and provide the theoretical foundation for molecular selection.The healthy Black plumage egg quail were selected as research object,and the egg production were analyzed using SPSS 13.0software.Estrogen receptorβ(ESRβ)subunit gene was selected as candidates gene to screen the genomic variation by PCR-SSCP,and the association of theESRβgene polymorphisms with egg production were analyzed.The results of polymorphisms detection showed that exon 1,exon 3,exon 4,exon 5,exon 6,exon 7and exon 8ofESRβ gene all had nucleotide variation.The association analysis results ofESRβgene exons and egg production showed that the egg weight of first laying of exon 3CD genotype were significantly higher than that of CC and DD genotypes(P<0.05).The age at first laying of exon 5was also significant difference between DD and CC,CD genotypes(P<0.05).Moreover,the average egg weight of exon 7CD genotype was significant higher than that of CC and DD genotypes(P<0.05).These data suggested thatESRβgene could significantly affect egg production of Black plumage egg.
Key words:quail;ESRβgene;exon;SNPs;egg production
