高温高压环境下腐蚀试验溶液pH值的测量
2016-02-14杨向同谢俊峰
杨向同 金 伟 谢俊峰 张 旭 李 岩 姜 锐
(1.中国石油塔里木油田油气工程研究院,新疆 库尔勒 841000;2 .沈阳中科腐蚀控制工程技术中心,辽宁 沈阳 110016)
高温高压环境下腐蚀试验溶液pH值的测量
杨向同1 金 伟2 谢俊峰1 张 旭2 李 岩1 姜 锐2
(1.中国石油塔里木油田油气工程研究院,新疆 库尔勒 841000;2 .沈阳中科腐蚀控制工程技术中心,辽宁 沈阳 110016)
本文主要采用高温高压pH电极测量了试验过程中溶液的pH值,同时研究了不同腐蚀条件下溶液pH值的变化情况。试验结果表明:Cl-浓度的升高促进了腐蚀的发生,溶液的pH升高,其变化速率有增大趋势;CO2分压的升高,溶液的pH值明显降低;在相同腐蚀条件下,P110S的腐蚀较JFE13Cr严重,试验溶液pH值的升高幅度相对于JFE13Cr较大。
高温高压 腐蚀介质 pH值 监测
0 引言
pH值是水溶液最重要的物理化学参数之一,凡涉及水溶液的自然现象、化学变化以及生产过程都与pH有关。因此,pH值的监检测一直以来就是科学研究、工农业生产、临床医学、腐蚀防护及环境保护与监测等领域必不可少的工作。
在腐蚀与防护领域,溶液的腐蚀特性可通过其理化参数来表征,其中pH值的高低是直接影响腐蚀程度的主要因素之一,尤其是在高温高压的腐蚀环境中,pH值对不锈钢局部腐蚀的影响较为显著。
腐蚀溶液中的pH值对环境变化十分敏感,很难采用传统的取样方法进行测定。由于取样过程中温度和压力的改变使得样品中的挥发成份逸出、过渡型阳离子被氧化等,足以使样品的pH值发生不可逆变化。因此高温高压环境下腐蚀溶液原位pH值的监测对认识腐蚀过程中pH值的变化显得格外重要。
1 试验方案
1.1 试验原理
选用一个适用于高温高压环境的pH电极,将其安装在高压反应釜釜盖上使其可以伸入釜内溶液中,pH电极在溶液中有选择性的渗透外层膜的离子形成电化学边界层,结合Ag/AgCl参比电极、pH计测得溶液的实时电位,再利用能斯特方程计算出对应电位值的pH值,实现高压釜内腐蚀溶液pH值的实时测量[1]。
1.2 试验材料和试样
试验材料取自JFE 超级13Cr油管用不锈钢。
试样尺寸为50×10×3mm ,试样的6个工作面先后采用200#、400#、800#、1200#金相砂纸进行逐级打磨,除去加工刀痕及毛刺,使其表面粗糙度达到1.6μm。
1.3 试验条件
按要求配制氯离子浓度一定的溶液。反算所需化学试剂发现钠离子剩余,因一价阳离子对腐蚀影响甚微,故以氯离子为准。试验温度设定为70℃,试验过程中需向腐蚀环境中通入一定量的CO2气体。
1.4 试验装置和设备
pH测量选择使用温度在0~85℃范围内的高温高压玻璃pH电极如图1所示,测量范围0~13,精确度为±0.3;参比电极选用高温高压Ag/AgCl参比电极;试验设备是电化学腐蚀试验高压釜如图2所示。

图1 高温高压pH电极

图2 电化学腐蚀试验高压釜
1.5 试验方法
首先对高温高压pH电极进行校正,即选取三种pH标准缓冲液(pH=4.14、pH=6.85、pH=8.88),利用参比电极和pH计测得三个溶液的电位值,建立电位E和pH值的一次函数关系;其次进行高压釜试验,在试验周期内测得不同时间的溶液的电位值,在将其代入E-pH一次函数中,计算得出试验溶液的pH值,最后绘制pH值与腐蚀时间的关系,分析试验结果。
2 试验结果与分析
2.1 高温高压玻璃基pH电极的校正
通过试验测得的70℃条件下各pH标准缓冲液的电位值如表1所示。
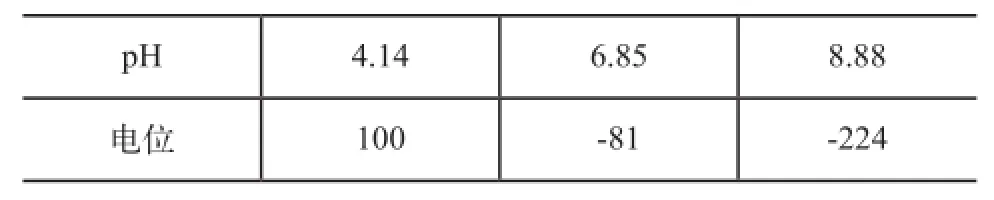
表1 70℃条件下各pH标准缓冲液对应的电位值
利用表1测得的试验数据,建立电位E和pH值的一次函数关系,如图3所示。

式中:x — 电极电位(mv);
y — pH值。

图3 70℃时E-pH一次函数关系
2.2 高压釜试验腐蚀溶液pH的测量
(1)不同氯离子浓度对溶液pH值的影响
在70℃高温高压釜浸泡试验中,利用玻璃基pH电极和参比电极实时测得不同氯离子浓度的(74000mg/L、128000mg/L、218000mg/L)试验溶液的电位,记录电位E数据,将其代入公式(1)计算出对应电位的pH值,同时绘制试验过程中溶液的pH变化曲线,如图4所示。

图4 不同氯离子浓度试验溶液的pH值随时间变化情况
从图4中可以看出:随着试验的进行,溶液pH值均有不同程度的升高。该部分试验是在高氯离子浓度、3.2MPa二氧化碳分压和70℃条件下完成的。试验中试样发生腐蚀的主要因素是CO2的存在,由于CO2溶于水生成碳酸所引起的。CO2腐蚀是一个电化学腐蚀过程,其反应过程如下:
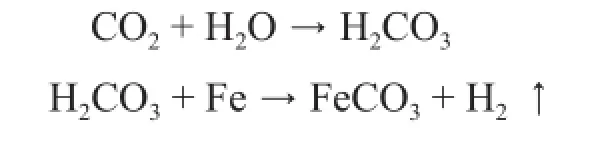
由方程式得知:在CO2腐蚀过程中,CO2溶于水生成的H2CO3在腐蚀进程中是被慢慢消耗的,从腐蚀理论上讲溶液的pH值是会升高的,实验结果与理论结果相一致。

图5 JFE13Cr在不同氯离子浓度溶液中的平均腐蚀速率
当Cl-浓度分别为74000 mg/L、128000mg/L和218000mg/L时,JFE13Cr的平均腐蚀速率分别为0.0343mm/a、0.0363mm/a和0.0374mm/a,随着Cl-浓度的增加平均腐蚀速率有较小程度的增大。在酸性环境下,随着腐蚀的发生,溶液的pH值理论上是应该逐渐增大的,图4中显示溶液的pH值均有不同程度的升高,实际情况与理论结果一致,并且图4中还可以看出随着Cl-浓度的增加,溶液pH-t曲线的斜率增大,这可能是因为Cl-浓度的升高降低了不锈钢试样表面钝化膜形成的可能性或加速不锈钢试样表面钝化膜的破坏,从而促进腐蚀的发生,增加了试样发生腐蚀的几率,而CO2溶于水形成的碳酸的消耗量也随着腐蚀的发生或加重明显增加,最终导致pH的变化率提高,即溶液pH-t曲线的斜率增大[2];
(2)不同二氧化碳分压对溶液pH值的影响
在70℃高温高压釜浸泡试验中,利用玻璃基pH电极和参比电极实时测得不同氯离子浓度的(2.8MPa、3.6MPa、4.0MPa)试验溶液的电位,记录电位E数据,将其代入公式(1)计算出对应电位的pH值,同时绘制试验过程中溶液的pH变化曲线,如图6所示。
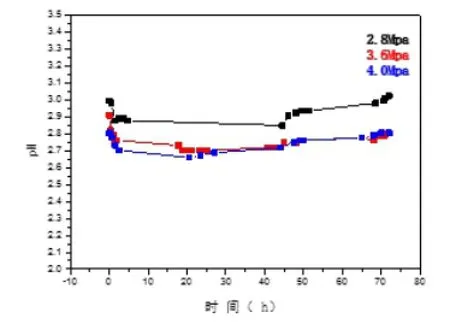
图6 不同CO2分压试验溶液的pH值随时间变化情况
由图6可以看出:在通入CO2分压时,随着CO2逐渐溶于水,三组实验溶液的pH值均有小幅度的下降,在1~2h后,溶液pH值基本保持稳定,在2.7~2.9范围内,Michel Bonis[3]等在研究CO2和H2S分压对溶液中pH值影响中得出:当Pco2+PH2S在1~10Mpa之间,温度在20~100℃之间,水溶液的PH值大约在2.8~3.4范围内,实验初期水溶液的pH值与Michel Bonis的研究结果基本吻合。当实验时间达到45h左右时,三组实验溶液的pH值均成小幅度增加的上升趋势,预示着溶液中有轻微腐蚀发生,CO2溶于水形成的H2CO3的量在减少。另外当CO2分压为3.6MPa和4.0MPa时,溶液的pH值较为接近,这可能是由于在此温度下,CO2的溶解量已快接近于饱和状态。

图7 JFE13Cr在不同二氧化碳分压溶液中的平均腐蚀速率
从图7腐蚀数据可看出,随着CO2分压的增加,试样的平均腐蚀速度依次有小幅度的增加。这是因为CO2分压的升高,水中的H2CO3含量增加,溶液酸性增强,促进了腐蚀的发生和发展,表现在数据上就是平均腐蚀速率升高[4]。另外从图6中看出当CO2分压为4.0MPa时,随着腐蚀的发生,pH值曲线的变化斜率相对于CO2分压为3.6MPa有增大的趋势,这是因为当CO2分压较高(相对于3.6MPa)时,溶液中的碳酸量较多,加剧了试样的腐蚀,致使pH值升高速率加快;
(3)不同材质试样对溶液pH值的影响
在70℃高温高压釜浸泡试验中,利用玻璃基pH电极和参比电极实时测得不同材质试样(JFE13Cr不锈钢、P110S碳钢)腐蚀试验的溶液的电位,记录电位E数据,将其代入公式(1)计算出对应电位的pH值,同时绘制试验过程中溶液的pH变化曲线,如图8所示。

图8 不同材质试样试验溶液的pH值随时间的变化情况
两组试验的平均腐蚀速率如图9所示,腐蚀形貌如图10所示。
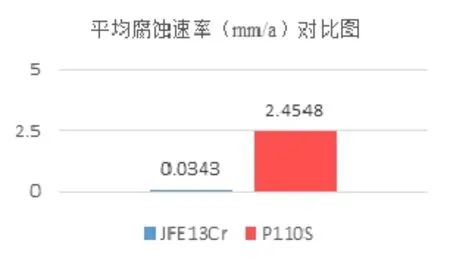
图9 JFE13Cr不锈钢和P110S碳钢平均腐蚀速率

图10 JFE13Cr不锈钢和P110S碳钢宏观腐蚀形貌图
从图9-10腐蚀数据结果中均可以看出,P110S碳钢的腐蚀速率远远高于JFE13Cr不锈钢。这是由于P110S碳钢表面无钝化膜保护,基体金属直接与环境中的CO2、H2O接触,发生典型的CO2腐蚀,腐蚀试样表面粗糙,呈黑灰色,而JFE13Cr不锈钢中含有12%~14%的Cr,其表面形成的钝化膜提高了材料的抗CO2腐蚀性能,腐蚀速率远远低于P110S碳钢,因此从试样外观上看无明显腐蚀。
图8中P110S碳钢试验的溶液pH值较JFE13Cr不锈钢的pH值上升幅度大,这是因为两种材质在相同的酸性环境中,P110S因其耐蚀性差发生了典型的CO2腐蚀,且腐蚀严重,消耗环境中碳酸的量较多,溶液酸性降低幅度大,pH值自然有较大程度的升高,而JFE13Cr不锈钢具有较高的抗CO2腐蚀性能,因此在该环境中腐蚀不明显,溶液中碳酸量变化较小,酸性降低幅度小,反应在pH值上就是pH升高程度较小。
3 结论
(1)在高温高压腐蚀环境下,Cl-浓度的升高加速了不锈钢试样表面钝化膜的破坏,JFE13Cr的腐蚀速率有较小程度的升高,溶液的pH变化速率增加;
(2)在Cl-浓度一定的高温高压腐蚀环境下,随着CO2分压的增加,溶液的pH值明显较低,JFE13Cr不锈钢的平均腐蚀速率有较小程度的升高;
(3)在相同腐蚀环境下,P110S的腐蚀程度远远高于JFE13Cr,并且P110S因其腐蚀严重消耗了溶液中大量碳酸,致使溶液的酸性降低幅度大,pH变化幅度大;
(4)高温高压玻璃基pH电极可以完成高温高压环境下溶液的pH实时测量。
[1] 熊以俊, 严宏. pH检测及控制系统的应用[J].涂装与电镀,2011(5),33~35
[2] 董晓焕, 赵国仙, 冯耀荣等. 13Cr 不锈钢的CO2腐蚀行为研究[J].石油矿场机械, 2003 ,32( 6) :1~3
[3] BONIS M, CROLET J-L. 在硫化氢致开裂中影响原位pH值的实际情况Corrosion Science,1987(27)pp.1059-1070
[4] Ikeda A , Ueda M, Mukai S. CO2corrosion behavior and mechanism of carbon steel and alloy steel[C] .Houston Texas :National Association of Corrosion Engineers ,1983
[5] 刘艳朝, 赵国仙, 薛艳等. 超级13Cr 钢在高温高压下的抗CO2腐蚀性能[J].全面腐蚀控制,2011,25(11):29~34
Measurement of pH Value of Solution in High Temperature and High Pressure Corrosion Environment
YANG Xiang-tong1, JIN Wei2, XIE Jun-feng1, ZHANG Xu2, LI Yan1, JIANG Rui2
(1. Oil and Gas Engineering Research Institute, Tarim Oilfeld Company of PetroChina, Korla 841000, China; 2. Zhongke Engineering Research Center For Corrosion Control, Shengyang, Shengyang 110016,China)
In this paper, high temperature and high pressure pH electrode was used to measure the pH value of the solution during the test, and the change of pH value of the solution under diferent corrosion conditions was studied. The test results show that Cl-concentration increased to promote the occurrence of corrosion and solution pH increased, the rate of change has increased; CO2partial pressure increased, the pH value decreased signifcantly; Under the same corrosion condition, the corrosion of P110S was more serious than that of JFE13Cr, and the pH value of the test solution was higher than that of JFE13Cr.
high temperature and high pressure; corrosive medium; pH value; monitoring
TG174.42
A
10.13726/j.cnki.11-2706/tq.2016.11.045.04
杨向同(1972-),男,甘肃武山人,高级工程师,现从事测井、试油技术研究和管理工作。
