纳米MnO2/Fe3O4对镉离子的静态吸附
2016-02-14刘占孟陈惠民唐朝春鲁秀国
刘占孟,叶 鑫,李 静,陈惠民,唐朝春,鲁秀国
(1. 华东交通大学 土木建筑学院,江西 南昌 330013;2. 邢台职业技术学院 建筑工程系,河北 邢台 054035)
废水处理
纳米MnO2/Fe3O4对镉离子的静态吸附
刘占孟1,叶 鑫1,李 静2,陈惠民1,唐朝春1,鲁秀国1
(1. 华东交通大学 土木建筑学院,江西 南昌 330013;2. 邢台职业技术学院 建筑工程系,河北 邢台 054035)
采用水热合成法将MnO2包覆于纳米Fe3O4的表面,制备出纳米MnO2/Fe3O4,并将其用于含镉溶液的吸附。考察了吸附效果的影响因素,并研究了纳米MnO2/Fe3O4的重复使用性能。实验结果表明:在初始镉离子质量浓度为10 mg/L、吸附剂投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为12 h的条件下,镉离子去除率由使用纳米Fe3O4时的3%增至使用纳米MnO2/Fe3O4时的96%;在初始镉离子质量浓度为50 mg/L、纳米MnO2/Fe3O4投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为1 h的条件下,镉离子去除率达78%,吸附量为9.7 mg/g;经5次重复使用后,纳米MnO2/Fe3O4对镉离子的去除率仅比首次使用时降低了10百分点,具有良好的重复使用性能。
重金属;纳米复合材料;纳米MnO2/Fe3O4;镉离子;吸附
重金属由于具有难降解、易在生物体内累积、对环境破坏性大等特点,在全世界造成了严重的环境问题[1]。大量含重金属的污水通过江河、湖泊流入海洋,在被水生动植物及土壤吸收后,通过生态环境和食物链直接或间接地危害到人类健康。作为常见的重金属离子,镉离子在污染水源中的限值为5 μg/L[2]。以提高资源利用效率、加大节能环保力度为宗旨,研究如何高效地对水中的镉进行去除并加以回收利用,具有重要的理论和现实意义[3-7]。
纳米材料[8]是指在外表结构上具有纳米尺度(1~100 nm)特征,性状上表现出特殊性质的材料。纳米材料微粒尺寸小、比表面积大,表现出较强的韧性及强度,可作为高效的吸附剂和催化剂使用,在生物医学[9]、水处理技术和环境治理[10]等领域有着巨大的应用潜力。纳米MnO2/Fe3O4是在纳米Fe3O4的基础上包覆一层MnO2后形成的新型纳米材料,不仅具有比表面积大、粒径小、可磁分离等传统纳米Fe3O4的特性,还具有吸附活性高、吸附容量大等特点,对重金属离子表现出良好的吸附性能[11-12]。
本工作采用水热合成法将MnO2包覆于纳米Fe3O4的表面,制备出纳米MnO2/Fe3O4,并将其用于含镉溶液的吸附,考察了吸附效果的影响因素,并研究了纳米MnO2/Fe3O4的重复使用性能,以期进一步阐明纳米MnO2/Fe3O4对隔离子的吸附行为和特性。
1 实验部分
1.1 试剂、材料和仪器
氯化镉、浓盐酸、氢氧化钠、高锰酸钾:分析纯。
纳米Fe3O4:上海阿拉丁生化科技股份有限公司,分析纯,黑色粉末,具有强磁性,平均粒径20 nm。
1 000 mg/L镉标准储备溶液:称取经干燥后的氯化镉2.031 1 g于容量瓶内,加入去离子水溶解,定容至1 L并摇匀。实验中根据需要稀释成不同浓度的镉溶液[13]。
AB204-N型电子天平:瑞士Mettler-Toledo公司;DHG-9101-2S型电热鼓风恒温干燥箱:上海光都仪器设备有限公司;KH-150型聚四氟乙烯内饰水热合成反应釜:中凯亚不锈钢制品厂;contrAA 300型火焰原子吸收光谱仪:德国耶拿公司;PHS-3C型pH计:合肥卓尔仪器仪表有限公司;ZD-8801型恒温振荡器:上海市百典仪器厂;D74*10型工业用钕铁硼强磁铁:卓求磁业公司;DZF-6020型电热真空干燥箱:常州恒德仪器制造有限公司。
1.2 实验方法
1.2.1 纳米Fe3O4/MnO2的制备
采用水热合成法制备纳米MnO2/Fe3O4:将2.04 g高锰酸钾溶于140 mL去离子水中,缓慢滴加2.8 mL浓盐酸(37%(w)),置于超声波振荡仪中超声振荡15 min;再加入1.2 g纳米Fe3O4,将混合液倒入200 mL反应釜中,密封,置于140 ℃电热鼓风恒温干燥箱中3 h;冷却至室温,过滤,将固体产物用无水乙醇和蒸馏水反复清洗,于60 ℃下真空干燥12 h,即得纳米MnO2/Fe3O4。
1.2.2 镉离子的吸附与解吸
将50 mL一定浓度的镉溶液置于150 mL锥形瓶中,调节溶液pH,再投加一定量的纳米MnO2/ Fe3O4(或纳米Fe3O4),混合后置于恒温振荡器中,在一定温度下振荡(150 r/min)吸附一定时间;利用纳米MnO2/Fe3O4的铁磁性,通过钕铁硼强磁铁对混合液进行磁分离,取上清液待测。
向磁分离后的固相中加入30 mL 0.01 mol/L稀盐酸,置于恒温振荡器中,在20 ℃下振荡(120 r/ min)解吸15 min;磁分离,取固相用去离子洗涤,干燥,得到解吸后的纳米MnO2/Fe3O4;对其进行重复使用。
1.3 分析方法
采用直接吸入火焰原子吸收法测定上清液中镉离子的质量浓度,测定波长为228.8 nm[14]。根据测定结果计算镉离子的去除率和吸附量[15]。
2 结果与讨论
2.1 纳米MnO2/Fe3O4与纳米Fe3O4的吸附效果对比
在吸附剂投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为12 h的条件下,纳米MnO2/Fe3O4和纳米Fe3O4的镉离子吸附效果对比见图1。

图1 纳米MnO2/Fe3O4和纳米Fe3O4的镉离子吸附效果对比
由图1可见:在不同的初始镉离子质量浓度下,改性前后的纳米Fe3O4对镉离子的吸附效率均发生了极大的变化;当初始镉离子质量浓度为10 mg/L时,镉离子去除率由改性前的3%增至改性后的96%。这是因为:一方面,纳米Fe3O4易发生团聚现象,很难与溶液完全混合,而纳米MnO2/Fe3O4分散性好,将其置于溶液中不易发生沉淀聚集现象,能更好地与溶液中的镉离子接触,从而达到更好的吸附效果;另一方面,MnO2对镉离子具有较强的吸附性能,能与镉离子发生交换吸附[16]。
纳米MnO2/Fe3O4和纳米Fe3O4均可通过外界磁场的作用在1~2 min内完成固液分离。说明纳米MnO2/Fe3O4仍具有良好的铁磁性,这极大地提高了固液分离的效率。
2.2 初始镉离子质量浓度对吸附效果的影响
前期实验结果表明,纳米MnO2/Fe3O4对镉离子的吸附在1 h左右基本达到平衡,继续延长吸附时间,吸附量变化不大,故以下实验均选择吸附时间为1 h。
在纳米MnO2/Fe3O4投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为1 h的条件下,初始镉离子质量浓度对镉离子吸附效果的影响见图2。由图2可见:随初始镉离子质量浓度的逐渐增加,纳米MnO2/Fe3O4对镉离子的吸附量也逐步增大;当初始镉离子质量浓度为50 mg/L时的吸附量最大,达到9.7 mg/g;继续增大初始镉离子质量浓度,吸附量开始降低。这是因为:随初始镉离子浓度的增加,吸附质与吸附剂接触的概率增大,使得吸附量也增大;继续增加镉离子浓度,吸附剂逐渐发生团聚现象,降低了其比表面积,导致吸附量降低。由图2还可见,随初始镉离子质量浓度的增加,镉离子的去除率不断降低。这是由于纳米MnO2/Fe3O4能在较短时间内达到吸附平衡,可供镉离子吸附的位点很快被消耗,无法再吸附更高浓度的镉离子,因而导致其去除率下降。

图2 初始镉离子质量浓度对镉离子吸附效果的影响
2.3 纳米MnO2/Fe3O4投加量对吸附效果的影响
不同吸附剂用量对重金属离子的去除效果有着显著差异[15]。在初始镉离子质量浓度为50 mg/ L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为1 h的条件下,纳米MnO2/Fe3O4投加量对镉离子吸附效果的影响见图3。由图3可见:纳米Fe3O4/MnO2投加量对镉离子的吸附效果影响较大;当投加量为0.2 g/L时,镉离子的去除率仅为53%;随投加量的不断增加,去除率也随之提高;当投加量达8 g/L时,对镉离子的去除效果明显,去除率达到84%;但随投加量的增加,镉离子的吸附量却在持续降低,投加量为0.2 g/L时的吸附量最高,达到131.3 mg/g。吸附剂投加量的增大一方面增加了参与吸附的官能团数目,使之争相对镉离子进行吸附,另一方面增大了吸附剂与吸附质的接触面积。随纳米MnO2/Fe3O4投加量的增加,其对隔离子的吸附量持续下降,直至吸附逐渐达到饱和;此时,吸附量缓慢下降并趋于平缓。综合考虑经济环保等因素,选择纳米MnO2/Fe3O4投加量为4 g/L较适宜。

图3 纳米MnO2/Fe3O4投加量对镉离子吸附效果的影响
2.4 吸附温度对吸附效果的影响
在初始镉离子质量浓度为50 mg/L、纳米MnO2/Fe3O4投加量为4 g/L、溶液pH为6.0、吸附时间为1 h的条件下,吸附温度对镉离子吸附效果的影响见图4。由图4可见:温度的变化与吸附量和去除率的变化均成正相关性;随温度的升高,隔离子的去除率和吸附量均单调递增,且变化明显;温度为20 ℃时,镉离子的去除率为78%,吸附量为9.7 mg/g,而温度升至80 ℃时,去除率已接近100%,吸附量为12.5 mg/g。这是因为:一方面,较高的温度增强了分子的热运动,纳米材料粒径小,表面原子数量多,故热运动更加明显,因而提高了去除效果;另一方面,随温度的升高,纳米MnO2/Fe3O4表面包覆的MnO2被激活了更多的可供吸附的官能团,因而增加了吸附量。

图4 吸附温度对镉离子吸附效果的影响
2.5 溶液pH对吸附效果的影响
在初始镉离子质量浓度为50 mg/L、纳米MnO2/Fe3O4投加量为4 g/L、吸附温度为20 ℃、吸附时间为1 h的条件下,溶液pH对镉离子吸附效果的影响见图5。由图5可见:pH的变化对纳米MnO2/ Fe3O4吸附镉离子的影响较大;当pH为2~6时,随pH的增大,镉离子的去除率和吸附量均增加;继续增大pH,去除率和吸附量急剧降低;pH=6时,吸附量为9.7 mg/g,去除率为78%,均达到峰值。说明弱酸性环境有利于纳米MnO2/Fe3O4对隔离子的吸附。
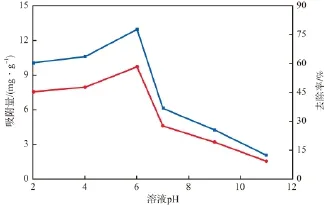
图5 溶液pH对镉离子吸附效果的影响
溶液pH是影响和控制纳米MnO2/Fe3O4吸附镉离子的一个重要因素,因为pH的变化改变了镉的存在形式:在溶液pH相对较低的情况下,镉主要以Cd2+的形式存在;在中性至弱碱性条件下,主要以Cd(OH)+的形式存在;在碱性或强碱性条件下,则以Cd(OH)2和Cd(OH)3-的形式存在[16]。由此可见,随pH的升高镉的存在价态逐渐降低。由于纳米MnO2/Fe3O4与镉离子之间的吸附作用主要来源于静电引力,因MnO2/Fe3O4表面带负电荷,故当溶液为酸性时静电引力大;在溶液由酸性至碱性的过程中,静电引力不断减小,Cd(OH)2和Cd(OH)3-很难被吸附在纳米MnO2/Fe3O4表面,从而导致镉离子在碱性环境下的吸附量较少。
2.6 纳米MnO2/Fe3O4的重复使用
吸附剂的回收利用对经济和环境都具有重要意义。由于纳米MnO2/Fe3O4在酸性或碱性条件下均表现出较低的吸附性能,但在碱性条件下Mn2+易与碱反应生成白色沉淀氢氧化锰,故选用酸处理法[17]对纳米MnO2/Fe3O4进行解吸。
在初始镉离子质量浓度为10 mg/L、纳米MnO2/Fe3O4投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为1 h的条件下,纳米MnO2/ Fe3O4的重复使用效果见图6。由图6可见,使用5次后,纳米MnO2/Fe3O4对镉离子的去除率仍达86%,与其首次使用时相比只降低了10百分点。说明纳米MnO2/Fe3O4具有良好的重复使用性能和再生性能。

图6 纳米MnO2/Fe3O4的重复使用效果
4 结论
a)制备了一种新型纳米MnO2/Fe3O4吸附材料。在初始镉离子质量浓度为10 mg/L、吸附剂投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为12 h的条件下,镉离子去除率由使用纳米Fe3O4时的3%增至使用纳米MnO2/Fe3O4时的96%。
b)在初始镉离子质量浓度为50 mg/L、纳米MnO2/Fe3O4投加量为4 g/L、吸附温度为20 ℃、溶液pH为6.0、吸附时间为1 h的条件下,镉离子去除率达78%,吸附量为9.7 mg/g。
c)经5次重复使用后,纳米MnO2/Fe3O4对镉离子的去除率仅比首次使用时降低了10百分点,具有良好的重复使用性能。
[1] Keng Pei-Sin,Lee Siew-Ling,Ha Sie-Tiong,et al. Removal of hazardous heavy metals from aqueous environment by low-cost adsorption materials[J]. Environ Chem Lett,2014,12(1):15 - 25.
[2] 中华人民共和国卫生部. GB 5749—2006 生活饮用水卫生标准[S]. 北京:中国标准出版社,2007.
[3] 邓书平. 改性累托石吸附处理含镉废水[J]. 化工环保,2009,29(4):308 - 311.
[4] 王哲,刘金亮,陈莉荣,等. 高炉渣对Cd2+的吸附性能[J]. 化工环保,2015,35(2):187 - 191.
[5] Kumari M,Tripathi B D. Effi ciency of Phragmites australis and Typha latifolia for heavy metal removal from wastewater[J]. Ecotoxicol Environ Saf,2015,112:80 - 86.
[6] Prica M,Adamovic S,Dalmacija B,et al. The electrocoagulation/flotation study:The removal of heavy metals from the waste fountain solution[J]. Process Saf Environ Prot,2015,94:262 - 273.
[7] Simate G S,Ndlovu S. The removal of heavy metals in a packed bed column using immobilized cassava peel waste biomass[J]. J Ind Eng Chem,2015,21:635 - 643.
[8] 杨静. 纳米材料用于有机污染物的磁固相萃取和光催化降解[D]. 南京:南京大学,2014.
[9 ] Qiao Ruirui,Jia Qiaojuan,Hü wel S,et al. Receptormediated delivery of magnetic nanoparticles across the blood-brain barrier[J]. ACS Nano,2012,6(4):3304 - 3310.
[10] 薛君. 功能化磁性纳米材料的制备及其在废水污染物治理中的应用研究[D]. 沈阳:沈阳理工大学,2014.
[11] 张晓蕾,陈静,韩京龙,等. 壳-核结构Fe3O4/MnO2磁性吸附剂的制备、表征及铅吸附去除研究[J]. 环境科学学报,2013,33(10):2730 - 2736.
[12] 张姝,王树林,李生娟. Fe3O4/MnO2磁性复合颗粒的制备及表征[J]. 机械工程材料,2009,33(5):41 - 44.
[13] 朱霞萍,白德奎,李锡坤,等. 镉在蒙脱石等黏土矿物上的吸附行为研究[J]. 岩石矿物学杂志,2009,28(6):643 - 648.
[14] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京:中国环境科学出版社,2002:323 - 326.
[15] Al-Haddabi M,Vuthaluru H,Znad H,et al. Removal of dissolved organic carbon from oily produced water by adsorption onto date seeds:Equilibrium,kinetic,and thermodynamic studies[J]. Water,Air,Soil Pollut,2015,226:172 - 186.
[16] 梁慧锋. δ-MnO2的制备及其对水中Cd2+的吸附[J].化工环保,2007,27(3):222 - 226.
[17] Eisazadeh H,Lashkenari M S,Davodi B. Studying the effect of adsorbent dosage on the removal of Arsenic from aqueous solution by using polyaniline nanocomposite[J]. AIP Conf Proc,2010,1255:31 - 33.
[18] Berber-Mendoza M S,Leyva-Ramos R,Alonso-Davila P,et al. Effect of pH and temperature on the ion-exchange isotherm of Cd(Ⅱ) and Pb(Ⅱ) on clinoptilolite[J]. J Chem Technol Biotechnol,2006,81(6):966 - 973.
[19] Kim Eun-Ju,Lee Chung-Seop,Chang Yoon-Young,et al. Hierarchically structured manganese oxide-coated magnetic nanocomposites for the efficient removal of heavy metal ions from aqueous systems[J]. ACS Appl Mater Interfaces,2013,5(19):9628 - 9634.
(编辑 魏京华)
《化工环保》编辑部启事
《化工环保》期刊网站已于2012年8月日开通,网址:www.hghb.com.cn。《化工环保》期刊实行作者在线投稿、专家在线审稿和编辑在线办公。请作者在“作者专区”登录后进行投稿,也可在线查看稿件处理状态。专家在“专家审稿”专区登录,填写并核实个人信息后,进行在线审稿。《化工环保》网站开通后,《化工环保》期刊只接受网上投稿,不再受理电子邮件投稿。
《化工环保》编辑部
Static adsorption of cadmium ions on nano MnO2/Fe3O4
Liu Zhanmeng1,Ye Xin1,Li Jing2,Chen Huimin1,Tang Chaochun1,Lu Xiuguo1
(1. School of Civil Engineering and Architecture,East China Jiaotong University,Nanchang Jiangxi 330013,China;2. Departmet of Civil Engineering and Architecture,Xingtai Polytechnic College,Xingtai Hebei 054035,China)
MnO2was loaded on the surface of nano-Fe3O4by hydrothermal synthesis method to prepare nano MnO2/Fe3O4,which was used for adsorption of cadmium from solution. The factors affecting adsorption were investigated,and the reuse performance of nano MnO2/Fe3O4was researched.The experimental results show that:Under the conditions of initial cadmium ion mass concentration 10 mg/L,adsorbent dosage 4 g/L,adsorption temperature 20 ℃,solution pH 6 and adsorption time 12 h,the removal rate of cadmium ion is increased from 3% on nano-Fe3O4to 96% on nano MnO2/Fe3O4;Under the conditions of initial cadmium ion mass concentration 50 mg/L,nano MnO2/Fe3O4dosage 4 g/L,adsorption temperature 20 ℃,solution pH 6 and adsorption time 1 h,the removal rate of cadmium ion is 78%,and the adsorption capacity is 9.7 mg/g;After 5 times of reuse,the removal rate of cadmium ion on nano MnO2/Fe3O4is only reduces by 10 percentage point compared with that at the fi rst use.
heavy metal;nanocomposite;nano MnO2/Fe3O4;cadmium ion;adsorption
X703.1
A
1006-1878(2016)03-0263-05
10.3969/j.issn.1006-1878.2016.03.005
2015 - 12 - 08;
2016 - 02 - 26。
刘占孟(1977—),男,河北省饶阳县人,博士,副教授,电话 13576060580,电邮 ustblzm@163.com。联系人:叶鑫,电话 18770069137,电邮 309698367@qq.com。
国家自然科学基金项目(51168013,51468016);江西省自然科学基金项目(20132BAB203033);江西省科技支撑计划项目(2009AE01601);江西省研究生创新专项(YC2014-S251);河北省科技支撑计划项目(15273628)。
