前列腺穿刺活检结果预测模型的建立
2016-02-14殷昭阳李方龙崔亮殷小涛齐思勇金一鹏唐杰石怀银高江平张旭
殷昭阳 李方龙 崔亮 殷小涛 齐思勇 金一鹏 唐杰 石怀银 高江平 张旭
·临床研究·
前列腺穿刺活检结果预测模型的建立
殷昭阳 李方龙 崔亮 殷小涛 齐思勇 金一鹏 唐杰 石怀银 高江平 张旭
目的基于前列腺特异性抗原(PSA)等指标,建立能够预测前列腺穿刺活检结果的数学模型。方法收集2009年7月至2015年3月在解放军总医院进行前列腺穿刺活检患者的年龄、前列腺体积、游离PSA(fPSA)和总PSA(tPSA)等临床资料。所有研究对象中随机选择80%为建模组,其余20%为验证组。在建模组中利用单因素和多因素Logistic分析筛选出预测前列腺癌的独立性影响因素,构建回归方程,并以此为基础建立预测前列腺穿刺结果的数学模型。利用受试者工作特征(receiver operating characteristic, ROC)曲线评估该模型对前列腺癌的诊断价值,并与临床常用的PSA及其相关参数比较诊断价值的差异。结果选取资料完整且tPSA 100 ng/ml以下的患者纳入研究,共958例。其中建模组767例(tPSA 4~20 ng/ml者587例),验证组191例。在建模组中,将所有指标纳入单因素和多因素Logistic回归分析,发现年龄、tPSA和前列腺体积是前列腺癌独立的预测因素。将所有指标(包括fPSA)纳入回归方程,构建数学模型Y=-4.765+0.074×(年龄)+0.057×(tPSA)+0.052×(fPSA)-0.029×(前列腺体积)。在建模组和验证组中,ROC曲线分析显示该模型预测前列腺癌的ROC曲线下面积高于tPSA、f/tPSA和PSA密度。取Y=-0.076,即约登指数最大值作为本模型最佳临界值,预测前列腺癌的灵敏度为76.2%、特异度为76.6%、阳性预测值76.5%、阴性预测值76.3%。结论本预测模型与单独应用PSA及其相关参数相比具有更高的诊断价值,并且可以在不增加患者检查项目的前提下提高预测前列腺癌的能力。
前列腺癌; 前列腺特异性抗原; 数学模型
前列腺癌是老年男性常见的恶性肿瘤,而良性前列腺增生是中老年男性常见的良性疾病,二者存在着较大的年龄重叠区。由于近年来我国前列腺癌的发病率升高,因此更需要能够准确鉴别两种疾病的诊断方法。前列腺穿刺活检是临床上诊断前列腺癌的“金标准”,穿刺指征主要参考前列腺特异性抗原(PSA)、超声或者MRI等影像学检查结果。PSA是常用的早期筛查前列腺癌的方法,临床上通常以总PSA(tPSA)>4.0 ng/ml为异常,但是在4~10 ng/ml范围内前列腺癌和前列腺增生存在较大的tPSA重叠区域。为了提高该范围内PSA诊断前列腺癌的能力,一系列PSA相关参数,如游离PSA与总PSA比值(f/tPSA)、PSA密度(PSAD)和PSA速率(PSAV)等被提出来,但是其应用目前仍然存在争议。本研究通过回顾解放军总医院前列腺穿刺患者的病例资料,分析良性前列腺增生与前列腺癌患者之间指标的差异,并联合相关指标构建预测前列腺穿刺结果的数学模型,以减少不必要的活检。
对象与方法
一、研究对象
选取2009年7月至2015年3月在解放军总医院进行十二针(12+X)前列腺穿刺且病理结果为前列腺癌或良性前列腺增生的患者,获得其临床资料,包括年龄、前列腺体积、fPSA及tPSA。所有患者穿刺前均无前列腺手术病史,且未服用5α还原酶抑制剂和(或)前列腺癌内分泌治疗药物。纳入tPSA水平在100 ng/ml以下的患者958例。将所有患者进行编号,利用计算机随机抽取80%的患者纳入建模组,共767例;20%的患者纳入验证组,共191例。
二、构建模型
在建模组中,对所有的指标进行单因素和Logistic多因素分析,筛选有意义的指标构建Logistic回归方程,获得数学模型Logit(P)=α+β1X1+β2X2……βNXN,其中α为常数项,β1、β2……βN为回归系数,X1、X2……XN为自变量。并确定其诊断前列腺癌的临界值。
在验证组中评估该数学模型对前列腺癌的诊断价值,并与临床常用的诊断指标(tPSA、f/tPSA和PSAD)相比较。f/tPSA=fPSA/tPSA,前列腺体积=0.52×左右径(cm)×上下径(cm)×前后径(cm),PSAD=tPSA/前列腺体积。
三、统计学方法
组间指标均数的比较采用Mann-Whitney’s U检验。在建模组和验证组中利用受试者工作特征(receiver operating characteristic, ROC)曲线分析tPSA、f/tPSA、PSAD和所建模型预测前列腺穿刺活检结果的准确性,利用约登指数确定数学模型的最佳临界值。使用SPSS 17.0统计软件进行统计学处理,以P<0.05为差异有统计学意义。
结 果
在纳入研究的958例患者中,中位年龄为70岁(35~89岁),中位tPSA为11.3 ng/ml(0.09~98.23 ng/ml)。根据穿刺结果分为前列腺增生组(494例)和前列腺癌组(464例),两组患者在年龄、fPSA、tPSA、前列腺体积、f/tPSA和PSAD上的差异均有统计学意义(P<0.05)。
根据tPSA水平将患者分为tPSA≤4.0、4.1~10.0、10.1~20.0以及>20.0 ng/ml四组,随着tPSA水平的升高,前列腺癌的检出率也升高(表1)。在tPSA 4.1~10.0 ng/ml和10.1~20.0 ng/ml两组中,前列腺癌检出率均低于50%,即在该范围内行前列腺穿刺将有超过一半的患者进行了不必要的活检。

表1 不同tPSA水平分组前列腺癌的检出率
在建模组中,对患者的年龄、前列腺体积、fPSA及tPSA进行单因素和多因素Logistic回归分析,多因素分析结果表明,年龄、tPSA和前列腺体积为前列腺癌的独立性预测指标(表2),而fPSA并不是前列腺癌的独立性预测指标。为了尽可能提高模型的预测准确性,将fPSA也加入模型中。利用上述独立性指标构建Logistic回归方程,年龄、tPSA、fPSA和前列腺体积的回归系数分别为0.074、0.057、0.052和-0.029,从而构建数学模型Y=Logit(P)=-4.765+0.074×(年龄)+0.057×(tPSA)+0.052×(fPSA)-0.029×(前列腺体积)。

表2 各参数的多因素Logistic回归分析结果
利用ROC曲线比较该模型与临床常用指标tPSA、f/tPSA、PSAD在鉴别前列腺增生与前列腺癌中的价值,模型的曲线下面积为0.831,高于其他指标(表3,图1)。利用ROC曲线获得该模型在不同取值时的灵敏度与特异度,选取约登指数最大值时的ROC曲线切点为最佳临界值,即Y=-0.076,其诊断前列腺癌的灵敏度为76.2%、特异度为76.6%、阳性预测值为76.5%、阴性预测值为76.3%(表4)。
在验证组中,数学模型的ROC曲线下面积为0.807,与建模组相似,高于tPSA、f/tPSA和PSAD。
在全部研究对象中,选取PSA范围在4~20 ng/ml的患者587例,数学模型的ROC曲线下面积为0.844,且均高于其他指标(表3,图2)。
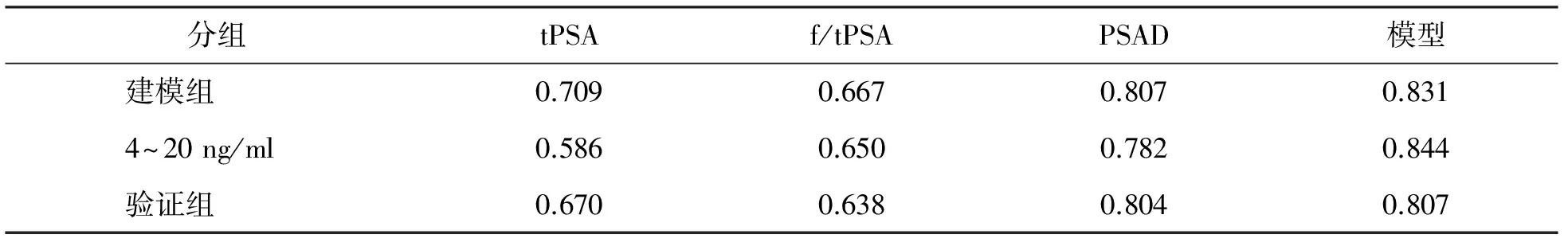
表3 各指标ROC曲线下面积

表4 模型不同取值时的灵敏度、特异度、阳性预测值和阴性预测值

图1 模型与PSA及其相关参数预测前列腺癌的ROC曲线
图2 在PSA 4~20 ng/ml范围内,模型与PSA各参数预测前列腺癌的ROC曲线
讨 论
PSA自1977年Wang等[1]发现以来,已经广泛应用于前列腺癌的诊断、分期、疗效评估和预后判断,是临床上重要的前列腺癌肿瘤学标志物。PSA是由前列腺上皮分泌的一种糖蛋白,具有良好的前列腺组织特异性,但是并不具备前列腺癌特异性,在其他前列腺疾病比如前列腺增生、前列腺炎或其他非癌情况下,PSA水平也会升高。目前临床上常把PSA参考值定为4.0 ng/ml,认为超出该值为异常。但是Thompson等[2]在PSA低于4 ng/ml的研究对象中发现有15.2%的人患有前列腺癌,并且有相当高的比例为Gleason评分大于7分。在PSA 4~10 ng/ml范围内,中国人前列腺穿刺阳性率约为15.9%[3],周利群等[4]研究发现,28.3%的前列腺增生患者PSA水平高于4 ng/ml,而PSA水平低于4 ng/ml的前列腺癌患者为28.2%,表明在4~10 ng/ml 范围内前列腺增生与前列腺癌存在较大的重叠。为了提高PSA在该范围内的诊断准确性,研究者提出了一系列的PSA相关参数:f/tPSA、PSAD、PSAV等[5-8],以提高诊断前列腺癌的灵敏度、特异度以及阳性预测值。
目前我国指南中对于前列腺穿刺的指征主要依靠PSA与影像学结果:①直肠指检发现前列腺结节,任何PSA值;②B超、CT或MRI发现异常影像,任何PSA值;③PSA>10 ng/ml时,任何f/tPSA和PSAD值;④PSA 4~10 ng/ml时,f/tPSA异常或PSAD值异常。但是单独依靠PSA及其相关参数或者影像学结果,预测前列腺穿刺的阳性率各不相同,目前并无统一的风险评估方法。国外研究者根据患者的临床及检验资料建立了一系列的前列腺癌的预测模型,包括列线图模型[9-11]、概率表模型[12]、人工神经网络模型[13]等。上述模型通过综合多种前列腺癌的预测因素,提高了对前列腺穿刺风险评估的准确性,与单独应用某项指标相比,更有助于临床上对患者的建议及决策的制定。
本研究建模组中的数据经Logistic分析发现,年龄、tPSA和前列腺体积可作为独立的预测因素。fPSA并不是前列腺癌阳性结果的独立性预测因素,但是为了能够增加数学模型的预测准确性,仍将其纳入模型。ROC曲线分析发现所建数学模型的曲线下面积为0.831,高于目前临床上常用的tPSA、f/tPSA、PSAD。选取约登指数最大的切点为最佳临界值,Y=-0.076时可以保证使灵敏度和特异度均达到较高水平。在临床应用中,有学者认为癌症诊断需要保证高的灵敏度[14],因此在本研究模型中,当Y=-0.731时,灵敏度可达到90.0%,特异度为54.8%。
在PSA 4~20 ng/ml范围内,患者前列腺癌的检出率低于50%,易导致较高比例的不必要的穿刺活检。利用本研究所建立的模型,在该范围内ROC曲线下面积为0.844,数学模型诊断前列腺癌的准确性均高于其他指标。在验证组中,数学模型的ROC曲线下面积为0.807,亦高于其他组。
国内有学者尝试综合各种因素建立前列腺穿刺的预测模型[15-17]。陈建刚等[15]建立了一种简易评分系统以预测穿刺活检前列腺癌阳性率,他们以年龄>71岁、tPSA>14.1 μg/L、f/tPSA<14.07、前列腺体积<42.8 ml、PSAD>0.31为1分,计算前列腺癌的风险,评分为0、1、2、3、4、5分的患者前列腺癌的检出率分别为7.69%、8.98%、15.19%、39.39%、54.55%和72.15%,ROC曲线下面积为0.82。李秋洋等[16]曾利用Logistic回归模型构建前列腺穿刺评分系统,发现年龄、前列腺体积、血清PSA水平、f/tPSA是前列腺穿刺阳性结果的预测因素,该评分系统的ROC曲线下面积为0.876 7,当评分为0.45时,活检为阳性的可能性是76.5%。本研究所建模型与上述两种方法相比预测准确性相似,但更为简洁,计算简便,利于临床或患者自行计算,并且经解放军总医院内部数据验证了其预测前列腺癌的高准确性。
本研究综合分析影响前列腺穿刺结果的多种因素,建立了预测前列腺穿刺活检结果的数学模型。该模型为临床医生提供了一种简便实用的方法,在不增加患者费用的前提下提高了对前列腺癌风险的评估能力,比目前临床单独应用PSA及其相关参数具有更高的准确性。本研究应用解放军总医院数据对该模型进行了验证,其临床应用还需要后续外部数据的验证。
[1] Wang MC, Valenzuela LA, Murphy GP, et al. Purification of a human prostate specific antigen[J]. Invest Urol,1979,17(2):159-163.
[2] Thompson IM, Pauler DK, Goodman PJ, et al. Prevalence of prostate cancer among men with a prostate-specific antigen level < or =4.0 ng per milliliter[J]. N Engl J Med,2004,350(22):2239-2246.
[3] 李鸣,那彦群. 不同水平前列腺特异抗原的前列腺癌诊断率[J]. 中华医学杂志,2008,88(1):16-18.
[4] 周利群,陈为民,那彦群,等. 良性前列腺增生与前列腺癌患者血清总PSA水平与游离PSA比值的比较[J]. 中华泌尿外科杂志,2002,23(6):354-357.
[5] Kim SJ, Jeong TY, Yoo DS, et al. Can Prostate-Specific Antigen Kinetics before Prostate Biopsy Predict the Malignant Potential of Prostate Cancer?[J]. Yonsei Med J,2015,56(6):1492-1496.
[6] Teoh JY, Yuen SK, Tsu JH, et al. The performance characteristics of prostate-specific antigen and prostate-specific antigen density in Chinese men[J]. Asian J Androl,2015. doi: 10.4103/1008-682X.167103.
[7] Ankerst DP, Gelfond J, Goros M, et al. Serial Percent-Free Prostate Specific Antigen in Combination with PSA for Population-Based Early Detection of Prostate Cancer[J]. J Urol,2016,196(2):355-360.
[8] Ikuerowo SO, Ajala MO, Abolarinwa AA, et al. Age-specific Serum Prostate Specific Antigen Ranges Among Apparently Healthy Nigerian Men Without Clinical Evidence of Prostate Cancer[J]. Niger J Surg,2016,22(1):5-8.
[9] Ouzaid I, Yates DR, Hupertan V, et al. A direct comparison of the diagnostic accuracy of three prostate cancer nomograms designed to predict the likelihood of a positive initial transrectal biopsy[J]. Prostate,2012,72(11):1200-1206.
[10] Tang P, Chen H, Uhlman M, et al. A nomogram based on age, prostate-specific antigen level, prostate volume and digital rectal examination for predicting risk of prostate cancer[J]. Asian J Androl,2013,15(1):129-133.
[11] Kuo SC, Hung SH, Wang HY, et al. Chinese nomogram to predict probability of positive initial prostate biopsy: a study in Taiwan region[J]. Asian J Androl,2013,15(6):780-784.
[12] Eifler JB, Feng Z, Lin BM, et al. An updated prostate cancer staging nomogram (Partin tables) based on cases from 2006 to 2011[J]. BJU Int,2013,111(1):22-29.
[13] Cai B, Jiang X. A novel artificial neural network method for biomedical prediction based on matrix pseudo-inversion[J]. J Biomed Inform,2014,48:114-121.
[14] Gjengstø P, Paus E, Halvorsen OJ, et al. Predictors of prostate cancer evaluated by receiver operating characteristics partial area index: a prospective institutional study[J]. J Urol,2005,173(2):425-428.
[15] 陈建刚,陈新凤,顾栋华,等. 建立一种简易评分系统预测前列腺穿刺活检前列腺癌阳性率[J]. 中华男科学杂志,2015,21(1):53-56.
[16] 李秋洋,唐杰,李岩密,等. 初步建立中国人前列腺癌预测的数学模型[J]. 中国医学科学院学报,2011,33(6):685-688.
[17] 李方龙,殷昭阳,李德维,等. 单中心前列腺穿刺活检结果查询表的建立[J]. 现代泌尿生殖肿瘤杂志,2016,8(1):16-18,23.
(本文编辑:熊钰芬)
Establishment of a model for predicting the result of prostate biopsy
YINZhao-yang*,LIFang-long,CUILiang,YINXiao-tao,QISi-yong,JINYi-peng,TANGJie,SHIHuai-yin,GAOJiang-ping,ZHANGXu.
*DepartmentofUrology,GeneralHospitalofChinesePLA,Beijing100853,ChinaCorrespondingauthor:GAOJiang-ping,E-mail:jpgao@163.com
Objective To develop a model for predicting the result of prostate biopsy based on clinical parameters such as prostate specific antigen (PSA). Methods We retrospectively analyzed the clinical data of patients who underwent prostate biopsy for prostate cancer in our hospital from July 2009 to March 2015. Variables including age, prostate volume, free PSA (fPSA) and total PSA (tPSA) were collected. Of these patients, we randomly selected 20% as validation group, and the other 80% as development group. We performed logistic regression analysis to identify the independent risk factors related to positive prostate biopsy in development group. Then we constructed a prediction model according to regression equation to predict the result of prostate biopsy. Receiver operating characteristic (ROC) analysis was performed to verify the diagnostic value of the novel prediction model, which was furtherly compared with the diagnostic values of PSA alone, f/t PSA, PSAD respectively. Results 958 patients whose tPSA was under 100 ng/ml with integrity datas enrolled in this study, of which 767 were randomly selected as development group (587 whose tPSA is between 4-20 ng/ml) and 191 as validation group. tPSA, age and prostate volume were independent risk factors by logistic regression analysis. And the prediction model based on all variables was established as follows: Y=-4.765+0.074×(age)+0.057×(tPSA)+0.052×(fPSA)-0.029×(prostate volume). The area under the ROC curve of the model was greater than that of tPSA, f/tPSA and PSAD in development and validation groups. The sensitivity, specificity, positive predictive value and negative predictive value were 76.2%, 76.6%, 76.5% and 76.3% respectively with a cut-off of -0.076, which was determined by Youden index. Conclusions The novel predictive model established in this study has better diagnostic value for prostate cancer compared with PSA and other PSA related parameters.
Prostate cancer; Prostate specific antigen; Model
100853北京,解放军总医院泌尿外科(殷昭阳、殷小涛、齐思勇、金一鹏、高江平、张旭);解放军白求恩国际和平医院泌尿外科(李方龙);民航总医院(崔亮);解放军总医院超声科(唐杰);解放军总医院病理科(石怀银)
高江平,E-mail:jpgao@163.com
10.3870/j.issn.1674-4624.2016.05.008
2016-06-29)
