高Ca2+浓度CO2沉淀法由电石渣制备纳米CaCO3
2016-02-13王百年葛礼响杨保俊
王百年,葛礼响,曹 萌,杨保俊
(合肥工业大学 化学与化工学院,安徽 合肥 230009)
综合利用
高Ca2+浓度CO2沉淀法由电石渣制备纳米CaCO3
王百年,葛礼响,曹 萌,杨保俊
(合肥工业大学 化学与化工学院,安徽 合肥 230009)
以NH4Cl溶液为浸取剂、CO2为碳化剂、多聚磷酸钠(STP)为添加剂,由电石渣制备纳米CaCO3。实验结果表明:电石渣浸取液Ca2+浓度为1.0 mol/L、STP加入量为3.00%时,可制备出粒径为30~60 nm的纳米CaCO3;STP可有效控制纳米CaCO3的粒度和形貌;在最佳工艺条件下,由电石渣制备纳米CaCO3的产率为80%,处理1 t电石渣产生的经济效益约为2 670元。
纳米CaCO3;电石渣;氯化铵;三聚磷酸钠;CO2
纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业[1]。目前工业化最为成熟的纳米CaCO3制备方法是碳化法[2],即以石灰石为原料经煅烧、消化、碳化等工序制备纳米CaCO3。但该法需开采不可再生原料石灰石矿,破坏环境,且煅烧工序能耗较高,与节能减排的国家政策相违背,同时也并不具有成本优势[3-4]。近年来已有不少利用电石渣、磷石膏等其他原料制备纳米CaCO3的报道[5-8]。电石渣是工业上由电石制备乙炔的副产物,其主要化学成分是Ca(OH)2。电石渣不仅从化学组成上是CaCO3制备的理想原料,而且用其制备CaCO3还能解决电石渣大量堆积、综合利用率低的问题。相比于工业上纳米CaCO3的制备方法,本工艺以电石渣为原料,在高Ca2+浓度、室温条件下制备纳米CaCO3,具有条件温和、操作简便、生产成本低的优点,同时可缓解电石渣堆积造成环境污染这一工业难题[9-10]。
近年来由电石渣制备纳米CaCO3的方式大多为:先采用NH4Cl溶液浸取,使电石渣中的Ca2+进入液相,通常使用Ca2+浓度仅为0.2 mol/L或更低的电石渣浸取液,加入碳酸盐溶液或通入CO2气体生成CaCO3沉淀,以制备纳米CaCO3[11-12]。该方法避免了煅烧工序,可明显降低生产能耗。
本工作采用以多聚磷酸钠(STP)为添加剂,在室温下向电石渣浸取液中通入CO2的方式制备纳米CaCO3,采用Ca2+浓度为1.0 mol/L的电石渣浸取液与CO2进行沉淀反应,相比同类文献的报道[13],Ca2+浓度有明显增加。本工艺有利于进一步提高生产效率,降低生产成本,提高电石渣的综合利用程度,并具有良好的工业化应用前景。
1 实验部分
1.1 原料与试剂
电石渣:由安徽皖维集团提供,Ca(OH)2含量为91.59%(w);NH4Cl、STP、无水乙醇等:均为分析纯;CO2:工业级。
1.2 制备方法
首先用浓度为4.6 mol/L的NH4Cl溶液浸取电石渣,得Ca2+浓度约为1.6 mol/L的电石渣浸取液,加入适量氨水,稀释至一定Ca2+浓度,具体过程参考文献[14]。加入添加剂STP,加入量为0.75%~4.00%(STP与理论生成CaCO3的质量比),30 ℃水浴、磁力搅拌下通入CO2进行沉淀反应,CO2流量为400 mL/min。当溶液pH降到7左右时终止反应,过滤后以浓度为1 mmol/L的STP溶液洗涤产物3次,再用去离子水和无水乙醇各洗2次,110℃烘干,得纳米CaCO3粉体。
1.3 表征方法
采用日本理学株式会社的D/MAX2500V 型X射线衍射仪表征产物的晶型,扫描范围为2θ=10°~70°,扫描速率4 (°)/min。采用日本日立株式会社的SU8020型场发射扫描电子显微镜(FESEM)观察其微观形貌,加速电压 5 kV。采用上海雷磁公司的PHS-3E型酸度计测定溶液pH。
2 结果与讨论
2.1 无添加剂时CaCO3的形貌与晶型
在Ca2+浓度为1.0 mol/L的条件下,无添加剂条件下制备的CaCO3的FESEM照片和XRD谱图分别见图1和图2。由图1可见,在无添加剂条件下,所制备的CaCO3颗粒为大小不一的类球形,且有明显的团聚现象。由图2可见,所有衍射峰均可指标化为球霰石型CaCO3(JCPDS33-0268),未发现其他衍射峰,表明该条件下所制备的样品为纯相的球霰石型CaCO3,而非热力学上更为稳定的文石型或方解石型(以石灰石为制备原料时主要产物的晶型)。原因可能在于,相比于石灰石消化液体系,本体系中Ca2+和CO32-浓度均较高,根据奥斯特瓦尔德一步规则[15],在高过饱和状态下,同质多形体之间的界面能之差起主要支配作用,这种支配作用有利于形成亚稳态沉淀物,因此形成的CaCO3为球霰石型。

图1 无添加剂条件下下制备的CaCO3的FESEM照片
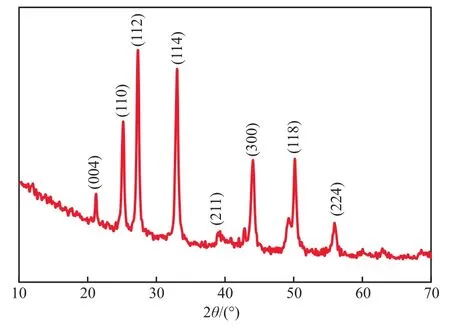
图2 无添加剂条件下下制备的CaCO3的XRD谱图
2.2 STP加入量对CaCO3形貌及粒径的影响
在Ca2+浓度为1.0 mol/L的条件下,不同STP加入量下制备的CaCO3的FESEM照片见图3。由图3可见:当STP加入量为0.75%时,生成的CaCO3颗粒较大,团聚明显;当STP加入量为2.00%时,生成的CaCO3的粒径变小,分散性明显得到改善,粒径约为200 nm;当STP加入量达到3.00%时,生成的CaCO3的粒径进一步减小,达到30~60 nm;当STP加入量增至4.00%时,生成的CaCO3颗粒明显大小不均匀,微米颗粒表面伴随有少量纳米颗粒生成。
在Ca2+浓度为1.0 mol/L的条件下,不同STP加入量下制备的CaCO3的XRD谱图见图4。由图4可见,与无添加剂条件下所制备CaCO3的XRD谱图(图2)相比,添加STP后所制备各试样的衍射峰均有不同程度的宽化现象,与图3中CaCO3粒径的变化基本一致。通过对STP加入量为3.00%时制备CaCO3的XRD谱图采用谢乐公式[16]进行计算,得到制备样品的粒径为45 nm。此外,由图4还可见,STP作为添加剂虽然可使CaCO3粒径的减小,却未改变CaCO3的晶型,无论是否有STP的添加,以向电石渣浸取液中通入CO2的方式制备的CaCO3始终保持球霰石型。

图3 不同STP加入量下制备的CaCO3的FESEM照片STP加入量:a 0.75%;b 2.00%;c 3.00%;d 4.00%
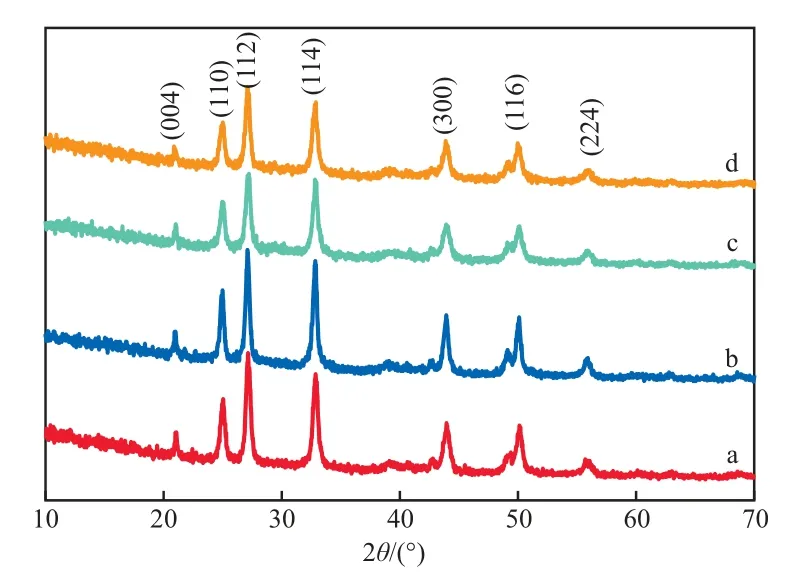
图4 不同STP加入量下制备的纳米CaCO3的XRD谱图STP加入量:a 0.75%;b 2.00%;c 3.00%;d 4.00%
上述结果表明,在电石渣浸取液Ca2+浓度为1.0 mol/L的情况下,STP加入量对所制备CaCO3的形貌具有较大影响。在不同体系中STP的作用方式差异明显,目前已有多人提出关于STP在纳米CaCO3制备过程中的作用机理。周立群等[17]用Ca(NO3)2·4H2O和Na2CO3·10H2O为原料、以STP为添加剂,采用室温固相反应制备了粒径为19 nm的CaCO3,并提出STP在制备过程中电离出离子进入CaCO3的正离子晶格位置或选择性吸附在CaCO3晶面,改变CaCO3表面能,从而抑制CaCO3晶体的生长和团聚。杨亚囡等[18]以分析纯的CaCl2与Na2CO3为原料,以STP为晶型控制剂,当STP加入量从0.07%提高到0.75%时,制备CaCO3的粒径由1~2 μm减小到30~50 nm,与本研究中不同STP加入量的作用趋势相同。
2.3 Ca2+浓度对CaCO3形貌和粒径的影响
不同Ca2+浓度下制备的CaCO3的FESEM照片见图5。由图5可见:当浸取液Ca2+浓度为0.5 mol/L时,制备的CaCO3颗粒较大,且团聚现象明显,仅部分表面有小颗粒;当浸取液Ca2+浓度为1.0 mol/L时,制备的CaCO3粒径显著减小(约30~60 nm),同时分散性也有所改善;当Ca2+浓度进一步增加到1.5 mol/L时,CaCO3的粒径并没有显著变化,但分散性相对变差。
在晶体生长过程中,过饱和度是晶核产生或晶体长大的最重要推动力[19],过饱和度的大小直接影响晶核的形成过程及晶体的生长速率。成核初期,成核速率和生长速率均随过饱和度的增加而明显增大;当过饱和度进一步提高时,成核速率的增大会逐渐占优势,晶体成核速率对过饱和度的敏感程度会远高于生长速率[20],从而导致晶核数增加、晶体生长速率趋缓、颗粒粒径减小。本体系中,当溶液中Ca2+浓度从0.5 mol/L提高到1.0 mol/ L时,NH4
+浓度也相应增大,通入CO2时体系中CaCO3的过饱和度增大,使得合成的CaCO3的粒径明显降低。而当Ca2+浓度进一步增大至1.5 mol/L时,过饱和度对粒径的影响减弱,CaCO3的粒径并未持续减小,而且Ca2+浓度过高时会使CaCO3颗粒在生长过程中碰撞的概率增加,团聚的可能性增大。

图5 不同Ca2+浓度下制备的CaCO3的FESEM照片
2.4 STP作用方式探讨
von Weimarn[21]提出了沉淀物的聚集速率(ν)与溶液的相对过饱和度(σ)之间关系的经验公式,见式(1)。

式中:K为常数,与沉淀性质、温度、介质等因素有关;σ=(cQ-S)/S,cQ为加入沉淀剂瞬间生成沉淀物质的浓度,S为沉淀物的溶解度,由此可见提高体系的相对过饱和度有利于增大沉淀物聚集速率,生成更多晶核。本体系中,STP能够与Ca2+螯合形成由4个六元环组成的六配位八面体结构[22](与球霰石型CaCO3的简单六方型晶胞结构相似),一方面STP可以与Ca2+配位,提供成核位点,使得局部构晶离子浓度增大,获得局部较高的相对过饱和度,能够生成更多晶核;另一方面STP能够与生成的CaCO3在后者表面以晶格匹配和静电作用方式[23]结合,抑制表面Ca2+的活性,使晶体生长速率降低。
由于在反应体系中有NH3-NH4Cl缓冲体系的存在,使得溶液pH不会随CO2的吸收而有过大的波动。当反应接近完成阶段时,体系中的NH3几乎反应完全,NH3-NH4Cl缓冲体系被打破,使得溶液pH快速下降。溶液pH随反应时间的变化见图6。由图6可见:在其他条件相同的情况下,体系中加入STP后溶液pH突跃的时间点有所延后;反应进行的前半阶段,不论有无STP,溶液pH的变化趋势基本一致;反应后半阶段,加入STP的体系,溶液pH的下降趋势明显趋缓,几乎无突跃点的存在,而无STP情况下,在反应约630 s之后,溶液pH明显下降。这可以从侧面说明STP存在下,反应后半阶段的反应速率降低,CaCO3晶体生长速率减缓,添加剂对晶体生长的抑制作用与前面提出的可能作用方式相符合。
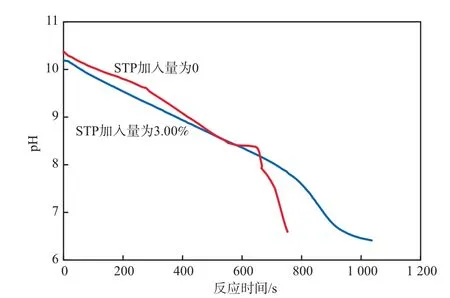
图6 溶液pH随反应时间的变化
将分析纯CaCO3与STP加入量为3.00%制备的CaCO3进行对比,二者的FTIR谱图见图7。由图7可见,添加STP 的试样在3 384 cm-1处的宽吸收峰归属于缔合羟基,在1 150 cm-1和1 090 cm-1处的特征吸收峰归属于P—O和P=O的伸缩振动。这可能是由于纳米CaCO3颗粒表面存在羟基或者更容易吸收空气中的水分,同时有少量STP最终包覆在纳米CaCO3颗粒表面。纳米CaCO3颗粒表面存在的羟基可能与纳米CaCO3粒径的减小有关。根据诸葛兰剑等[24-25]提出的CaCO3分子模型,由于“位阻效应”,CaCO3颗粒表面绝大部分为带负电荷的CO32-所占据,对外显电负性。在CaCO3胶体溶液中,CaCO3颗粒优先吸附Ca2+,当CaCO3粒径由3~5 μm降到30~60 nm时,表面能明显增加,势必通过团聚或形成氢键等缔合作用降低表面能,导致颗粒表面存在羟基或容易吸附空气中水分。此外,磷酸根的存在说明STP的确进入CaCO3晶体中或吸附于晶体表面,从而使对CaCO3生长过程的抑制成为可能。
2.5 纳米CaCO3产品物性与初步技术经济分析
在电石渣浸取液Ca2+浓度为1.0 mol/L、STP加入量为3.00%的最佳工艺条件下制备纳米CaCO3,产品指标测试结果见表1。由表1可见,产品的各项检测结果均达到GB/T 19590—2011《纳米碳酸钙》标准[16]的要求。根据实验结果,在最佳工艺条件下,由电石渣制备纳米CaCO3的产率为80%,所消耗的原料成本约330元/t。按纳米CaCO3售价3 000 元/t计算,处理1 t电石渣产生的经济效益约为2 670元。由此可见,本工艺以电石渣为原料生产纳米CaCO3,不仅可以减少排渣量,实现其资源化、减量化、无害化,具有良好的环境效益,而且生产成本低廉,具有可观的经济效益。

表1 纳米CaCO3产品指标测试结果
3 结论
a)以电石渣为原料,采用向浸取液中通入CO2的方法由电石渣制备纳米CaCO3。在电石渣浸取液Ca2+浓度1.0 mol/L、STP加入量3.00%的优化工艺条件下,制备的纳米CaCO3为粒径30~60 nm的纯相球霰石晶型。
b)STP可以有效控制纳米CaCO3的粒度和形貌。
c)以电石渣为原料制备纳米CaCO3具有良好的环境效益和可观的经济效益。
[1] 冯文华. 纳米CaCO3制备新工艺研究[D]. 上海:华东理工大学,2015.
[2] 颜鑫,王佩良,舒均杰. 纳米CaCO3关键技术[M]. 北京:化学工业出版社,2007,12 - 14.
[3] 李强. 不同形貌纳米CaCO3的制备、改性及应用研究[D]. 合肥:合肥工业大学,2014.
[4] 偰南杰,曹建新,高传平,等. 反应温度对电石渣合成纳米CaCO3形貌的影响[J]. 中国粉体技术,2015,21(01):22 - 26.
[5] Zhang Wanyou,Hu Yang,Xi Lijuan,et al. Preparation of calcium carbonate superfi ne powder by calcium carbide residue[J/OL]. Energy Procedia,2012,17(B):1635-1640 [2016-03-18]. http://www.sciencedirect.com/ science/article/pii/S1876610212006273.
[6] 高传平,曹建新,杨林,等. 盐酸处理电石渣制备球形超细CaCO3的研究[J]. 贵州大学学报,2009,26 (3):90 - 94.
[7] EI-Sherbiny S,EI-Sheikh S M,Barhoum A. Preparation and modification of nano calcium carbonate filler from waste marble dust and commercial limestone for papermaking wet end application[J]. Powder Technol,2015,279:290 - 300.
[8] 刘健,朱必学,朱云勤,等. 高温烧结磷石膏钙渣制备轻质CaCO3[J]. 化工环保,2011,31(1):69 - 72.
[9] 董卫龙. 电石渣制备超细活性CaCO3工艺研究及其塑料中的应用[D]. 杭州:浙江工业大学,2014.
[10] 闫琨,周康根. 利用电石渣液相法制备纳米CaCO3[J]. 化工环保,2008,28(6):535 - 537.
[11] 乔叶刚. 用电石废渣制备纳米CaCO3的研究[J]. 中国粉体技术,2005,11(1):39 - 41.
[12] 张宏. 电石渣制备纳米CaCO3的研究[J]. 维纶通讯,2006,26(4):15 - 17.
[13] 张爱华,朱敏,关云山,等. 氯化铵处理电石渣制备纳米CaCO3的实验研究[J]. 科学技术与工程,2013,13(10):2880 - 2883.
[14] 卢忠远,姜彩荣,涂铭旌. 电石渣制备高白度板状CaCO3的研究[J]. 西安交通大学学报,2004,38 (9):989 - 990.
[15] Watanabe H,Mizuno Y,Endo T,et al. Effect of initial pH on formation of hollow calcium carbonate particles by continuous CO2gas bubbling into CaCl2aqueous solution[J]. Adv Powder Technol,2009,20 (1):89 - 93.
[16] 全国化学标准化技术委员会无机化工分会. GB/T 19590—2011 纳米CaCO3[S]. 北京:中国标准出版社,2011.
[17] 周立群,杨念华,王驰伟,等. 纳米的室温固相合成及三聚磷酸钠的控制机理[J]. 化学与生物工程,2005,7(7):14 - 16.
[18] 杨亚囡,朱晓丽,孔祥正. 沉淀反应制备CaCO3粒子及其形貌和结构的控制[J]. 无机材料学报,2013,12(28):1313 - 1320.
[19] 程芳琴,程文婷,成怀刚. 盐湖化工基础及应用[M]. 北京:科学出版社,2012:123 - 147.
[20] 陈先勇. 纳米CaCO3合成的研究[D]. 成都:四川大学,2004.
[21] von Weiman P P. The precipitation laws[J]. Chem Rev,1925(2):227 - 228.
[22] 何春芳,叶近婷,高阳. 三聚磷酸钠与柠檬酸钠钙螯合机理和螯合能力的对比分析[J]. 分子科学学报,2015,31(3):198 - 202.
[23] 欧阳建明. 单分子膜诱导生物矿物晶体生长中的晶格匹配和电荷匹配[J]. 化学进展,2005,17(5):931 - 935.
[24] 诸葛兰剑,张士成,韩跃新. 超细CaCO3的合成及结晶过程[J]. 硅酸盐学报,1999,27(2):159 - 163.
[25] 颜鑫,卢云峰. 轻质及纳米CaCO3关键技术[M]. 北京:化学工业出版社,2011:100 - 109.
(编辑 叶晶菁)
Preparation of nano CaCO3from calcium carbide residue by CO2precipitation with high Ca2+concentration
Wang Bainian,Ge Lixiang,CaoMeng,Yang Baojun
(College of Chemistry and Chemical Engineering,Hefei University of Technology,Hefei Anhui 230009,China)
Nano CaCO3was prepared from calcium carbide residue using NH4Cl solution as leaching agent,CO2as carbonation agent,sodium tripolyphosphate (STP) as additive agent. The experimental results show that:When Ca2+concentration of calcium carbide residue leaching solution is 1.0 mol/L and STP dosage is 3.00%,the nano CaCO3with 30-60 nm of particle size is prepared;STP has good effect on control of particle size and morphology of nano CaCO3;Under the optimum technological conditions,the yield of nano CaCO3from calcium carbide residue is 80%,and the economic benefi ts of calcium carbide residue treatment is 2 670 yuan per ton.
nano CaCO3;calcium carbide residue;ammonium chloride;sodium tripolyphosphate;CO2
X705
A
1006-1878(2016)04-0460-06
10.3969/j.issn.1006-1878.2016.04.020
2015 - 12 - 04;
2016 - 03 - 22。
王百年 (1973—),男,安徽省芜湖市人,博士,教授,电话 13966683600,电邮 284855884@163.com。联系人:杨保俊,电话 13155131429,电邮 bj_yang@hfut.edu.cn。
