2014—2016年河南省猪伪狂犬野毒感染和免疫情况血清学调查
2016-02-09解伟涛乔松林郝慧芳郭成留
解伟涛,梁 跃,乔松林,郝慧芳,郭成留
(河南省农业科学院 动物免疫学重点实验室, 河南 郑州 450002)
2014—2016年河南省猪伪狂犬野毒感染和免疫情况血清学调查
解伟涛,梁 跃,乔松林*,郝慧芳,郭成留
(河南省农业科学院 动物免疫学重点实验室, 河南 郑州 450002)
调查河南省猪群伪狂犬野毒感染流行情况,为制订合理的防控与净化策略提供参考依据。于2014年1月—2016年5月,采集河南省不同地域780个猪场16 200份血清样本,使用gE-ELISA鉴别诊断方法进行血清学调查,对10个阳性稳定猪场和10个阳性发病猪场进行血清学分析,对2个后备母猪培育场(1个为阴性场,另1个为阳性场)进行生产成绩分析,同时对猪场伪狂犬gE基因缺失疫苗使用情况进行调查,并跟踪了40个猪场的疫苗免疫情况。结果显示,河南省猪场伪狂犬gE抗体阳性率90.0%,血清样本阳性率46.2%,成年种猪阳性率53.1%,后备种猪阳性率27.6%。猪群在阳性发病场的阳性率高于在阳性稳定场的阳性率,育肥猪感染带毒严重影响其生产成绩,猪场伪狂犬疫苗免疫强度呈现增加趋势。综上可知,目前河南省猪群伪狂犬野毒感染情况比较严重。
猪; 伪狂犬; 野毒; gE-ELISA; 免疫
猪伪狂犬病(pseudorabies,PR)是由猪伪狂犬病毒(pseudorabies virus,PRV)引起的一种多种动物共患的传染病。猪是该病毒唯一的自然贮存宿主,犬、猫、牛、羊等动物感染后表现为致死性[1-4]。不同阶段和免疫背景的猪感染PRV后临床症状差异较大,种猪群感染后可引起繁殖障碍(精子活力下降、流产、产死胎等);哺乳阶段和保育阶段仔猪感染后可出现神经症状、呼吸道症状和消化道症状,且感染日龄越小,死亡率越高;育肥猪和成年猪感染后,一般表现为一过性的发热和呼吸道症状。临床上多继发副猪嗜血杆菌、链球菌、胸膜肺炎放线杆菌等细菌病。康复猪生长速度较慢,且终生带毒。
在美国、丹麦、荷兰等养猪发达国家,依靠基因缺失苗和与之相配套的鉴别诊断方法,在家猪群中已经完成PRV净化,并禁止使用PRV活疫苗[5]。2005—2010年,随着PRV基因缺失疫苗在国内猪场的广泛应用,我国猪群PRV感染得到了较好地控制,猪群感染率呈下降趋势。2010年国内许多猪场已经净化了该病,达到免疫无感染状态[6]。2011年后,PRV出现变异、毒力返强等新情况,许多猪场相继出现PRV疫情,该病在国内迅速大面积暴发流行。
河南省是养猪大省且位于国内养猪的中心地带,养猪业受PRV疫情影响尤其严重。笔者所在实验室于2014年1月—2016年5月,采用gE-ELISA鉴别诊断方法对河南省不同地域的猪场进行野毒感染情况血清学调查,对部分阳性稳定猪场和发病猪场进行血清学检测对比分析,对育肥阶段保持阴性和育肥阶段感染转阳的2个后备母猪培育场进行生产成绩分析,同时对猪场使用PRVgE基因缺失疫苗情况进行了调查,并统计分析了40个猪场近3 a的疫苗免疫情况,以了解河南省猪群PRV感染情况,为制定合理的防控与净化方案提供参考依据。
1 材料和方法
1.1 PRV血清样本采集
2014年1月—2016年5月,在河南省不同地域
的780个猪场,采集16 200份血清样品。采样猪场均已排除使用含gE基因PRV疫苗情况。
1.2 PRV血清学检测方法
血清学检测在河南省农业科学院动物免疫学实验室进行,PRV gE抗体鉴别诊断ELISA试剂盒购自IDEXX公司。检测程序和判断标准严格按照试剂盒使用说明进行。
1.3 PRV阳性稳定猪场和阳性发病猪场不同阶段猪群gE抗体阳性率比较
从上述检测猪场中分别选择10个生产成绩较好的PRV阳性稳定猪场和10个生产成绩较差的PRV阳性发病猪场,分别对种母猪、保育中后期(45~70日龄)、育肥前期(70~100日龄)和育肥中期(100~130日龄)血清样本gE抗体进行统计分析。
1.4 PRV感染对育肥阶段猪群生产成绩影响调查
选择河南省某种猪企业的2个后备母猪培育场进行生产性能测定,2个场猪的品种、饲料营养、硬件设施和饲养管理水平基本一致,分别为PRV阳性场和阴性场。对育肥阶段(体质量25~115 kg)的测定成绩进行统计分析,比较PRV感染对育肥阶段猪群生产成绩的影响。
后备母猪培育场生产性能测定在企业内部进行,种猪测定秤购自OSBORNE公司。测定程序严格按照农业部种猪生产性能测定规程进行。
1.5 PRVgE基因缺失疫苗免疫情况调查
对采样的780个猪场记录并统计PRVgE基因缺失疫苗免疫使用情况,对其中40个猪场近3 a的免疫情况进行统计分析。
2 结果与分析
2.1 PRV gE抗体检测情况
共检测统计了780个猪场16 200份血清样本,其中猪场阳性率为90.0%,血清阳性率为46.2%(表1)。可见,河南猪场普遍存在野毒感染情况,猪群感染带毒率较高,且未见有下降趋势。
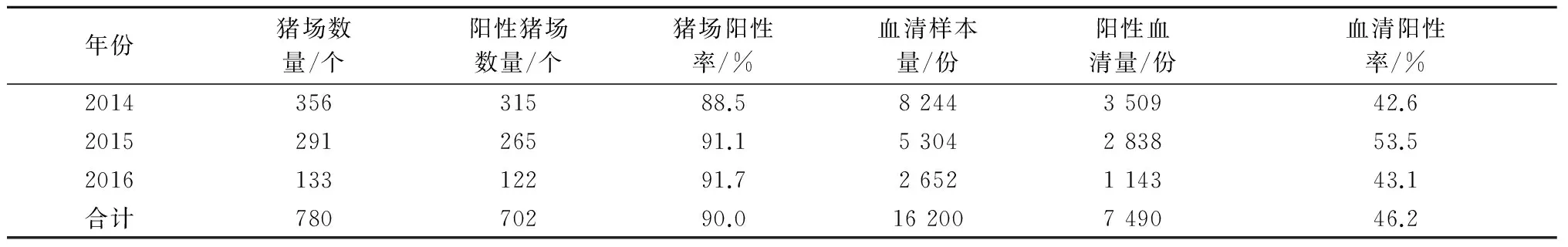
表1 河南省猪PRV gE抗体检测情况
2.2 种猪群gE抗体阳性率
共检测统计了9 392份种猪血清样本,成年种猪和后备种猪的感染带毒率分别为53.1%和27.6%(表2)。种猪多为隐性长期带毒,在应激情况下容易激活病毒,不定期间歇性排毒,是该病在猪群中长期流行并且很难根除的重要原因[7]。一般情况下,猪场种猪群每年的更新率为35%左右,通过不断补充阴性后备种猪,自然淘汰阳性种猪,理论上用3 a左右时间可以实现PRV净化。种猪群感染带毒率高,尤其是后备种猪也感染带毒,增加了PRV净化的难度。
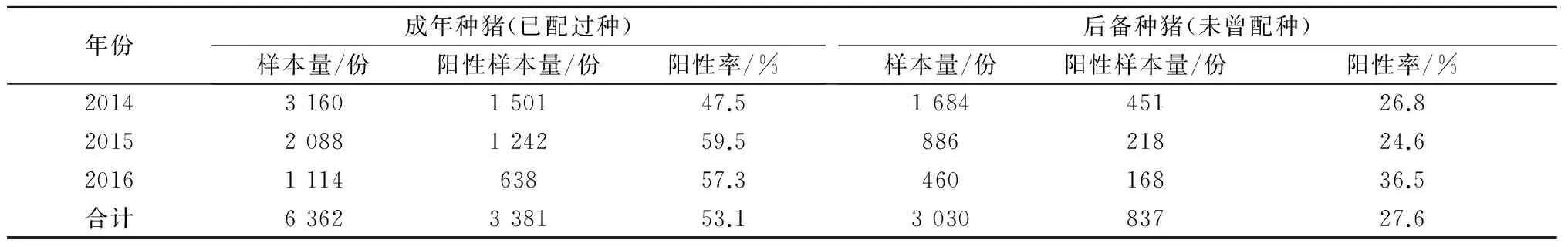
表2 种猪群gE抗体检测情况
2.3 PRV阳性稳定猪场和阳性发病猪场不同阶段猪群gE抗体阳性率
选择10个生产成绩较好的PRV阳性稳定猪场,对检测的486份血清进行统计分析(表3)。结果表明,通过采取强化免疫,不断补充阴性后备种猪,加强饲养管理和生物安全等综合防控措施,猪群整体gE抗体阳性率比较低,并且可以扩繁出大量阴性的育肥猪。

表3 PRV阳性稳定猪场gE抗体检测情况
选择10个生产成绩较差的PRV阳性发病猪场,对检测的461份血清进行统计分析(表4)。结果表明,对于PRV防控不力的猪场,猪群整体gE抗体阳性率比较高,尤其是种猪群和育肥猪感染带毒情况非常严重,种母猪高达88.3%,育肥中期高达91.1%。

表4 PRV阳性发病猪场gE抗体检测情况
2.4 PRV感染对育肥阶段猪群生产成绩的影响
由表5可知,与育肥阶段gE抗体转阳场结果相比,育肥阶段gE抗体阴性场猪群批次成活率提高3.9个百分点,校正100 kg日龄缩短13 d。可见,PRV感染对育肥阶段猪群的生产指标影响较大,在阳性猪场开展PRV净化工作具有重要的经济意义。

表5 2个猪场育肥阶段猪群测定成绩
2.5 PRVgE基因缺失疫苗免疫情况调查
选择40个年出栏3 000~50 000头的规模猪场,进行PRV疫苗免疫情况跟踪调查发现,种猪群每年免疫2~3次的猪场比例在逐渐减少,目前以每年免疫4次为主(表6);在断奶至育肥阶段,只免疫1次的猪场越来越少,目前以免疫2~3次为主(表7)。

表6 种猪群PRV疫苗免疫情况 %

表7 断奶至育肥阶段猪群PRV疫苗免疫情况 %
PRV疫苗TCID50国家标准为5 000/头份。统计数据表明,低效价的疫苗在猪场的使用率在减少,目前猪场使用的疫苗以每头份大于105TCID50为主(表8)。

表8 猪场使用PRV疫苗效价(每头份疫苗病毒含量TCID50)情况 %
调查结果表明,2014—2016年,猪群免疫强度呈逐渐增强趋势,免疫次数增加,高效价疫苗使用增多。出现这种现象可能由于PRV出现变异和毒力返强[8-10],疫苗交叉保护力下降,猪群感染压力巨大等因素导致。
3 结论与讨论
3.1 关于PRV抗体(gE/gB)检测
由于PRVgE基因缺失疫苗在生产中广泛使用,通过gE-ELISA抗体鉴别诊断试剂盒检测血清中的gE抗体,可以区分疫苗毒和野毒感染,这也为PRV的净化提供了技术保障。通过检测gE抗体判断野毒感染,还需要排除母源抗体和感染早期抗体尚未转阳等影响因素,对于gE抗体检测结果阳性样品(仔猪),除了机体感染外,也有可能是母源抗体(非感染)。对于gE抗体检测结果阴性样品,除了考虑机体未感染野毒外,还可能是野毒感染时间比较短,抗体尚未转阳。
对于免疫抗体检测,一般使用gB-ELISA抗体检测试剂盒。由于gB抗体检测不能区分疫苗毒和野毒产生的抗体,且gB抗体水平与免疫保护力相关性不强,目前对于大多数PRV野毒阳性猪场,检测gB抗体意义有限。如果条件允许,检测血清中和抗体更有意义[11-12]。同时也要重视细胞免疫在控制伪狂犬发病、减少排毒等方面发挥的重要作用[13]。3.2 PRV野毒感染和免疫情况分析本次检测统计结果显示,河南省猪场PRV阳性率高达90.0%,血清阳性率为46.2%。对比实验室近年来检测的历史数据[14]和常洪涛等[15]发表的分析报告,发现当前河南省猪群PR野毒感染情况仍然十分严重。
疫苗免疫仍是当前防控PR疫情的主要手段。本次免疫情况调查结果表明,采取种猪群每年免疫2~3次,断奶至育肥阶段只接种1次,以及猪群使用普通效价疫苗的免疫策略,已经不能满足当前猪场伪狂犬防控需要。鉴于PRV已经出现变异和毒力返强情况,现有的疫苗对野毒的交叉保护力下降。猪群需要采取强化免疫[16],提高中和抗体水平[17],避免出现免疫空白期,从而减少感染风险。
3.3 猪群PRV控制与净化
当前PR疫情已经严重制约了我国养猪业健康发展,按照国家《动物疫病防控中长期规划(2012—2020年)》要求,2020年我国所有种猪场必须达到PRV净化标准。血清学调查是制订净化策略的基础,通过本次调查发现,成年种猪gE抗体阳性率高达53.1%,如果采取“淘汰清群”的净化方案,代价太大,且难以推广落实。目前国内的养殖模式,后备种猪一般都是从育肥阶段选留的。在PRV野毒阳性发病的猪场,育肥猪感染带毒率非常高,这增大了挑选出健康合格后备种猪的难度,不利于净化工作开展。在一些阳性稳定猪场,通过强化免疫、加强饲养管理和生物安全等综合防控措施,完全可以扩繁出阴性的育肥猪。因此,对于目前大多数阳性猪场,可以通过强化免疫,先稳定生产;坚持补充阴性后备种猪(自留或外购),自然淘汰阳性种猪,逐步完成净化。如果条件允许,可以实施“检测—淘汰”方案,以便加快净化进度。
本研究结果表明,目前河南省猪群伪狂犬野毒感染情况比较严重。通过准确的血清学调查,并根据猪群感染状况,制订科学、合理的PRV净化方案是净化成功的关键。目前,国家生猪产业技术体系28个试验站(河南省3个)及河南省生猪产业技术体系1个试验站和5个示范场,已经开展了PRV的净化工作,并且取得了显著的净化效果。省内的一些大型种猪场和商品猪场,也积极开展PRV净化工作,取得了较好的净化效果。通过全国一致行动,科学规划,种猪场率先实现净化,再扩大到商品猪场,最后进行区域内联合净化,相信最终可以实现PRV净化目标。
[1] 陈灵芝,张国军,杨珊珊,等.一起犬伪狂犬病例报告[J].中国动物保健,2014,16(10):92.
[2] 张建新,靳冬,仇泽凯,等.探秘猪场死狗[J].中国动物保健,2013,15(3):26-28.
[3] Kong H J,Zhang K S,Liu Y J,etal.Attenuated live vaccine (Bartha-k61) caused pseudorabies (Aujeszky’s disease) in sheep[J].Vet Res Commun,2013,37:329-332.
[4] 吕建军,张兰清,英措.山羊感染伪狂犬病毒的诊断[J].畜牧与兽医,2014,46(8):92-94.
[5] Jeffrey J Z,Locke A K,Alejandro R,etal.猪病学[M].10版.赵德民,张仲秋,周向梅,等译.北京:中国农业大学出版社,2014:438-448.
[6] 李晓成.2010年猪群疫病流行动态分析报告及2011年猪群疫病流行动态预测[J].北方牧业,2011(2):12.
[7] 陈溥言.兽医传染病学[M].5版.北京:中国农业出版社,2006:218-220.
[8] Luo Y Z,Li N,Cong X,etal.Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61 vaccinated swine population in China[J].Vet Microbiol,2014,174(1/2):107-115.
[9] 童武,张青占,郑浩,等.免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报,2013,21(3):1-7.
[10] An T Q,Peng J M,Tian Z J,etal.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].Emerging Infectious Diseases,2013,19(11):1749-1755.
[11] 杨文萍,顾真庆,孙海凤,等.伪狂犬病毒流行毒株的抗原性和血清中和特性分析[J].畜牧与兽医,2014,46(10):11-14.
[12] 张明辉,库旭钢,凌云志,等.猪伪狂犬病病毒HNX株在免疫猪群中水平传播能力研究[J].中国预防兽医学报,2015,37(6):426-429.
[13] 何启盖,童光志,杨汉春,等.猪伪狂犬病流行病学特征、净化技术及其应用示范[J].中国畜牧杂志,2015,51(24):68-74.
[14] 解伟涛,乔松林,王寅彪,等.2013年河南省猪伪狂犬野毒感染血清学调查[J].中国动物传染病学报,2014,10(6):66-70.
[15] 常洪涛,刘惠敏,郭占达,等.河南省及周边省份猪群中大面积感染猪伪狂犬病毒的病因分析[J].病毒学报,2014,30(4):441-448.
[16] 杨汉春.猪伪狂犬病的防控[J].北方牧业,2013(12):24.
[17] 何启盖.猪病流行特点与主要防控技术[J].今日养猪业,2015(8):58-62.
Serological Survey of Porcine Pseudorabies Virus Infection and Vaccine Immunization from 2014 to 2016 in Henan Province
XIE Weitao,LIANG Yue,QIAO Songlin*,HAO Huifang,GUO Chengliu
(Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
The current infection status of pseudorabies virus in the pig population of Henan province was investigated to provide reference basis for developing effective control and purification strategies for the disease. The study was carried out from January 2014 to May 2016. A total of 16 200 serum samples were collected and analyzed from 780 pig farms in different regions of Henan province to perform a serological survey. Pseudorabies virus antibodies were detected using gE-ELISA kit. 10 stable pig farms and 10 unstable pig farms which were pseudorabies virus positive were compared by serology.The production performance in two gilts breeding pig farms which were pseudorabies virus positive and negative respectively was compared.The use ofgE-deleted vaccine for pseudorabies virus was investigated in pig farms at the same time,and 40 farms were tracked on vaccine immunization.The results showed that the positive rates of PRV infection were 90.0% for pig farms and 46.2% for serum samples in Henan province.The positive rates were 53.1% for the breeding herd and 27.6% for the exposed gilts.The positive rate in the unstable pig farms was higher than that in the positive stable pig farms.And the production performance was seriously impacted by the viral infection in the finishing pigs.The strength of vaccine immunization had increased.In summary,the current situation of pig herd infected with pseudorabies virus is more serious in Henan province.
pig; pseudorabies virus; wild virus; gE-ELISA; immunization
2016-07-20
国家生猪产业技术体系建设专项(CARS-36);河南省生猪产业技术体系创新团队项目(S2012-06)
解伟涛(1982-),男,河南虞城人,兽医师,硕士,主要从事猪病流行与防控研究。 E-mail:xwt513@126.com
*通讯作者:乔松林(1970-),男,河南鲁山人,研究员,博士,主要从事预防兽医学研究。E-mail:cdj565@gmail.com
时间:2016-11-25 14∶24∶33
S855.3
A
1004-3268(2016)12-0153-05
网络出版地址:http://www.cnki.net/kcms/detail/41.1092.S.20161125.1424.034.html
