芦苇根际土壤有机磷组分的季节变化及与磷酸酶活性的关系①
2016-02-08朱芸芸滕泽栋
朱芸芸,李 敏,曲 博,赵 暾,滕泽栋
(北京林业大学环境科学与工程学院,北京 100083)
芦苇根际土壤有机磷组分的季节变化及与磷酸酶活性的关系①
朱芸芸,李 敏*,曲 博,赵 暾,滕泽栋
(北京林业大学环境科学与工程学院,北京 100083)
通过野鸭湖湿地一年实验研究了芦苇根际土壤中各组分有机磷含量随植物生长的变化规律,分析了不同有机磷组分与磷酸单酯酶、磷酸二酯酶活性间的关系。结果表明:有机磷含量分布为活性有机磷(L-OP)<中活性有机磷(ML-OP)<中稳定性有机磷(MR-OP)<高稳定性有机磷(HR-OP),各组分含量均随芦苇生长先降低后升高。在芦苇对养分需求最大的旺盛生长期,L-OP、ML-OP含量达到最低值,分别为2.46、3.27 mg/kg;在此阶段,MR-OP、HR-OP含量也有所降低。在有机磷矿化过程中,HR-OP一定程度上可转化为ML-OP,ML-OP与MR-OP主要转化为L-OP。磷酸单酯酶与磷酸二酯酶活性均随芦苇生长先降低后升高,在其旺盛生长期达到最低值,分别为PhOH 0.37 mg/(g·h)和PN 62 mg/(g·h)。磷酸酶活性均与L-OP、ML-OP、HR-OP含量呈极显著或显著正相关,活性磷含量的高低对磷酸酶活性有明显的影响作用,两种磷酸酶在一定程度上也可水解转化稳定性高的有机磷组分。衰亡期的芦苇,其衰败的老根及脱落物可间接促进磷酸酶活性。
有机磷;磷酸单酯酶;磷酸二酯酶;根际土壤;芦苇
磷作为一种不可再生的宝贵资源,矿石中的储量十分有限。据统计,近35年人类对磷的开采已达到了顶峰,后期将严重影响全球的粮食产量[1]。按目前消耗速度预计,矿石中的磷将在100 ~ 250年内消耗殆尽[2]。植物从土壤中吸收的磷主要为磷酸盐,只有极少部分有机磷能被植物直接利用。一般有机磷占全磷的10% ~ 15%,在有机质含量高的黑土中,有机磷可达全磷的60% ~ 70%[3],与无机磷相比,有机磷具有较大的移动性,被土壤无机矿物固定程度低等特点。在磷酸酶的作用下,即使是难溶于水的有机磷经水解后可释放出无机磷以供植物吸收利用[4–5],但在磷酸酶缺乏的情况下, 土壤有机磷的释放需要几百年的时间[6]。李文华等[7]研究发现,碱性磷酸酶参与土壤磷形态之间的转化,碱性磷酸酶活性与活性有机磷、非活性有机磷均呈正相关关系,且非活性有机磷为生物有效磷的潜在磷源。冯固等[8]的研究发现,玉米根际土壤碱性磷酸酶能有效提高玉米对土壤有机磷的吸收利用。周驰等[9]的研究也发现巢湖沿岸土壤有机磷与速效磷和藻类可利用磷含量密切相关,其转化过程受磷酸酶活性影响。因此,磷酸酶对土壤有机磷的矿化分解过程有重要作用。
根据磷酸酶水解酯键的类型把磷酸酶分为磷酸单酯酶和磷酸二酯酶。自然界中,有机磷大多以磷酸单酯或二酯的形态存在[10–11],参与有机磷水解的磷酸酶主要为磷酸单酯酶和磷酸二酯酶[10]。因此研究磷酸单酯酶与磷酸二酯酶活性对研究有机磷转化机制有重要意义。目前国内外学者对土壤有机磷含量分布及其与磷酸酶的关系做了大量的研究[12–15],大多是关于湖泊河流沉积物或耕地土壤中酸性和碱性磷酸酶与有机磷组分间的关系[16–18],对湿地植物根际土壤中磷酸单酯酶和磷酸二酯酶的研究尚缺乏。因此本文研究了芦苇根际土壤中不同组分有机磷含量随植物生长的动态变化规律,同时测定了根际土壤中磷酸单酯酶和磷酸二酯酶的活性,分析了根际土壤中有机磷含量与磷酸酶活性的关系,研究结果可进一步完善磷酸酶在有机磷转化过程中的作用机制,并对湿地在缓解水体富营养化中的作用以及如何提高植物对有机磷的吸收利用提供有效依据。
1 材料与方法
1.1 样品采集
本文选择典型湿地植物——芦苇(Phragmitescommunis)为研究对象,实验样品采自北京市延庆县野鸭湖湿地 40°26¢32.10²N,115°51¢24.12²E 处,地理位置及采样点位的分布情况如图1所示,芦苇群落主要分布于离河流边缘稍远的陆地上。
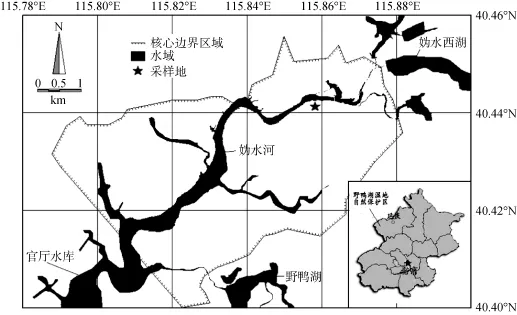
图1 野鸭湖湿地自然保护区平面图及采样点位分布图Fig. 1 Diagram of Yeyahu wetland natural reserve and the sampling sites
野鸭湖湿地的湖水一般在 4月份开始解冻,此时多年生的挺水植物开始发芽生长,因为气候原因,野鸭湖湿地的气温在2013年4月份仍然十分低,11月植物死亡并已被冰层覆盖。因此采样周期为2013年5—10月每月中旬。采集方法为:挑选长势较好的植株,采用“抖根法”[19]抖落掉不含根系的大块土壤,再用刷子仔细扫取根系表面的土壤,混合均匀作为根际的土样并3次重复取样,12 h内运送至实验室处理,自然风干后过100目筛待用。其中,用于分析土壤含水率的样品采用新鲜土样。湿地背景土壤基本理化性质见表1。
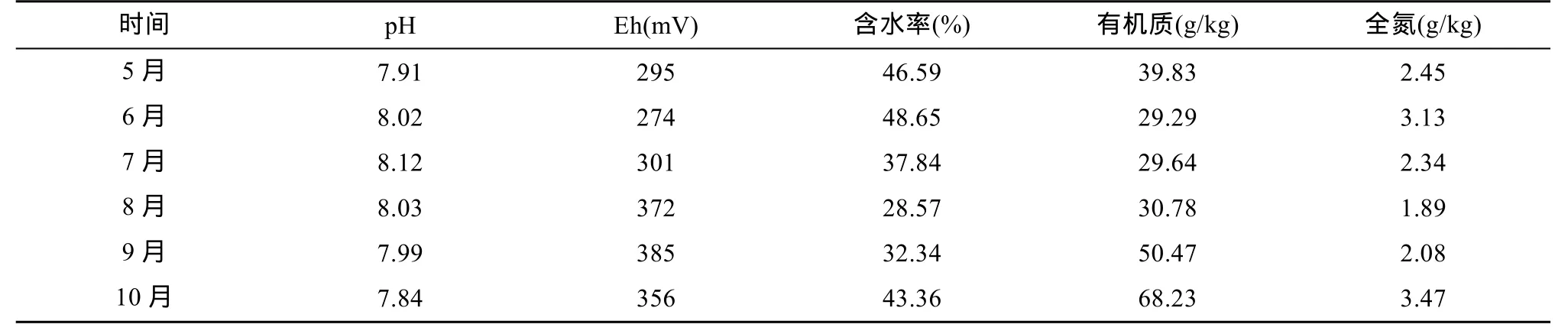
表1 背景土壤基本理化性质Table 1 Basic physical and chemical properties of background soil
1.2 磷酸酶活性测定方法
磷酸单酯酶和磷酸二酯酶活性的具体测定方法参照文献[20],对照组用蒸馏水代替底物处理。磷酸单酯酶和磷酸二酯酶的活性分别以1 g土壤在37 ℃下培养 1 h产生的苯酚(PhOH)和对硝基酚(PN)的质量表示。
1.3 有机磷组分测定方法
采用化学连续提取法对根际土壤中各形态有机磷进行测定,具体测定方法见参考文献[21]。将有机磷分为活性有机磷(L-OP)、中活性有机磷(ML-OP)、中稳定性有机磷(MR-OP)、高稳定性有机磷(HR-OP)。磷含量的测定均使用钼锑抗分光光度法[22]。
1.4 数据分析与处理
试验数据用 Microsoft Excel 2007及 SPSS18.0统计软件处理,文中所有图形于软件Origin9.2中完成。所有数据使用单因素方差分析,Duncan法显著性检验(P<0.05),相关性分析采用Pearson法分析。
2 结果与讨论
2.1 芦苇根际土壤中各有机磷组分含量的季节变化
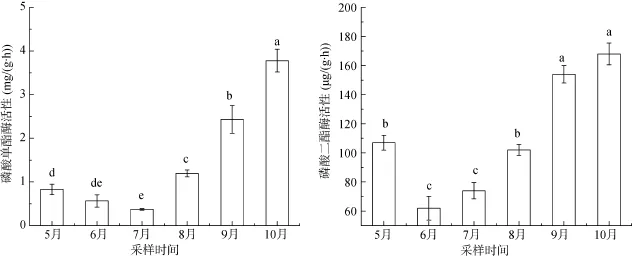
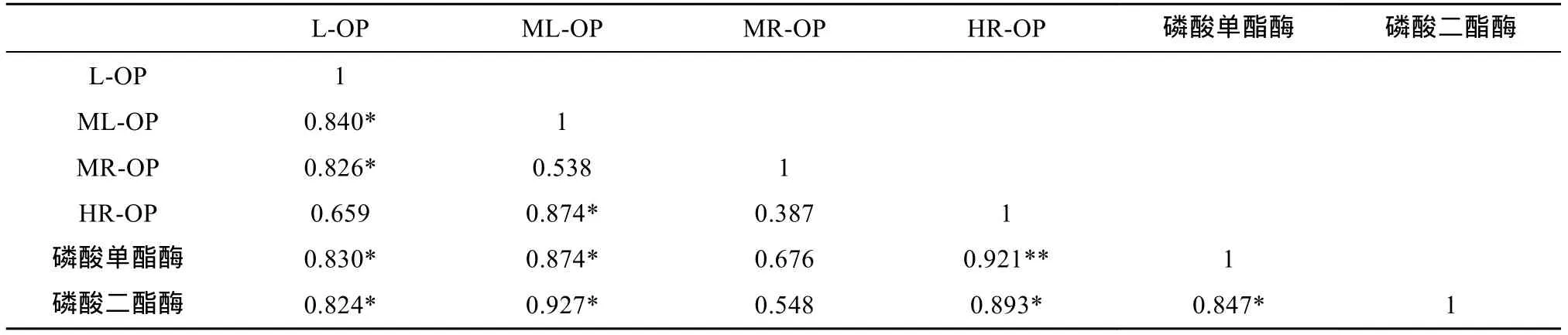
芦苇根际土壤不同有机磷组分含量随季节变化如图2所示,有机磷组分含量分布为L-OP 图2 芦苇根际土壤中各形态有机磷的季节变化Fig. 2 Seasonal variations of OP contents inPhragmites communisrhizosphere soils MR-OP含量随芦苇生长先减后增,范围分别为47.25 ~ 98.55mg/kg。MR-OP为潜在的生物有效性磷,主要成分为富里酸结合的含磷化合物[25]。HR-OP作为稳定性较高的有机磷形态,随着芦苇生长变化较小,先略有降低后逐渐升高,含量范围78.57 ~ 131.1 mg/kg,其主要成分包括腐殖质中胡敏酸和胡敏素中的有机磷形态、肌醇含 4 ~ 6个磷酸的铁铝盐或者少量被Fe2O3胶膜所包裹的铝或钙磷[26]。 2.2 芦苇根际土壤中磷酸酶活性的季节变化 芦苇根际土壤磷酸酶活性随季节变化特征如图3所示,磷酸单酯酶与磷酸二酯酶活性均随着芦苇生长先降低后升高,磷酸单酯酶活性在 7月达到最低值,为0.37 mg/(g·h)(以PhOH量计),磷酸二酯酶活性在6月份达到最低值,为62 μg/(g·h)(以生成的PN量计)。磷酸二酯酶主要作用于土壤中的磷酸二酯,将其水解为磷酸单酯,此后又在磷酸单酯酶的作用下转化为植物可利用的正磷酸盐[27–28]。磷酸单酯主要包括肌醇磷酸酯、磷蛋白、磷酸糖类、单核苷酸[29];磷酸二酯主要包括DNA、RNA、磷脂、胞壁酸[30–31]。因此,磷酸二酯酶的水解产物恰好是磷酸单酯酶水解过程的底物,磷酸单酯酶与磷酸二酯酶活性变化趋势大致相同。随着芦苇的生长,根系变强,土壤酶活性逐渐增强。9月芦苇进入衰亡期,其衰败的老根以及老根表面脱落的表皮为微生物提供了营养源,促进了微生物的新陈代谢,也进一步提高了根际土壤磷酸酶的活性,磷酸酶活性在10月达到了峰值。 2.3 芦苇根际土壤中磷酸酶活性与有机磷组分的关系 磷酸酶是一种诱导酶或适应性酶,其活性除受植物根系和微生物的影响外,还间接地受土壤无机磷酸盐含量的支配。芦苇在旺盛生长期内大量吸收无机磷,造成根际土壤短暂的活性磷亏缺。根系在低磷胁迫下,会随着芦苇的生长分泌多种酚类、酶类以及有机酸等,这些分泌物能直接或间接地改变土壤的性质。同时,芦苇根系巨大的表面积以及分泌物又为大量微生物提供了良好的附着载体,微生物又能向外释放植酸酶、磷酸酶等各种酶类。酸性磷酸酶主要来源于植物根系,碱性磷酸酶一般由细菌、真菌产生[32]。这些都为稳定性磷转化成活性磷提供了有利条件。 图3 芦苇根际土壤中磷酸酶活性的季节变化Fig. 3 Seasonal variations of phosphatases activity inPhragmites communisrhizosphere soils 将湿地植物根际土壤磷酸酶活性与各有机磷组分进行相关性分析,分析结果见表2。由表2可知,磷酸酶与大部分有机磷组分有明显相关性,说明磷酸酶与有机磷的矿化转化过程有着密切联系。土壤中的L-OP与ML-OP含量与磷酸单酯酶、磷酸二酯酶活性都呈显著正相关(P<0.05),表明L-OP与ML-OP含量的高低对磷酸酶活性有明显的影响。L-OP与ML-OP在芦苇旺盛生长期含量最低,磷酸单酯酶与磷酸二酯酶活性也在此阶段达到最低值,这与张广娜等[10]的研究结论一致。有学者认为,磷酸酶的活性也可作为衡量土壤有效磷素水平的参考指标[10,33],但也有学者认为土壤酶来源的广泛性以及研究方法的复杂性,养分有效性与土壤酶活性的相关关系还很难建立[34]。磷酸单酯酶、磷酸二酯酶活性与HR-OP含量分别呈极显著(P<0.01)和显著正相关(P<0.05),表明这两种酶一定程度上也能水解转化稳定性高的有机磷组分。 ML-OP、MR-OP含量与L-OP含量均呈显著正相关关系(P<0.05),表明有机磷组分在矿化分解过程中,L-OP为ML-OP、MR-OP转化后的主要有机磷组分。这与有关学者[35–36]得出的结论一致,李继明[36]在试验研究中发现,当土壤处于磷亏缺状态下,ML-OP与MR-OP是土壤有机磷释放有效磷的主要组分,且按照先ML-OP后MR-OP的顺序降解,其中相当一部分MR-OP是经ML-OP再降解为L-OP,L-OP为ML-OP与MR-OP为植物供磷的速效有机磷库。此外,HR-OP含量与 ML-OP含量也呈显著正相关(P<0.05),说明HR-OP矿化过程中可转化为ML-OP。ML-OP与HROP主要成分中均包含植酸盐,植酸盐是金属离子与肌醇六磷酸结合形成的肌醇六磷酸盐,其稳定性与肌醇六磷酸对金属离子的络合能力有关[37],植酸钙、镁等化合物相对于植酸铁、铝等化合物稳定性较差,植酸钙、镁等化合物属于ML-OP,植酸铁、铝等化合物属于HR-OP。在水解过程中,酶对肌醇六磷酸与金属离子的络合能力也产生了影响[38],使稳定高的有机磷组分在此过程中稳定性降低,因此HR-OP在矿化过程中一定程度上可转化为ML-OP。 表2 芦苇根际土壤磷酸酶活性与各有机磷组分的相关性Table 2 Correlations between phosphatase activity and organic P fractions inPhragmites communisrhizosphere soils 1) 芦苇根际土壤各形态有机磷含量分布为L-OP< ML-OP 2) 磷酸单酯酶与磷酸二酯酶活性随芦苇生长先降低后升高,酶活性也在芦苇旺盛生长期达到最低值,分别为0.37 mg/(g·h)和62 μg/(g·h)。凋落物对磷酸酶活性具有明显的促进作用,磷酸酶活性均在植物衰亡期达到峰值。 3) 磷酸单酯酶、磷酸二酯酶活性与L-OP、MLOP、HR-OP含量均有极显著或显著正相关关系,活性磷含量的高低对磷酸酶活性有明显的影响,两种磷酸酶在一定程度上也可水解转化稳定性高的有机磷组分。 [1] Vestergren J E, Vincent A G, Persson P, et al. Improved identification of organic phosphorus species in tropical/ high latitude soils and aquatic ecosystems by advanced liquid and solid state NMR approaches[J]. Biophysical Journal, 2012, 102(3): 389a [2] 郝晓地, 衣兰凯, 王崇臣, 等. 磷回收技术的研发现状及发展趋势[J]. 环境科学学报, 2010, 30(5): 897–907 [3] 孙桂芳, 金继运, 石元亮. 土壤磷素形态及其生物有效性研究进展[J]. 中国土壤与肥料, 2011(2): 1–6 [4] Mcgill W B, Cole C V. Comparative aspects of cycling of organic C, N, S and P through soil organic matter[J]. Geoderma, 1981, 26: 267–286 [5] Scott J T, Condron L M. Dynamics and availability of phosphorus in the rhizosphere of a temperate silvopastoral system[J]. Biology and Fertility of Soils, 2003, 39: 65–73 [6] Fisher R F, Binkley D. Ecology and management of forest soils[M]. 3rd ed. New York: John Wiley & Sons, 2000: 282–284 [7] 李文华, 邵学新, 吴明, 等. 杭州湾潮滩湿地土壤碱性磷酸酶活性分布及其与磷形态的关系[J]. 环境科学学报, 2013, 33(12): 3 341–3 349 [8] 冯固, 杨茂秋. 石灰性土壤上 VA菌根真菌对土壤有机磷矿化的影响及其机理初探[J]. 土壤通报, 1993, 24(4): 184–186 [9] 周驰, 宋春雷, 陈玺,等. 有机磷在调节土壤磷素保持与释放过程中的作用[J]. 土壤, 2013, 45(1): 60–66 [10] 张广娜, 陈振华, 陈利军, 等. 东北地区三种典型土壤磷组分的31P核磁共振研究及其与土壤磷酸酶活性的关系[J]. 土壤通报, 2013, 44(3): 618–623 [11] He Z, Senwo Z N, Mankolo R N, et al. Phosphorus fractions in poultry litter characterized by sequential fraction coupled with phosphatase hydrolysis[J]. Journal of Food Agriculture and Environment, 2006, 4(1): 304–312 [12] 徐德兰, 万蕾, 高明侠, 等. 骆马湖东部沉积物中氮磷含量和碱性磷酸酶活性季节变化[J]. 农业环境科学学报, 2012, 31(7): 1 387–1 392 [13] Ye D H, Li T X, Yu H Y, et al. P accumulation of Polygonumhydropiper, soil P fractions and phosphatase activity as affected by swine manure[J]. Applied Soil Ecology, 2015, 86: 10–18 [14] Huang L D, Zhang Y H, Shi Y M, et al. Comparison of phosphorus fractions and phosphatase activities in coastal wetland soils along vegetation zones of Yancheng National Nature Reserve, China[J]. Estuarine, Coastal and Shelf Science, 2015, 157: 93–98 [15] Zhang A M, Chen Z H, Zhang G N, et al. Soil phosphorus composition determined by31P NMR spectroscopy and relative phosphatase activities influenced by land use[J]. European Journal of Soil Biology, 2012, 52: 73–77 [16] Redersma S, Grisrson P F. Phosphorus mobilization in agroforestry: organic anions, phosphatase activity and phosphorus fractions in the rhizosphere[J]. Plant and Soil, 2004, 259(1): 209–219 [17] Xie C, Tang J, Zhao J, et al. Comparison of phosphorus fractions and alkaline phosphatase activity in sludge, soil, and sediments[J]. Journal of Soils and Sediments, 2011, 11(8): 1 432–1 439 [18] Zhang R, Wu F, Liu C, et al. Characteristic of organic phosphorus fractions in different trophic sediments of lakes from the middle and lower reaches of Yangtze River region and Southwestern P lateau, China[J]. Environmental Pollution, 2008, 152(2): 366–372 [19] Riley D, Barker S A. Bicarbonate accumulation and pH changes at the soybean root-soil interface[J]. Proceedings of Soil Science Society of America, 1969, 33: 905–908 [20] 曲博. 湿地土壤磷酸酶活性对土壤有机磷形态转化的影响研究[D]. 北京: 北京林业大学, 2015 [21] Li M,Zhang J, Wang G Q, et al. Organic phosphorus fractionation in wetland soil profiles by chemical extraction and phosphorus-31 nuclear magnetic resonance spectroscopy[J]. Applied Geochemistry, 2013, 33: 213–221 [22] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 1999: 308–315 [23] 郑加为, 陈法军, 刘满强, 等. 转植酸酶玉米大田种植对根际土壤磷含量及组成的影响[J]. 土壤学报, 2014, 51(5): 1 111–1 119 [24] 赵晶晶, 郭颖, 陈欣, 等. 有机物料对土壤有机磷组分及其矿化进程的影响[J]. 土壤, 2006, 38 (6): 740–744 [25] 孙静, 王圣瑞, 曾清如, 等. 洱海表层沉积物有机磷形态分布特征及其影响因素[J]. 环境科学研究, 2011, 24(11): 1 226–1 232 [26] 王书航, 张博, 姜霞, 等. 采用连续分级提取法研究沉积物中磷的化学形态[J]. 环境科学研究, 2015, 28(9): 1 382–1 388 [27] Criquet S, Braud A. Effects of organic and mineral amendments on available P and phosphatase activities in a degraded Mediterranean soil under short-term incubation experiment [J]. Soil Tillage Research, 2008, 98: 164–174 [28] Turner B L, Haygarth P M. Phosphatase activity in temperate pasture soils: Potential regulation of labile organic phosphorus turnover by phosphodiesterase activity [J]. Science of the Total Environment, 2005, 344(1/2/3): 27–36 [29] Reitzel K, Ahlgren J, DeBarbandere H, et al. Degradation rates of organic phosphorus in lake sediment[J]. Biogeochemistry, 2007, 82: 15–28 [30] Cade-menun B J, Preston C M. A comparison of soil extraction procedures for31P NMR spectroscopy [J]. Soil Science, 1996, 161(11): 770–785 [31] Watts E E, Dean P A W, Martin R R.31P Nuclear magnetic resonance study of sediment microbial phospholipids[J]. Canadian Journal of Analytical Sciences and Spectroscopy, 2002, 47(5): 127–133 [32] Marklein, A R, Houlton, BZ. Nitrogen inputs accelerate phosphorus cycling rates across a wide variety of terrestrial ecosystems[J]. New Phytologist, 2012, 193(3): 696–704 [33] 杨艳菊, 王改兰, 张海鹏, 等. 长期施肥条件下栗褐土碱性磷酸酶活性及其与磷形态的关系[J]. 土壤, 2013, 45(4): 678–682 [34] Allison V J, Condron L M, Peltzer D A, et al. Changes in enzyme activities and soil microbial community composition along carbon and nutrientgradients at the Franz Josef chronosequence, New Zealand[J]. Soil Biological and Biochemistry, 2007, 39(7): 1 770–1 781 [35] 史静, 张誉方, 张乃明, 等. 长期施磷对山原红壤磷库组成及有效性的影响[J]. 土壤学报, 2014, 51(2): 352–359 [36] 李继明. 潮土有机磷级份的动态转化[D]. 武汉: 华中农业大学, 2000 [37] Nolan K B, Duffin P A, Mcweeny D J. Effects of phytate on mineral bioavailability-Invitro studies on Mg2+, Ca2+, Fe3+, Cu2+and Zn2+(also Cd2+) solubilities in the presence of phytate[J]. Journal of the Science of Food and Agriculture, 2006, 40(1): 79–85 [38] 曲博, 李敏, 其美, 等. 外源植酸酶对野鸭湖湿地土壤有机磷转化的影响研究[J]. 生态环境学报, 2015, 24(2): 250–254 Seasonal Variations of Organic Phosphorus Composition and Their Relationship with Phosphatase Activity inPhragmites communisRhizosphere Soil ZHU Yunyun, LI Min*, QU Bo, ZHAO Tun, TENG Zedong Seasonal variations of different organic phosphorus (OP) composition and their relationship with phosphomonoesterase and phosphodiesterase activities inPhragmites communisrhizosphere soil were studied by one-year experiment of Yeyahu wetland. The results showed that the contents of different OP compositions were ranked in the order of labile OP (L-OP)< Moderately labile (ML-OP) Organic phosphorus; Phosphomonoesterase; Phosphodiesterase; Rhizosphere soil;Phragmites communis S154.1 10.13758/j.cnki.tr.2016.06.007 国家自然科学基金项目(51279004)和人事部留学基金委择优资助项目(优秀项目类)资助。 * 通讯作者(liminbjfu@126.com) 朱芸芸(1991—),女,江苏苏州人,硕士研究生,研究方向为生态环境污染机制与修复技术。E-mail: bessie_zyy@bjfu.edu.cn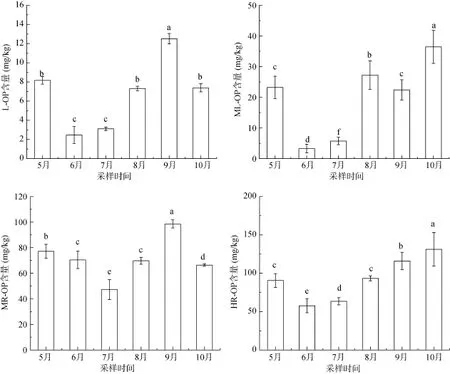
3 结论
(College of Environmental Science and Engineering,Beijing Forestry University,Beijing100083,China)
