油葵与光果甘草间作对根际土壤酶活性及微生物功能多样性的影响①
2016-02-08张旭龙吴振振张志政
张旭龙,马 淼,吴振振,张志政,林 慧
(石河子大学生命科学学院,新疆石河子 832003)
油葵与光果甘草间作对根际土壤酶活性及微生物功能多样性的影响①
张旭龙,马 淼*,吴振振,张志政,林 慧
(石河子大学生命科学学院,新疆石河子 832003)
通过盆栽试验,研究了新葵10号油葵与光果甘草间作对盐碱地根际土壤酶活性和微生物群落功能多样性的影响,以期为盐碱地的改良提供依据。结果表明,与单作模式相比,间作显著提高了根际土壤蔗糖酶、脲酶、磷酸酶和蛋白酶的活性。在 144 h 的温育期内,间作模式下的 AWCD 均高于单作模式,并显著提高了 AWCD 的利用率(72 h,P<0.05)。与单作模式相比,间作显著提高了微生物多样性指数(S、H)。主成分分析表明,间作优化了盐碱土壤微生物群落组成;羧酸类化合物、聚合物、氨基酸和碳水化合物是间作模式下根际土壤微生物利用的主要碳源。因此,新葵 10 号与光果甘草间作显著提高盐碱地根际土壤酶活性和微生物多样性指数,改变了微生物群落功能多样性,对盐碱土壤质量的改良有积极作用。
光果甘草;种植模式;盐碱地;土壤酶;土壤微生物多样性
土壤盐碱化可降低土壤质量,抑制植物正常生长,是制约我国农业发展的主要因素之一。我国盐碱土地面积储量大且增长迅速[1],这一点在新疆地区表现得尤为明显。由于远离海洋的内陆环境和干旱的大陆性气候使新疆成为全国土壤盐碱化大区,新疆盐碱土总面积约为 8.476×106hm2[2],盐碱土种类众多,有世界盐碱土的博物馆之称[3],其中有 80% 的耕地面积属于次生盐碱土地[4],并且还有进一步增大的趋势,严重制约着新疆地区农业经济的发展和生态环境的改善。
盐碱地的改良效果可以用土壤质量来表示,而植物种植模式是影响土壤质量的关键因素之一,植物之间合理的时空搭配能有效改善土壤质量[5]。合理的间作能显著提高植物的光合作用[6]、抑制杂草滋生和虫害[7–8],改善土壤微生态环境[9–10],与单作相比,间作可获得更高的产量和经济效益[11]。光果甘草(Glycyrrhiza glabraL.)和油葵 (Helianthus annuusL.)是我国重要的盐生经济植物,对盐碱土壤有很强的耐性[12–18]。一年生栽培甘草的冠幅与根系规模均较小,密度较低,甘草地中留有大量的空余生态位,这为与其他作物的套种间作提供了可能。光果甘草与油葵间作对盐碱地土壤质量改良有一定的积极作用,但光果甘草与油葵间作模式下的改良机理目前却未见报道。因此,本文从土壤酶活性和土壤微生物群落功能多样性等方面,探讨了油葵(新葵 10 号)和光果甘草间作对盐碱地土壤质量的改善效果,以期为土壤质量的改良、生态系统的恢复与重建以及区域经济的发展提供科学依据。
1 材料与方法
1.1 供试种子
光果甘草种子采自新疆巴楚县,新葵10号油葵的种子由新疆农垦科学院作物所提供。
1.2 试验设计
供试土壤采自石河子市周边盐碱土。土壤类型为轻度盐碱沙壤土(pH 7.88,全氮 0.73 g/kg,碱解氮51.45 mg/kg,速效钾 213.26 mg/kg,速效磷 23.58 mg/kg)。栽培试验在长宽高分别为 35 cm × 25 cm × 15 cm 白色塑料盆中进行,土壤厚度约为 12 cm,充分浇水,隔夜备用。新葵 10 号的种子用温水浸泡过夜,光果甘草的种子用 18.4 mol/L 的浓硫酸腐蚀 30 min(打破由种皮抑制而引起的种子休眠),然后用蒸馏水冲洗 2 h。间作处理:在塑料盆正中间,并排种植甘草2 行,行距 8 cm,穴距 2 cm,在甘草行的两边各种植一行油葵,甘草行与油葵行相距 10 cm,油葵穴距15 cm。单作处理:油葵单作行距 28 cm,穴距 15 cm (每盆种 4 棵);甘草单作行距 8 cm,穴距 2 cm,每盆种 3 行,并且每穴点播种子 3 颗,设置 6 个重复。将其置于温度为 25℃、光强为 450 μmol/(m2·s)、光照时间为 12 h/d 的光照培养箱 (GXZ-430D) 中培养。出苗后定苗,每穴留苗 1 颗,每 3 天等量浇水一次,培养 80 多天至油葵开花时取根际土样。将去除残余根系和杂质后的相同处理不同重复的土壤样品混和均匀并过 1 mm 筛,然后均分为两份,置于 4 ℃ 冰箱中保存待用,其中一份风干用于测定土壤酶活性,另一份未风干土样用于测定微生物多样性。
1.3 土壤微生物酶活性分析
土壤蔗糖酶、脲酶、磷酸酶和蛋白酶活性的测定方法参照关松荫[19]的《土壤酶及其研究法》。蔗糖酶活性采用3,5-二硝基水杨酸比色法测定,以24 h后1 g土壤中含有的葡萄糖毫克(mg)数表示;脲酶活性采用苯酚钠–次氯酸钠比色法测定,以24 h 后1 g土壤中NH3-N的毫克(mg)数表示;磷酸酶采用磷酸苯二钠比色法测定,以24 h后1 g土壤中释放出的酚的毫克(mg)数表示;蛋白酶活性用茚三酮比色法测定,以24 h后1 g土壤中氨基氮的毫克(mg)数表示。
1.4 土壤微生物功能多样性分析
微生物群落功能多样性采用 Biolog (Biolog-Eco PlateTM) 技术进行分析。称取相当于 10 g烘干土的鲜土加入已装有100 ml灭菌的0.05 mol/L的磷酸盐缓冲液(PBS)的三角瓶中,室温震荡60 min,然后用PBS缓冲液稀释至1 000倍液,再震荡30 min,吸取稀释液接种到生态板(Eco-plate)中,每孔加样150 μl。将接种好的微平板置于 25 ℃ 的恒温培养箱中避光培养,每隔12 h在Biolog EmaxTM读数器上读取波长590 nm下的光密度值,持续144 h。用31个孔的平均颜色变化率(AWCD)表示微生物代谢的整体活性。计算Shannon物种丰富度指数(H)和碳源利用丰富度指数(S),具体计算公式如下[20–22]:

式中:Ci为每个孔的光密度值;Ri为对照孔的光密度值;n= 31,为 ECO 板的孔数。
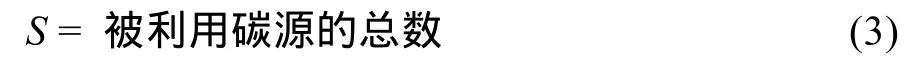
1.5 数据处理
采用 SPSS 16.0 软件对试验数据进行单因素方差分析、主成分分析和相关性分析。
2 结果与分析
2.1 间作对土壤酶活性的影响
如表 1 所示,与单作新葵10号和单作光果甘草相比,间作新葵10号和间作光果甘草均能不同程度地提高根际土壤蔗糖酶、脲酶、磷酸酶和蛋白酶的活性,而间作新葵10号对根际土壤蔗糖酶和磷酸酶的活性影响较大,间作光果甘草对根际土壤脲酶和蛋白酶的活性影响较大。间作新葵10号和间作光果甘草能显著提高根际土壤蔗糖酶的活性和蛋白酶的活性,单作新葵10号和单作光果甘草间蔗糖酶活性差异不显著,而蛋白酶活性差异显著。间作新葵10号和间作光果甘草间根际土壤脲酶活性差异不显著,并且与单作相比,间作新葵10号也没有显著提高根际土壤脲酶的活性。对根际土壤磷酸酶而言,间作新葵10号和光果甘草均显著高了磷酸酶的活性。

表1 不同种植模式下的土壤酶活性Table 1 Soil enzyme activities of different planting pattern
2.2 间作对平均颜色变化率(AWCD)的影响
31种碳源的AWCD变化如图1所示,在0 ~ 12 h内,间作和单作的AWCD值为零,在12 h之后,均开始利用碳源进行代谢。在整个温育期内,间作的AWCD均高于单作,且AWCD表现出如下规律:间作光果甘草>间作新葵 10号>单作光果甘草>单作新葵10号。在温育72 h时, 与单作相比,间作均显著提高了微生物的代谢活性(P<0.05)。
2.3 间作对根际微生物多样性指数的影响
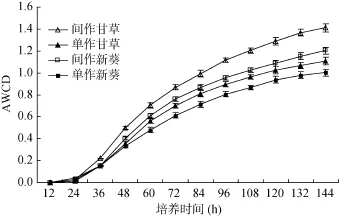
图1 根际微生物AWCD随温育时间的变化Fig. 1 AWCD changes with incubation time of different treatments
Shannon多样性指数可以从不同侧面反映土壤微生物群落功能多样性,是目前应用最广泛的群落多样性指数之一[23–24],通常把颜色变化孔数作为根际微生物群落功能多样性的丰富度[25]。图 2所示,间作新葵10号和间作光果甘草的根际微生物的S和H均显著高于单作。与单作新葵10号相比,间作新葵10号使H提高了8.77%;与单作光果甘草相比,间作光果甘草使H提高了9.66%。
2.4 根际微生物对碳源代谢的主成分分析
对培养 72 h 的 31 种碳源利用情况进行主成分分析,共提取 2 个主成分,第一主成分(PC1)和第二主成分(PC2),分别可以解释所有变量的 47.81%和 32.64%,两个主成分累积方差贡献率达到 80.45%,可较全面地概括 31 个变量的特征。间作光果甘草在PC1 上的得分最高,为 5.02,单作新葵 10 号在 PC2上的得分为 –4.41。

图2 微生物碳源利用多样性指数Fig. 2 Diversity indices of microbial carbon source utilization
因子载荷反映了主成分与碳源利用的相关程度,因子载荷绝对值越接近于 1,表示该碳源对主成分的影响越大。表 2 显示,与 PC1 相关性较高的碳源有 20 个,主要包括碳水化合物(7 个)、羧酸类化合物(5 个)、聚合物(3 个)、氨基酸(3 个)、胺类化合物(1 个)、酚酸类化合物(1 个);与 PC2 相关性较高的碳源有 11 个,主要包括碳水化合物(4 个)、羧酸类化合物(3 个)、氨基酸(2 个)、胺类化合物(1 个)、酚酸类化合物(1 个)、聚合物(1 个)。其中,羧酸类化合物、聚合物、氨基酸和碳水化合物是根际土壤微生物利用的主要碳源。
2.5 微生物学指标与根际土壤酶活性的相关性
为了探讨土壤微生物学特征与土壤微环境各酶活间的关系,对这两方面的特征指标进行相关性分析。结果表明(表3),H对土壤酶活性和PC1得分有很强的影响效应,与4个根际土壤酶活性和PC1得分呈显著正相关关系,其中与土壤蔗糖酶和脲酶的活性有极显著正相关关系。S与AWCD有显著正相关关系。AWCD与蛋白酶活性和PC1得分有显著正相关关系。根际土壤蔗糖酶活性与脲酶、磷酸酶和蛋白酶的活性均有显著正相关关系,其中根际土壤蔗糖酶活性与脲酶和磷酸酶活性的相关性达极显著水平,其相关系数分别为0.749和0.910。根际土壤脲酶的活性与蛋白酶活性和PC1得分的相关系数分别为0.888和0.825,达极显著水平。根际土壤蛋白酶活性与PC1得分的相关系数为0.977,相关性达极显著水平。所有指标与PC2得分均没有显著相关关系。
3 讨论
土壤酶来源于微生物、动物和植物的活体或残体[26],是土壤环境的重要组成部分,催化土壤中的一切生物化学反应;并且土壤酶活性体现着土壤总生物学活性,在土壤养分循环中起着重要作用,已被用作土壤微生物的活性指标[27–28]和土壤肥力指标[19]。土壤蔗糖酶、磷酸酶、脲酶和蛋白酶分别反映土壤中碳、磷和氮素水平状况,对植物的生长有至关重要的作用[29–32]。较高的酶活性水平,能在一定程度上保证作物在土壤肥力贫瘠的土地上生长良好。本研究中,与单作相比,新葵10号与光果甘草间作能显著提高根际土壤蔗糖酶、磷酸酶、脲酶和蛋白酶的活性,这与刘均霞等[33]研究大豆与玉米间作和代会会等[34]研究番茄与豆科间作所得结果一致,其原因可能是新葵10号与光果甘草间作使得根系分泌物增加。其中,间作光果甘草对脲酶和蛋白酶的活性影响最大,其原因可能是豆科植物光果甘草根瘤菌的固氮作用使土壤微环境中氮水平提高。
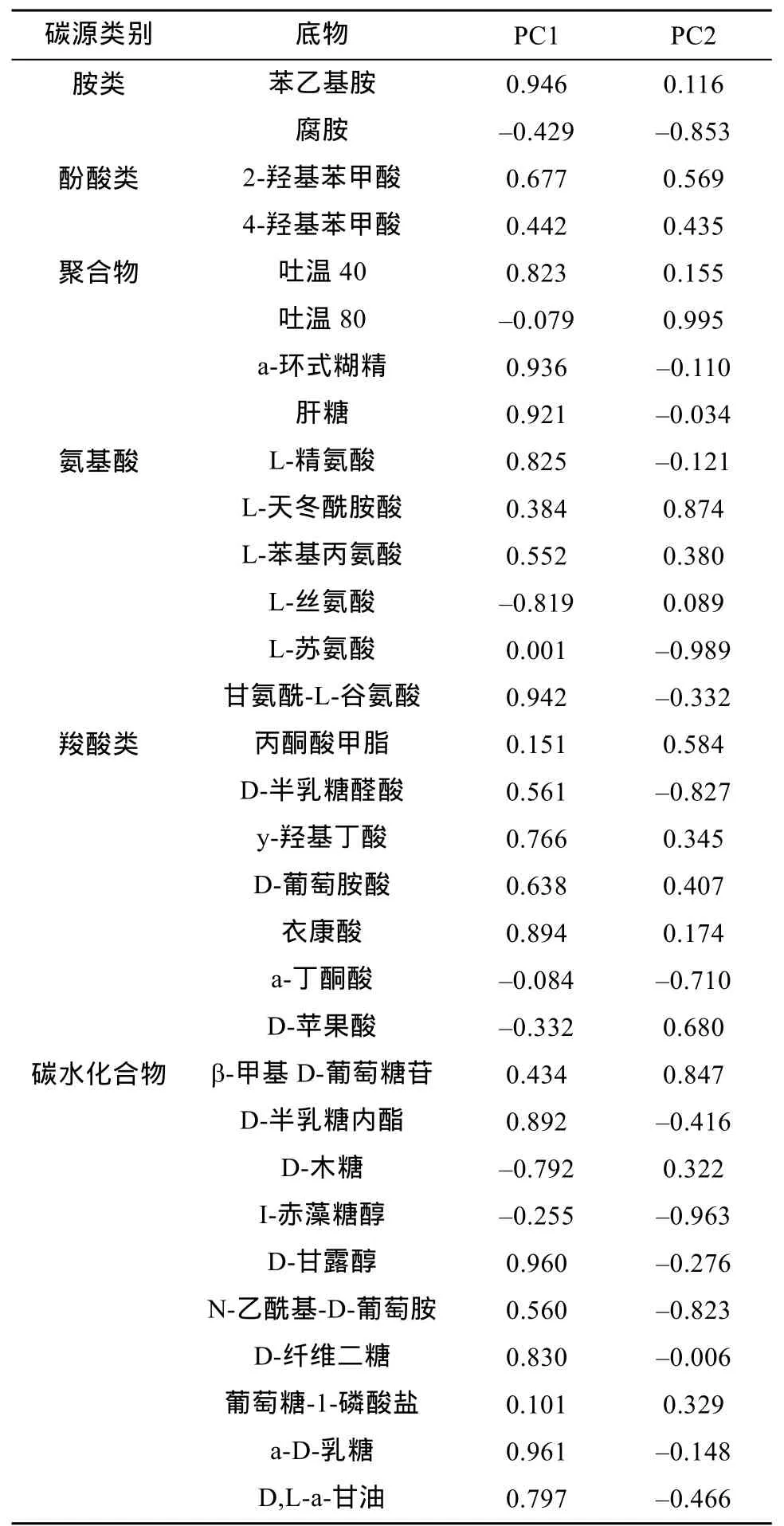
表2 31 种碳源的因子载荷Table 2 Factor loading of 31 carbon sources
光密度平均颜色变化率AWCD反映土壤微生物利用总碳源的能力和代谢活性的大小,AWCD越大,其代谢活性越强[35–36]。本研究中,在0 ~ 24 h时微生物处于适应期阶段,基本上没有利用31种碳源进行代谢;24 h之后,微生物逐渐进入对数增长期,在132 h后基本进入稳定期,这与一般微生物培养的生长规律相同[37]。在整个温育期内,间作的AWCD都高于单作,即间作新葵10号>单作新葵10号,间作光果甘草>单作光果甘草。并且,第72 h时,间作的AWCD显著高于单作(P<0.05),这说明间作后的土壤微生物对碳源的利用率较高,这与董艳等[38]研究蚕豆小麦间作所得结果一致。其原因可能是两种植物间作其根系分泌物的种类和数量较单作有所增加,根际微生物以这些分泌物为能源而生长和繁殖从而导致根际微生物群落结构发生变化。
间作新葵10号和间作光果甘草的土壤微生物多样性指数分别显著高于单作新葵10号和单作光果甘草,表明间作使土壤微生物群落多样性增加。在新葵10号间作光果甘草的种植模式下,根瘤菌通过固氮作用可为光果甘草的生长提供一定量的氮素营养,而在土壤养分贫瘠的地区,适当提高的氮素能改善土壤养分并调节微生物的营养代谢平衡,促进土壤微生物群落的稳定[39]。相关性分析表明,AWCD、H和S与根际土壤酶活性有密切的关系。其中H与蔗糖酶、脲酶、磷酸酶和蛋白酶活性均有显著正相关关系。
主成分分析表明新葵10号与光果甘草间作,对盐碱地土壤微生物的碳源利用能力影响显著,使盐碱地土壤微生物群落代谢特征发生改变。间作光果甘草和单作光果甘草在 PC1上有较大分异,间作光果甘草分布在PC1的正方向,得分最高为5.02,单作光果甘草分布在PC1的负方向,得分为–3.12;间作新葵10号分布在PC2的正方向,得分为2.17,单作新葵10号分布在PC2的负方向,得分为–4.41,分异较大,表明新葵10号与光果甘草间作改变了其根际微生物群落功能多样性,而这种改变是由根际微生物对

表3 土壤微生物学指标与根际酶活性的相关性分析 (Pearson相关系数)Table 3 Correlationship between soil microbial indices and soil enzyme activities in rhizosphere soil
PC1和PC2上相关系数较高的碳源利用差异引起的。地上植物多样性与土壤微生物多样性密切相关,间作即增加了地上部生物的多样性,而植物残留物和根系分泌物,间接地增加了地下部土壤酶活和微生物群落功能多样性,对土壤质量的改善具有重要意义[40–42]。在盐碱环境中新葵10号与光果甘草间作显著提高了根际土壤蔗糖酶、磷酸酶、脲酶和蛋白酶的活性,对AWCD和土壤微生物多样性指数都有显著提高作用,改善土壤微生物功能,优化微生物群落结构。因此,在盐碱土壤环境中,新葵10号和光果甘草间作是提高土壤肥力、优化土壤微生物群落功能多样性、改良盐碱土壤的重要措施。
[1] 杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 70–78
[2] 新疆维吾尔自治区农业厅. 新疆土壤[M]. 北京: 科学出版社, 1996: 304–336
[3] 文振旺, 石玉麟, 黄荣金. 新疆土壤地理[M]. 北京: 科学出版社, 1965: 93–104
[4] 田长彦, 周宏飞, 刘国庆. 21世纪新疆土壤盐渍化调控与农业持续发展研究建议[J]. 干旱区地理, 2000, 23(4): 177–178
[5] 李鑫, 张会慧, 岳冰冰, 等. 桑树–大豆间作对盐碱土碳代谢微生物多样性的影响[J]. 应用生态学报, 2012, 23(7): 1 825–1 831
[6] 刘景辉, 曾昭海, 焦立新, 等. 不同青贮玉米品种与紫花苜蓿的间作效应[J]. 作物学报, 2006, 32(1): 129–134
[7] 李潮海, 苏新宏, 孙敦立. 不同基因型玉米间作复合群体生态生理效应[J]. 生态学报, 2002, 22(12): 2 096–2 103
[8] Gaynor J D, Tan C S, Drury C F, et al. Tillage, intercrop, and controlled drainage-subirrigation Influence atrazine, metribuzin, and metolachlor loss[J]. Journal of Environmental Quality, 2001, 30(2): 561–572
[9] 朱丽霞, 章家恩, 刘文高. 根系分泌物与根际微生物相互作用研究综述[J]. 生态环境, 2003, 12(1): 102–105
[10] Suman A, Lal M H, Singh A K, et al. Microbial biomass turnover in Indian subtropical soils under different sugarcane intercropping systems[J]. Agronomy Journal, 2006, 98(3): 698–704
[11] 陈阜, 逄焕成. 冬小麦/春玉米/夏玉米间套作复合群体的高产机理探讨[J]. 中国农业大学学报, 2000, 5(5): 12–16
[12] 杜社妮, 白岗栓, 于健, 等. 沙封覆膜种植孔促进盐碱地油葵生长[J]. 农业工程学报, 2014, 30(5): 82–90
[13] 王鹏, 马玲玲, 陈雨, 等. 盐胁迫对油葵种子萌发及内源激素含量的影响[J]. 北方园艺, 2015(3): 12–15
[14] 石必显, 雷中华, 向理军. 利用盆栽试验对4个油葵品种的耐盐性鉴定[J]. 新疆农业科学, 2010, 47(3): 523–526
[15] 王蓉, 何文寿, 马玉波, 等. 氮素用量对油葵氮磷钾养分吸收积累及产量的影响[J]. 中国油料作物学报, 2014(4): 494–501
[16] 吴琼, 韩亚楠, 高睿, 等. 中生与盐生乌拉甘草种群种子萌发阶段耐盐性能的比较[J]. 种子, 2014, 33(11): 31–35
[17] 陆嘉惠, 吕新, 吴玲, 等. 三种药用甘草种子对盐渍环境的萌发响应及其适宜生态种植区[J]. 草业学报, 2013, 22(2): 195–202
[18] 卢精林, 高彦娟, 常玉娇. 外源 VC对盐胁迫下油葵种子萌发和幼苗生理特性的影响[J]. 安徽农业科学, 2014, 42(30): 10 503–10 505
[19] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 274–312
[20] Zhang N L, Wan S Q, Li L H, et al. Impacts of urea N addition on soil microbial community in a semi-arid temperate steppe in Northern China[J]. Plant and Soil, 2008, 311(1): 19–28
[21] Zak J C, Willig M R, Moorhead D L, et al. Functional diversity of microbial communities: A quantitative approach[J]. Soil Biology and Biochemistry, 1994, 26(9): 1 101–1 108
[22] Shannon C E, Weaver W. The mathematical theory of communication[M]. Illinois: University of Illinois Press, 2015
[23] Larkin R P. Characterization of soil microbial communities under different potato cropping systems by microbial population dynamics, substrate utilization, and fatty acid profiles[J]. Soil Biology and Biochemistry, 2003, 35(11): 1 451–1 466
[24] 田春杰, 陈家宽, 钟扬. 微生物系统发育多样性及其保护生物学意义[J]. 应用生态学报, 2003, 14(4): 609–612
[25] Choi K H, Dobbs F C. Comparison of two kinds of biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203–213
[26] 姜莉, 陈源泉, 隋鹏, 等. 不同间作形式对玉米根际土壤酶活性的影响[J]. 中国农学通报, 2010, 26(9): 326–330 [27] 刘占锋, 傅伯杰, 刘国华, 等. 土壤质量与土壤质量指标及其评价[J]. 生态学报, 2006, 26(1): 901–913
[28] 唐玉姝, 魏朝富, 颜廷梅, 等. 土壤质量生物学指标研究进展[J]. 土壤, 2007, 39(2): 157–163
[29] Alkorta I, Aizpurua A, Riga P, et al. Soil enzyme activities as biological indicators of soil health[J]. Reviews on Environmental Health, 2003, 18(1): 65–73
[30] 李志萍, 吴福忠, 杨万勤, 等. 川西亚高山森林林窗不同时期土壤转化酶和脲酶活性的特征[J]. 生态学报, 2015, 35(12): 3 919–3 925
[31] 和文祥, 朱铭莪. 陕西土壤脲酶活性与土壤肥力关系分析[J]. 土壤学报, 1997, 34(4): 392–398
[32] 王栋, 李辉信, 胡锋. 不同耕作方式下覆草旱作稻田土壤肥力特征[J]. 土壤学报, 2011, 38(6): 1 203–1 209
[33] 刘均霞, 陆引罡, 远红伟, 等. 玉米、大豆间作对根际土壤微生物数量和酶活性的影响[J]. 贵州农业科学, 2007, 35(2): 60–64
[34] 代会会, 胡雪峰, 曹明阳, 等. 豆科间作对番茄产量、土壤养分及酶活性的影响[J]. 土壤学报, 2015, 52(4): 911–918
[35] Garland J. Analysis and interpretation of community-level physiological profiles in microbial ecology[J]. FEMS Microbiology Ecology, 1997, 24(4): 289–300
[36] Konopka A, Oliver L, Turco Jr R F. The use of carbon substrate utilization patterns in environmental and ecological microbiology[J]. Microbial Ecology, 1998, 35(2): 15–103
[37] 沈萍, 陈向东. 微生物学[M]. 2版. 北京: 高等教育出版社, 2006: 134–136
[38] 董艳, 董坤, 汤利, 等. 小麦蚕豆间作对蚕豆根际微生物群落功能多样性的影响及其与蚕豆枯萎病发生的关系[J]. 生态学报, 2013, 33(23): 7 445–7 454
[39] 董艳, 汤利, 郑毅, 等. 施氮对间作蚕豆根际微生物区系和枯萎病发生的影响[J]. 生态学报, 2010, 30(7): 1 797–1 805
[40] Song Y N, Zhang F S, Marschner P, et al. Effect of intercropping on crop yield and chemical and microbiological properties in rhizosphere of wheat (Triticum aestivumL.), maize (Zea maysL.), and faba bean (Vicia fabaL.)[J]. Biology and Fertility of Soils, 2007, 43(5): 565–574
[41] Wardle D A, Bardgett R D, Klironomos J N, et al. Ecological linkages between aboveground and belowground biota[J]. Science, 2004, 304(5667): 1 629–1 633
[42] Salles J F, Van Veen J A, van Elsas J D. Multivariate analyses ofBurkholderiaspecies in soil: Effect of crop and land use history[J]. Applied and Environmental Microbiology, 2004, 70(7): 4 012–4 020
Effects ofHelianthus annuusandGlycyrrhiza glabraIntercropping on Rhizosphere Soil Enzyme Activities and Soil Microbes Functional Diversity
ZHANG Xulong, MA Miao*, WU Zhenzhen, ZHANG Zhizheng, LIN Hui
(College of Life Science,Shihezi University,Shihezi,Xinjiang832003,China)
In order to provide a scientific basis for amelioration of saline-alkali soils, the pot experiment was conducted to study the effects of intercropping ofHelianthus annuus(Xinkui 10) andGlycyrrhiza glabraon enzyme activities and microbial diversity of saline-alkali rhizosphere soil. The results showed that, compared with the monoculture, intercropping of Xinkui 10 withGlycyrrhiza glabrasignificantly increased the activities of rhizosphere soil invertase, urease, phosphatase and protease. In 144 h incubation period, the AWCD of the intercropping treatment was higher than that of monoculture. The intercropping also significantly improved the utilization of AWCD (72h,P<0.05). Compared with monoculture, the intercropping significantly increased the microbial diversity indexes (S,H). Principal component analysis showed that the intercropping of Xinkui 10 withGlycyrrhiza glabracould optimize the microbial community composition of saline-alkali soils. The carbon sources mostly used by saline-alkali soil microbes were carboxylic acids, polymers, amino acids and carbohydrates. Therefore, the intercropping of Xinkui10 withGlycyrrhiza glabrahas a positive effect on soil saline-alkali quality, because it significantly enhanced the related enzyme activities and soil microbial utilization degrees of carbon source, and changed the microbial diversities.
Glycyrrhiza glabra; Cropping pattern; Saline-alkali soil; Soil enzyme activity; Soil microbial diversity
Q949.9
10.13758/j.cnki.tr.2016.06.008
国家自然科学基金项目(31360047)和石河子大学重大科技攻关项目(gxjs2012-zdgg06-04)资助。
* 通讯作者(mamiaogg@126.com)
张旭龙(1988—),男,甘肃西和人,硕士研究生,研究方向为资源植物学。E-mail: zxl52807@163.com
