不同铵钾比对高铵下拟南芥地上部和根系生长的影响①
2016-02-08宋海燕李光杰施卫明
宋海燕,李光杰,施卫明*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
不同铵钾比对高铵下拟南芥地上部和根系生长的影响①
宋海燕1,2,李光杰1,施卫明1*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
钾在缓解植物铵毒害的过程中起着重要的作用。本文研究了高铵(30 mmol/L)条件下,不同铵钾比(7.5︰1和150︰1)对拟南芥(Col-0)主根、侧根以及地上部生长的影响。结果表明:30 mmol/L NH条件下,高铵钾比(150)处理显著加重了拟南芥铵毒害现象,地上部和根系生长所受的抑制作用更为明显并导致更严重的氧化胁迫。相比低铵钾比水平,在高铵处理下,高铵钾比使得拟南芥主根伸长量降低57.4%,侧根数量减少33.3%,而地上部鲜重减轻69.9%。DAB(3,3¢-二氨基联苯胺,3,3¢-diaminobenzidine)叶片染色结果表明,不加铵处理下,外源不同钾水平(0.2 和4.0 mmol/L)对拟南芥叶片的氧化胁迫作用没有显著差异;而高铵处理下,相比低铵钾比处理,高铵钾比显著增加了叶片中过氧化氢的含量,加重了其氧化胁迫。伊文思蓝(Evans blue, EB)染色结果表明,不加铵处理下,外源不同钾水平对拟南芥地上部和根部的膜透性没有显著差异,而高铵处理下,高铵钾比显著增强了拟南芥地上部和根部的膜透性,表明其对细胞的伤害程度加重。可见,高铵抑制拟南芥根系和地上部生长,高铵钾比则会加重这种抑制,其原因除了高浓度钾能减少植物对铵的吸收外,可能与高铵钾比条件加剧了植物的氧化胁迫有关。因此,适宜的铵钾比在植物应对铵毒害的过程中发挥重要作用。
拟南芥;铵毒害;铵钾比;氧化胁迫
同时,铵对植物生长的影响也受到土壤其他养分,尤其是供钾水平的强烈影响[10]。我国土壤普遍缺钾[11],其中水稻种植区域土壤缺钾的情况较为严重[12],中国南方超过70% 的地区普遍缺钾,在这些缺钾地区,铵对植物生长的抑制作用愈发显著;而补施钾肥有助于缓解铵对植物生长的不利影响[13]。例如,Cao等[14]报道在不供钾情况下,3 ~ 12 mmol/L的铵处理显著抑制了拟南芥幼苗根生长,而加入适量的钾盐可明显缓解该抑制效应。Xu等[15]的研究表明在2 mmol/L供铵环境中,加入2 mmol/L钾离子不仅可以避免铵对玉米的伤害,而且可促进玉米根生长,提高地上部的氮同化。这些研究都说明了低钾环境会加重铵毒害现象,而外源补充钾离子、维持环境中较高的钾铵比会显著缓解铵毒害[16–18]。进一步研究表明,高铵对植物生长的影响与外界铵钾比有密切的关系,当外界环境中铵钾比在4 ~ 8时,植物的生长比较良好[19]。但对水稻这类耐铵植物而言,只有当外界钾浓度低于0.1 mmol/L,铵钾比超过400时,才会产生铵的毒害[20]。由此可见,不同植物种类对环境中铵钾比的需求是不同的。
总之,高铵供应显著抑制植物生长,而外源补充钾肥能部分缓解铵的毒害效应。但是,有关不同供钾水平如何影响高铵对植物生长的抑制效应,尚有待进一步研究;对植物如何响应不同铵钾比供应更缺少深入的研究。因此,本研究以野生型拟南芥Col-0为材料,研究了不同供钾水平下,高铵对其根系、地上部和氧化胁迫的影响,以期了解铵钾互作在这些过程中的作用,探索植物响应不同铵钾比供应的可能机制。
1 材料与方法
1.1 试验材料与试验设计
植物材料为野生型拟南芥(Arabidopsis thalianaL.)Columbia-0生态型(Col-0)。先用乙醇、NaClO、十二烷基硫酸钠(sodium dodecyl sulfate, SDS)和超纯水对种子进行消毒灭菌[21],然后置于 0.1% 的琼脂溶液中,使种子悬浮,置于4℃的冰箱避光保存2 天。将春化好的种子用移液枪播种于正常萌发培养基(13 cm× 13 cm)上,培养基[22–23]成分为:2 mmol/L KH2PO4、5 mmol/LNaNO3、2 mmol/L MgSO4、1 mmol/L CaCl2、0.1 mmol/L Fe-EDTA、50 μmol/L H3BO3、12 μmol/L MnSO4、1 μmol/L ZnCl2、1 μmol/L CuSO4、0.2 μmol/L Na2MoO4、0.5 g/L 2-(N-吗啉)乙磺酸(2-(N-Morpholino) ethanesulfonic acid, MES)、1% (w/v)蔗糖、0.8% (w/v)琼脂粉(用5 mol/L NaOH调至pH 5.7)。其中添加的MES可以使培养基pH得到缓冲,防止培养基pH在植物生长过程中发生大幅度变化。培养板用Parafilm膜封口后垂直置于光照培养室中,使根沿培养基表面垂直向下生长。培养室光周期为16 h/8 h,温度(23±1) ℃,光照强度为 100 μmol/(m2×s)。高铵处理(30 mmol/L NH)则是在上述培养基中添加15 mmol/L (NH4)2SO4。K+的供应设置为 0.2和 4.0 mmol/L(用 0.2 mol/L K2SO4配制)两个浓度,以形成高铵钾比(150︰1)、低铵钾比(7.5︰1)处理。相应地,原萌发培养基中的KH2PO4则用NaH2PO4代替,浓度仍为2 mmol/L。种子萌发5天后(根长大约为1.5 ~ 2 cm),选取长势一致的苗,移到处理培养基上,处理指定时间后,统计结果。各处理试验设置3次重复。本实验用以模拟铵毒害的浓度设置,主要借鉴了实验室前期的研究报道,在培养体系下,30 mmol/L NH可使供试材料发生明显的铵中毒现象[22]。
1.2 测定项目与方法
1.2.1 主根伸长量 移苗之后,在根尖位置做好标记(用记号笔点一个黑点),4 天之后,用直尺测定主根伸长量。本文提及的主根伸长量是指移至处理板后主根新增的长度。
1.2.2 侧根数量 取长势一致的 5 天的苗,不同处理4 天之后,将地下部剪下,用GUS(β-葡萄糖苷酸酶,β-glucuronidase)染色法进行染色。GUS 的组织染色法直接参考“Arabidopsis : A laboratory manual”的操作程序[24]:标记好灭菌的离心管,然后在1.5 cm灭菌的离心管中放入1 ml无菌水,将不同处理的拟南芥根依次剪下放入管中,在无菌水中清洗,用移液枪小心地将无菌水吸出,分别加入合适体积的GUS染色液和X-Gluc(5-溴-4-氯-3-吲哚-β-D-葡萄糖苷酸,5-Bromo-4-chloro-3-indolyl-beta-D-glucuronide cyclohexylammonium salt hydrate),混合均匀之后,在37℃的培养箱中避光处理16 h以上直至材料明显着色,而后吸出GUS染色液,将染好的材料依次置于20%、35%、50%、75%、90% 的乙醇里,室温下每一级乙醇浓度放置30 min左右,最后保存在75%的乙醇里。根部GUS染色用Olympus BX51带DIC效果的显微镜观察,并通过Olympus DP71拍照系统拍摄记录。
1.2.3 地上部生物量 取长势一致的苗(5天),在处理培养基上生长 5 天之后,用万分之一的电子天平称量不同处理每株植物地上部的重量并记录。
1.2.4 EB染色 取长势一致的5 天的苗,不同处理 5 天之后,地上部、根部分别取样,用伊文思蓝染色法[25]进行染色。首先将地上部、根部放于0.25% (w/v)的Evans blue溶液中,在室温下染色15 min,然后用蒸馏水洗3次,每次10 min,分别将地上部和根部浸泡在N,N-二甲基甲酰胺中1 h,最后在600 nm处测定光密度(optical density,OD)值,最终以OD600值与鲜重(g)的比值作为衡量指标。
1.2.5 DAB染色 H2O2的组织化学染色按Li等[23]的方法进行。简述如下:叶片沉浸在 0.1 mg/ml 的DAB(溶解于50 mmol/L Tris-醋酸中,pH为5.0)。样品在黑暗中室温染色24 h,随后用80% 的乙醇70℃脱色10 min,之后保存于75% 的乙醇中待用。DAB在根中的染色用Olympus BX51带DIC效果的显微镜观察,并通过Olympus DP71拍照系统拍摄记录。
1.2.6 数据处理 应用Excel 2003进行数据处理,数据的统计分析采用SPSS 20.0,以P<0.05为差异显著。图表使用 OriginPro 8.0生成并由 Photoshop排版。
2 结果与分析
2.1 不同浓度钾对高铵下拟南芥野生型主根伸长量的影响

图1 不同NH和K+处理下主根伸长量的变化Fig. 1 The changes of root elongation under different NHand K+treatments
2.2 不同浓度钾对高铵下拟南芥野生型侧根数量及阶段分布的影响
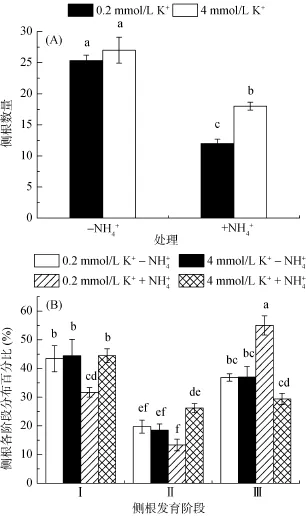
图2 不同NH和K+处理下侧根数量及阶段分布变化Fig. 2 The changes of lateral root number and stage distribution under different concentrations of NHand K+treatments
2.3 不同浓度钾对高铵下拟南芥野生型地上部鲜重的影响
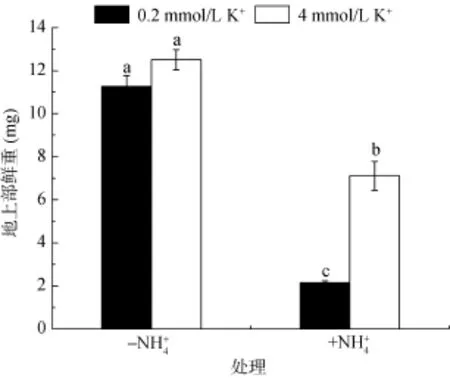
图3 不同NH和K+处理下地上部鲜重变化Fig. 3 The fresh weight changes of shoot under different concentrations of NHand K+treatments
2.4 不同浓度钾对高铵下拟南芥野生型细胞死亡程度的影响
利用EB染色法研究了不同浓度K+对高铵下拟南芥细胞死亡程度的影响。图4A表明,不加NH时,不同浓度(0.2和4.0 mmol/L)K+处理对拟南芥地上部的OD600值影响较小且无显著差异。高浓度(30 mmol/L) NH显著提高了拟南芥地上部EB染色的OD600值,且高铵钾比处理时更为明显。低铵钾比处理,其OD600值为14.4,而高铵钾比处理下,其地上部EB染色的OD600值达到 27.9,两者分别为不加 NH处理时的1.7倍和2.9倍,可见,高铵钾比处理增加更为明显。图4B显示不同浓度(0.2和4.0 mmol/L)K+处理对高铵下拟南芥根部EB染色的OD600值的影响。结果表明,不加NH时,不同浓度(0.2和4.0 mmol/L)K+处理对拟南芥根部EB染色的OD600值影响较小且无显著差异,高浓度(30 mmol/L) NH明显提高了拟南芥根部EB染色的OD600值,且高铵钾比处理时更为明显。低铵钾比处理时,其OD600值为47.3,而高铵钾比处理时,其根部EB染色的OD600值达到 66.2,两者分别为不加 NH处理时的 2.0倍和2.8倍。由此说明,在高NH条件下,高铵钾比处理对拟南芥地上部和根部细胞的伤害更大,细胞透性大大增加,细胞死亡程度升高。同时可以看到,同一处理下,根部OD600值显著高于地上部,说明根部受胁迫程度更高。

图4 不同NH和K+处理下地上部(A)和根部(B)EB染色情况Fig. 4 The EB staining of shoot (A) and root (B) under different concentrations of NHand K+treatments
2.5 不同浓度钾对高铵下拟南芥野生型 H2O2含量的影响
为了探究叶部活性氧(reactive oxygen species, ROS)在不同NH和K+处理下的变化,本研究利用DAB染色法对叶部H2O2进行了原位组织化学染色。图5显示了不同NH和K+处理下叶片DAB染色情况。结果表明,不添加 NH条件下,外源提供不同浓度(0.2和4.0 mmol/L)K+处理,拟南芥叶片几乎没有DAB染色,表明此时两者叶片都只有较低的H2O2水平。而高浓度(30 mmol/L) NH条件下,高铵钾比处理的拟南芥叶片染色程度显著深于低铵钾比处理,表明高 NH下,高铵钾比处理显著增加了叶片中H2O2的含量,加深了叶片氧化胁迫程度。可见,在高 NH条件下,高铵钾比对拟南芥叶片氧化胁迫的加剧作用更突出,降低铵钾比可部分缓解高 NH对叶片的氧化胁迫。

图5 不同NH和K+处理下叶片DAB染色情况Fig. 5 The DAB staining of leaf under different concentrations of NHand K+treatments
3 讨论
铵是植物的重要氮源之一,而植物体内过量铵积累会对植物造成伤害,高 NH对植物抑制作用的明显特征是抑制根系生长和地上部发育[4,22,26]。Lasa等[27]研究发现豌豆和菠菜根系在高 NH下被显著抑制。本文研究也发现高浓度的 NH显著抑制拟南芥主根的伸长和地上部的发育。
外界阳离子的浓度在植物抵抗铵毒害过程中起重要的作用,尤其是钾离子。在高铵条件下,维持外界合适的铵钾比是植物耐受铵毒害过程中的一个关键。铵钾比是指外界环境中NH与K+的浓度比,其在植物抵御铵毒害过程中有重要作用。当铵钾比高时,植物就容易遭受铵毒害;而当铵钾比降到合适的比例时,铵毒害程度就会有所减轻甚至消除。研究表明,在高铵条件下,当外界铵钾比从15降至5,拟南芥遭受铵毒害的程度就得到一定的缓解,而当外界钾浓度进一步提高,铵钾比进一步下降时,植物遭受铵毒害的程度并不能进一步得到缓解。Li等[28]研究认为高铵对主根伸长的抑制与外源铵钾比密切相关,铵钾比在不高于4 ~ 8时会明显减轻铵毒害症状,而维持较低的外源 NH/K+比可以明显恢复根系的生长,缓解 NH对主根伸长的抑制[29–32],因此降低NH/K+比可能是提高拟南芥耐铵毒的手段。较低的阳离子,尤其 K+的吸收是植物发生 NH毒害的关键之一[15,33],而外源添加K+会显著缓解NH的毒害作用[15,31,33]。例如,研究常用的MS培养基,其本身就含有20.6 mmol/L的NH,但同时含有20 mmol/L的K+,其上生长的植物幼苗并没有任何毒害症状[15]。而在以 NH为单一氮源的缺 K+培养基中,只需要1 mmol/L NH就足以引发拟南芥铵中毒症状[34]。Balkos等[20]也报道,高NH胁迫下降低外源NH/K+(浓度比)比会显著增加水稻根系的生物量。本研究中铵钾比由150降到7.5,显著减轻了铵对拟南芥根系和地上部生长的抑制作用。除根系伸长外,侧根数量也是植物吸收水分和养分的关键,侧根的发育包括原基的启动、伸长等过程。Li等[35]研究发现,高NH可以抑制侧根原基的冒出过程,本研究发现高铵处理下,不同铵钾比条件都会显著降低侧根数量,但拟南芥侧根数量在低铵钾比时比高铵钾比时有显著增加,说明,低铵钾比在缓解高 NH抑制的拟南芥侧根发育过程中也发挥重要作用,这与前人研究相一致[36]。另外,Li等[37]的研究还提到在低K+条件下,AMOS2遗传位点可能在拟南芥抵抗高 NH对侧根的抑制过程中发挥重要作用,降低NH/K+比可能是提高拟南芥耐铵毒的手段之一,因此铵钾比的调控可能与该遗传位点有关。本研究结果显示高铵会抑制根系的生长发育,影响地上部的生物量,但不同铵钾比对根系及地上部影响差异较大,高铵钾比显著加重了主根伸长和侧根数量的抑制,改变了侧根的阶段分布,减轻了地上部生物量,而降低铵钾比则在很大程度上缓解了这种抑制,并且对根系的缓解效应要大于地上部的缓解效应。NH和 K+具有高度相似的离子半径和价位,这在离子透过膜转运时非常重要[38]。现在普遍认为,NH会影响 K+的吸收和积累,同理,K+也会影响NH的吸收和积累[30],这些现象也就能解释为什么提高外源K+含量能在一定条件下保护植物免受铵毒害[15,29]。此外,也有研究认为K+不仅与NH竞争通道位点和转运蛋白,而且还增强了 NH的同化作用也是提高外源K+含量能保护植物免受铵毒害的机制之一[20]。
活性氧(ROS)是植物光合作用中产生的副产物,也是植物细胞代谢过程中的产物,在植物受到胁迫时更容易产生[39]。高铵会引起植物体内氧化还原状态的紊乱,导致ROS的过量积累,从而对植物造成氧化损伤[40]。另外,铵胁迫还会诱导植物体内NO及其衍生的其他活性氮(RNS)等物质的产生,也会扰乱植物细胞内氧化还原状态[41]。植物在逆境胁迫初期其内源的 H2O2会快速升高[41–43]。Wang等[44]研究发现铵毒害引起水生植物Hydrilla verticillata的氧化胁迫加重,O2–和H2O2含量升高,本研究结果也显示,高铵会对拟南芥造成明显的氧化胁迫,导致叶片 H2O2水平增加,但Wang等[44]实验中铵钾比浓度为2左右,与一般认定的可引起铵毒害的铵钾比有较大差异,这可能与实验条件为水培有关。图5结果显示不加NH条件下,外源提供不同浓度K+处理,拟南芥叶片几乎没有DAB染色,表明此时两者叶片都只有较低的H2O2水平。但在高浓度NH条件下,不同钾浓度处理的叶片 DAB染色程度均较对照有所增加,这与Wang等[40,44]研究发现结果一致,他们的实验结果表明在高铵胁迫下,地上部有明显的H2O2积累。Podgórska等[45]的研究也表明,铵胁迫与氧化还原状态的失衡相关联,并且会提高拟南芥Col-0叶片中的ROS水平。但本研究同时发现,在高浓度NH条件下,高铵钾比处理的拟南芥叶片DAB染色程度显著深于低铵钾比处理,表明高 NH下,高铵钾比显著增加了叶片中H2O2的含量,加剧了叶片氧化胁迫程度,这与Shin和Schachtman[46]的研究结果一致,他们的实验证明,拟南芥在 K+缺乏的条件下 ROS会明显增加。本研究中在高 NH处理下,高铵钾比对拟南芥叶片氧化胁迫的加剧作用更突出,降低铵钾比可部分缓解高 NH对叶片的氧化胁迫。因此,在植物响应不同铵钾比供应的过程中,氧化胁迫可能是其中一个重要环节。另外,本研究发现高铵条件下,高铵钾比处理的拟南芥细胞透性和死亡程度增加尤其显著,而这种伤害可以通过降低铵钾比得到部分缓解。另外,同一处理下,根部OD600值显著高于地上部,说明根部受胁迫程度更高,这可能与根系是植物吸收代谢铵的主要场所,是土壤高铵胁迫的直接感应和受害部位有关。
4 结论
2) 目前关于不同铵钾比对主侧根发育和地上部生长的毒害机制报道较少,本文报道的高铵导致植株氧化胁迫升高的现象可能为深入研究主侧根及地上部对不同铵钾比环境响应的信号机制提供了新的切入点。
3) 本研究可以为土壤施肥提供一定的理论参考,由于我国土壤普遍缺钾,在实际应用过程中,这些土壤中应尽量降低铵肥的施用,或者在施用铵肥时补充一定量的钾肥,使之保持较低的铵钾比,避免铵对农作物的毒害;而在某些土壤钾素较为丰富的地区,则可适当提高施用铵肥的比例,以提供充足养分保证作物的良好生长。
[1] Kronzucker H J, Siddiqi M Y, Glass A D M, et al. Nitrate-ammonium synergism in rice. A subcellular flux analysis[J]. Plant Physiol., 1999, 119: 1 041–1 045
[2] Masclaux-Daubresse C, Reisdorf-Cren M, Pageau K, et al. Glutamine synthetase-glutamate synthase pathway and glutamate dehydrogenase play distinct roles in the sink-source nitrogen cycle in tobacco[J]. Plant Physiol., 2006, 140: 444–456
[3] Siddiqi M Y, Malhotra B, Min X J, et al. Effects of ammonium and inorganic carbon enrichment on growth and yield of a hydroponic tomato crop[J]. J. Plant Nutr., 2002, 165: 191–197
[4] Britto D T, Kronzucker H J. NHtoxicity in higher plants: A critical review[J]. J Plant Physiol, 2002, 159: 567–584
[5] Krupa S V. Effects of atmospheric ammonia (NH3) on terrestrial vegetation: A review[J]. Environ Pollut, 2003, 124: 179–221
[6] Camargo J A, Alonso A. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: A global assessment[J]. Environ. Int., 2006, 32: 831–849
[7] Cao T, Xie P, Ni L, et al. The role of NHtoxicity in the decline of the submersed macrophyteVallisneria natansin lakes of the Yangtze River basin, China[J]. Mar. Freshwater Res., 2007, 58: 581–587
[8] Dave G, Nilsson E. Increased reproductive toxicity of landfill leachate after degradation was caused by nitrite[J]. Aquat. Toxicol., 2005, 73: 11–30
[9] Romano N, Zeng C. Acute toxicity of ammonia and its effects on the haemolymph osmolality, ammonia-N, pH and ionic composition of early juvenile mud crabs,Scylla serrata(Forskal)[J]. Comp. Biochem. Physiol. (Sect A), 2007, 148: 278–285
[10] 李婷, 王火焰, 陈小琴, 等. 土壤非交换性钾释放动力学特征及其生物有效性[J]. 土壤学报, 2015, 52(5): 1 078–1 087
[11] 刘秀秀, 鲁剑巍, 王寅, 等. 缺钾对油菜主序产量性状的影响及施钾效果[J]. 土壤, 2014, 46(5): 875–880
[12] Li X Z, Velde B, Li D. Loss of K-bearing clay minerals in flood-irrigated, rice-growing soils in Jiangxi Province, China[J]. Clay Clay Miner, 2003, 51: 75–82
[13] Yang X E, Li H, Kirk G J D, et al. Room-induced changes of potassium in the rhizosphere of lowland rice[J]. Commun. Soil Sci. Plant Anal., 2005, 36: 1 947–1 963
[14] Cao Y W, Class A D M, Crawford N M. Ammonium Inhibition of Arabidopsis Root growth can be reversed by potassium and by auxin resistance mutations aux1, axr1, and axr2[J]. Plant Physiol., 1993, 102: 983–989
[15] Xu Q F, Tsai C L, Tsai C Y. Interaction of potassium with the form and amount of nitrogen nutrition on growth and nitrogen uptake of maize[J]. J. Plant Nutr., 1992, 15: 23–33
[16] Walker D J, Leigh R A, Miller A J. Potassium homeostasis in vacuolate plant cells[J]. Proc .Natl. Acad. Sci. USA, 1996, 93: 10 510–10 514
[17] Szczerba M W, Britto D T, Kronzucker H J. Rapid, futile K+cycling and pool-size dynamics define low-affinity potassium transport in barley[J]. Plant Physiol., 2006, 141: 1 494–1 507
[18] Barker A V, Maynard D N, Lachman W H. Induction of tomato stem and leaf lesions and potassium deficiency by excessive ammonium nutrition[J]. Soil Sci., 1967, 103: 319–327
[19] Zhang Y S, Sun X, Ying Q Z. The effect of organic manure and potassium in preventing ammonium toxicity in barley[J]. Acta Pedologica Sinica, 1990, 27: 80–86
[20] Balkos K D, Britto D T, Kronzucker H J. Optimization of ammonium acquisition and metabolism by potassium in rice (Oryza sativaL. cv. IR-72)[J]. Plant Cell Environ., 2010, 33: 23–34
[21] 董刚强, 冯晓宇, 李光杰, 等. 拟南芥铵超敏感突变体amosd和vtc1对外源铵的响应[J]. 生态学杂志, 2012, 31(6): 1 327–1 333
[22] Li Q, Li B H, Kronzucker H J, et al. Root growth inhibition by NHinArabidopsisis mediated by the root tip and is linked to NHefflux and GMPase activity[J]. Plant Cell Environ., 2010, 33 (9): 1 529–1 542
[23] Li G J, Li B H, Dong G Q, et al. Ammonium-induced shoot ethylene production is associated with the inhibition of lateral root formation inArabidopsis[J]. J. Exp. Bot., 2013, 64 (5): 1 413–1 425
[24] Weigel D, Glazebrook J. Arabidopsis: A laboratory manual[M]. Cold Spring Harbor Laboratory Press, New York, USA, 2002
[25] Baker C J, Mock N M. An improved method for monitoring cell death in cell suspension and leaf disc assays using evans blue[J]. Plant Cell Tissue Org., 1994, 39: 7–12
[26] 李青. 高铵胁迫影响拟南芥根系生长的作用特征及分子生理机制[D]. 南京:中国科学院南京土壤研究所, 2010
[27] Lasa B, Frechilla S, Aparicio-Tejo P M, et al. Role of glutamate dehydrogenase and phosphoenolpyruvate carboxilase activity in ammonium nutrition tolerance in roots[J]. Plant Physiol. Biochem., 2002, 40: 969–976
[28] Li B H, Li Q, Kronzucker H J, et al. Roles of abscisic acid and auxin in shoot-supplied ammonium inhibition of root system development[J]. Plant Signal Behav., 2011, 6 (10): 1 451–1 453
[29] Kronzucker H J, Szczerba M W, Britto D T. Cytosolic potassium homeostasis revisited:42K-tracer analysis inHordeum vulgareL. reveals set-point variations in [K+][J]. Planta, 2003, 217: 540–546
[30] Szczerba M W, Britto D T, Balkos K D, et al. Alleviation of rapid, futile ammonium cycling at the plasma membrane by potassium reveals K+-sensitive and -insensitive components of NHtransport[J]. J. Exp. Bot., 2008, 59 (2): 303–313
[31] Hoopen F T, Cuin T A, Pedas P, et al. Competition between uptake of ammonium and potassium in barley andArabidopsisroots: molecular mechanisms and physiological consequences[J]. J. Exp. Bot., 2010, 61 (9): 2 303–2 315
[32] Zou N, Li B H, Dong G Q, et al. Ammonium-induced loss of root gravitropism is related to auxin distribution and TRH1 function, and is uncoupled from the inhibition of root elongation inArabidopsis[J]. J. Exp. Bot., 2012, 63 (10): 3 777–3 788
[33] Roosta H R, Schjoerring J K. Effects of nitrate and potassium on ammonium toxicity in cucumber plants[J]. J. Plant Nutr., 2008, 31: 1 270–1 283
[34] 方婧. 铵态氮对拟南芥根尖结构的影响[D]. 北京: 中国农业大学, 2007
[35] Li B H, Li Q, Su Y H, et al. Shoot-supplied ammonium targets the root auxin influx carrier AUX1 and inhibits lateral root emergence inArabidopsis[J]. Plant Cell Environ., 2011, 34: 933–946
[36] 冯晓宇, 李光杰, 董刚强, 等. 不同浓度 NH和 K+处理对拟南芥突变体amos2侧根发育的影响[J]. 植物生理学报, 2013, 49 (5): 463–468
[37] Li G J, Dong G Q, Li B H, et al. Isolation and characterization of a novel ammonium overly sensitive mutant, amos2, inArabidopsis thaliana[J]. Planta, 2012, 235: 239–252
[38] Wang M Y, Siddiqi M Y, Glass A D M. Interactions between K+and NH: effects on ion uptake by rice roots[J]. Plant, Cell and Environment, 1996, 19: 1 037–1 046
[39] Apel K, Hirt H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction[J]. Annu. Rev. Plant Biol., 2004, 55: 373–399
[40] Wang C, Zhang S H, Wang P F, et al. Effects of ammonium on the antioxidative response inHydrilla verticillata(L.f.) Royle plants[J]. Ecotox. Environ. Safety, 2010, 73: 189–195
[41] Foyer C H, Lopez-Delgado H, Dat J F, et al. Hydrogen peroxide-and glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J]. Physiol. Plantarum., 1997, 100: 241–254
[42] Pucciariello C, Parlanti S, Banti V, et al. Reactive oxygen species-driven transcription inArabidopsisunder oxygen deprivation[J]. Plant Physiol., 2012, 159: 184–196
[43] Wahid A, Perveen M, Gelani S, et al. Pretreatment of seed with H2O2improves salt tolerance of wheat seedlings by alleviation of oxidative damage and expression of stress proteins[J]. J. Plant Physiol., 2007, 164: 283–294
[44] Wang C, Zhang S H, Li W, et al. Nitric oxide supplementation alleviates ammonium toxicity in the submerged macrophyteHydrilla verticillata(L.f.) Royle[J]. Ecotox. Environ. Safety, 2011, 74: 67–73
[45] Podgórska A, Ostaszewska M, Gardeström P, et al. In comparison with nitrate nutrition, ammonium nutrition increases growth of the frostbite1Arabidopsismutant[J]. Plant Cell Environ., 2015, 38: 224–237
[46] Shin R, Schachtman D P. Hydrogen peroxide mediates plant root cell response to nutrient deprivation[J]. P. Natl. Acad. Sci. USA, 2004, 101: 8 827–8 832
Effects of Different Concentrations of NH/K+ratios on Shoot and Root Growth ofArabidopsis thalianaUnder High Ammonium Condition
SONG Haiyan1,2, LI Guangjie1,2, SHI Weiming1*
(1State Key Laboratory of Soil and Sustainable Agriculture(Institute of Soil Science,Chinese Academy of Sciences),Nanjing210008,China; 2University of Chinese Academy of Sciences,Beijing100049,China)
Potassium plays an important role in the process of protecting plant species from ammonium toxicity. In the present study, primary root, lateral root (LR) and shoot developments ofArabidopsiswild type (Col-0) were analyzed under excessive NH(30 mmol/L) with two concentration ratios of NH/K+(7.5 and 150) in agar medium. The results showed that under high ammonium condition (30 mmol/L), high NH/K+ratio (150) increased the ammonium stress, inhibited the shoot and root development and aggravated the oxidative stress compared with low NH/K+ratio (7.5). Compared with the low NH/K+ratio, the high NH/K+ratio inhibited the primary root elongation by 57.4%, the relative number of LRs by 33.3% and the shoot fresh weight by 69.9% under the high ammonium condition. The results of DAB (3, 3'-diaminobenzidine) staining of leaf indicated that compared with no ammonium treatment, the different external K+levels (0.2 and 4.0 mmol/L) did not show significantly different effects on shoot oxidative stress ofArabidopsis; while under the high ammonium condition, the high NH/K+ratio further increased the H2O2content of leaf and aggravated the oxidative stress compared with the low NH/K+ratio. Evans blue (EB) staining showed that the different external K+levels did not show significantly different effects on shoot and root membrane permeability ofArabidopsisin the treatment without ammonium; while the high NH/K+ratio significantly enhanced shoot and root membrane permeability under the high ammonium condition. All the results indicated that high ammonium inhibited the development of shoot and root ofArabidopsis, and the inhibition would be enhanced by the high NH/K+ratio. In addition to the reduction in the absorption of ammonium by the plants due to presence of high concentration of potassium, the reason may be also ascribed to the exacerbated oxidative stress by the high NH/K+ratio. Therefore, appropriate NH/K+ratio plays an important role in response of plants to ammonium toxicity.
Arabidopsis thaliana; NHtoxicity; NH/K+ratio; Oxidative stress
Q945.1
10.13758/j.cnki.tr.2016.06.003
国家自然科学基金青年科学基金项目(31300210)和国家自然科学基金重点项目(41171234)资助。
* 通讯作者(wmshi@issas.ac.cn)
宋海燕(1991—),女,浙江湖州人,硕士研究生,主要从事植物营养生理生化与分子遗传方面的研究。E-mail:hysong@issas.ac.cn
