太子参GAPDH基因的克隆及序列分析
2016-02-08龙登凯江维克肖承鸿
龙登凯,丁 铃,李 军,周 涛,江维克,肖承鸿
(贵阳中医学院,贵州 贵阳 550002)
太子参GAPDH基因的克隆及序列分析
龙登凯,丁 铃,李 军,周 涛*,江维克,肖承鸿
(贵阳中医学院,贵州 贵阳 550002)
为了获取可靠内参基因,采用同源克隆技术和cDNA末端快速延伸技术,首次从太子参中克隆3-磷酸甘油醛脱氢酶基因(GAPDH)的部分cDNA序列,命名为PhGAPDH,序列长度为981 bp,包含699 bp的部分阅读框,推测其编码232个氨基酸,还含有282 bp的3′UTR。序列分析结果表明,太子参PhGAPDH基因编码的氨基酸序列与同科植物香石竹(Dianthuscaryophyllus)氨基酸序列同源性高达99%。PCR分析结果表明,PhGAPDH基因在太子参不同种源块根、同一种源不同组织及不同生长时期的表达水平较稳定,可以作为太子参功能基因研究的内部参考基因。
太子参;GAPDH基因; 同源克隆法; cDNA末端快速扩增; 表达模式
理想的内参基因应该在所有的生物细胞中和生理状态下都能较稳定地表达。但是研究表明,没有任何一种内参基因的表达是始终稳定的,在一种试验条件下合适的内参基因并不一定适用于另一种试验条件[1]。因此,在具体试验条件下选择合适的内参基因作为内部参考,从而减小检测样本之间的表达差异至关重要[2]。3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是高等植物糖酵解过程中的一种关键酶,是维持生命活动能量形成的最基本酶之一,具有高度的保守性。GAPDH作为一种含量丰富的胞内蛋白质,在不同个体及组织细胞中的表达相对稳定,具有组成型表达、易于扩增等许多优点,因此经常和β-actin、18S rRNA等管家基因在半定量RT-PCR、Real-time PCR等基因表达量的研究中作为内参基因[3-4]。迄今为止,人们已从银杏[5]、金龙胆草[6]、罗汉果[7]、羊蹄[8]等药用植物中克隆得到GAPDH基因,并将其成功用作基因表达分析的内部参考基因。
太子参为石竹科植物孩儿参[Pseudostellariaheterophylla(Mip.) Pax ex Pax et Hoffm.]的干燥块根,具益气健脾、生津润肺之功效。现代研究表明,太子参具有降血糖、抗疲劳、增强机体免疫以及抗氧化等功效。目前有关太子参的研究主要集中在化学成分[9-10]、药理作用[11-12]、分子鉴定[13]和遗传多样性[14]等方面,其在分子生物学领域的研究尚处于起步阶段,内参基因研究尚未见报道。鉴于此,采用同源克隆及cDNA末端快速延伸技术克隆太子参GAPDH基因的部分序列,并进行序列分析和组织特异性表达分析,为后续的太子参功能基因的研究奠定良好的基础。
1 材料和方法
1.1 材料
太子参样本分为不同种源(A)、不同器官(B)、不同生长阶段(C)3组。A组为不同种植区域的太子参块根材料,分别来自江苏句容马山、句容赤山湖,福建柘荣、英山,贵州施秉牛大场种质圃1号、种质圃2号、种质圃3号,共7份;B组为贵州施秉牛大场种质圃3号的同株4个器官(花、茎、叶、块根),各1份;C组为贵州施秉牛大场种质圃3号的同株第1~4茎段及其对应的叶片,各4份。洗净杂质,用液氮速冻后保存于-80 ℃冰箱中备用。
1.2 主要试剂和仪器
质粒载体pMD19-T simple vector、RNAiso Plus试剂盒、TaqDNA聚合酶、反转录酶M-MLV、SMARTer®RACE 5′/3′Kit均购自宝生物工程(大连)有限公司。胶回收试剂盒购自Omega公司。大肠杆菌(Escherichiacoli)菌株DH5α购自上海生工生物工程技术服务公司。引物合成(表1)及测序服务均由上海生工生物工程技术服务公司完成。

表1 引物名称与序列
1.3 试验方法
1.3.1 RNA的提取及cDNA的合成 取适量太子参新鲜组织置于预冷的研钵中,加液氮迅速研磨成粉末状。参照RNAiso Plus抽提试剂盒说明书提取总RNA。1.2%琼脂糖凝胶电泳检测其完整性,微量核酸测定仪检测其浓度和纯度。以RNA为模板、Oligo T11(50 μmol/L)为引物,利用M-MLV反转录酶合成cDNA第1链。
1.3.2GAPDH核心片段的克隆和3′RACE延伸 从NCBI(National Center for Biotechnology Information,美国国立生物技术信息中心)上下载薄荷(Menthapiperita,KF061097)、彩叶草(Solenostemonscutellarioides,JX419387)、海蓬子(Salicorniaeuropaea,HM067013)、柠檬(Citruslimon,KJ852651)、漆菇(Saginasubulata,KC136241),以及坎伯兰雪草(Mononeuriacumberlandensis,HM017508、HM017509、HM017510)的GAPDH基因序列,通过muscle 3.6软件进行多序列比较并找到保守区域,利用软件Primer 5.0设计简并引物GAPDH-1F、GAPDH-1R(表1)。以cDNA为模板进行PCR扩增,程序为:95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃后延伸7 min。
根据上一步所得GAPDH序列设计2条3′末端延伸引物3gaGSP1、3gaGSP2(表1)。以cDNA为模板,参照SMARTer®RACE 5′/3′Kit说明书进行cDNA末端快速延伸。PCR产物经1.8%琼脂糖凝胶电泳检测,切下目的条带,用Omega胶回收试剂盒回收产物,将之与pMD19-T simple vector载体相连接,转入DH5α感受态细胞进行培养、筛选。将筛选到的阳性克隆送至上海生工生物工程技术服务公司进行测序分析。
1.3.3GAPDH生物信息学分析 利用Genetyx version 7和sequencher V4软件处理和组装GAPDH序列。通过NCBI中的BLASTx(http://blast.ncbi.nlm.nih.gov/Blast.cgi)在线分析工具,对GAPDH编码的氨基酸序列进行相似性分析,采用muscle 3.6软件对相似性高的氨基酸序列进行多重比对、分析,利用Mega 4.0软件以相邻连接法(Neighbour Joining,NJ)构建系统发育树。
1.3.4GAPDH基因组织特异性表达分析 根据GAPDH核心片段序列设计特异引物G-2F和G-2R(表1),以总RNA为分析标准,检测GAPDH基因在太子参7个不同种植区域块根中的表达情况,在块根、茎、叶、花4个器官中的表达情况以及在茎、叶器官不同生长阶段中的表达情况。扩增条件为:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃后延伸7 min。PCR产物经1.8%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 总RNA质量分析
太子参总RNA电泳检测结果(图1—2)表明,28S和18S RNA条带明亮清晰,5S RNA条带较清晰,RNA完整性良好、无降解,且无DNA污染。经核酸检测仪检测,其OD260/280在1.8~2.0, OD260/230在1.9~2.1,可以用于下一步cDNA的合成。
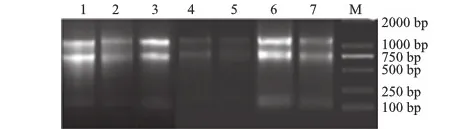
1~7分别为贵州施秉牛大场种质圃1号、2号、3号,福建柘荣,江苏赤山湖、马山,福建英山等种植区域太子参块根,图7同; M:DL 2000

A:1~4分别为块根、花、茎、叶; B:1~4分别为第1~4茎段,5~8分别为第1~4叶位的叶片; M:DL 2000
2.2GAPDH核心片段的克隆及序列分析
以太子参总RNA反转录获得的cDNA为模板,GAPDH-1F和GAPDH-1R为引物进行PCR扩增,得到约500 bp的条带;利用3′RACE扩增得到约1 000 bp大小条带(图3)。测序后的序列经Genetyx version 7软件去除其载体序列,得到539 bp的核心片段序列和918 bp的3′末端序列,与预期大小一致。
利用sequencher V4软件,对测序所得2条序列进行处理组装,得到长度为981 bp的GAPDH序列,并将其命名为PhGAPDH,GenBank注册号为KT899096。
根据cDNA序列翻译的相应氨基酸序列(图4),PhGAPDH片段编码区长699 bp,编码232个氨基酸残基,其终止密码子在第697~699位碱基,3′UTR长度为282 bp。

1、2分别为太子参GAPDH基因核心片段、3′ RACE扩增; M:DL 2000

*表示终止密码子; 长方形框内为多聚腺苷酸尾
运用muscle 3.6软件,将太子参GAPDH基因编码的氨基酸序列与香石竹(Dianthuscaryophyllus)、梨(Pyruspyrifoliavar.culta)、大豆(Glycinemax)、麻疯树(Jatrophacurcas)、枣(Ziziphusjujuba)等物种的GAPDH氨基酸序列进行多重比较,并利用NCBI的CDD数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对太子参GAPDH蛋白进行结构域预测。结果如图5所示,本研究所得PhGAPDH基因编码的氨基酸序列与其他物种的氨基酸序列均具有高度同源性,其中,与香石竹的GAPDH氨基酸序列同源性高达99%。蛋白结构域预测表明,PhGAPDH具有2个结构域,一个为Gp_dh_N,与其他物种有4个氨基酸位点具有差异,另一个为Gp_dh_C,与其他物种有12个氨基酸位点的差异。

1:太子参; 2:香石竹; 3:梨; 4:大豆; 5:麻疯树; 6:枣;黑色背景:高度保守的氨基酸序列;黑色方框:GAPDH蛋白的Gp_dh_N和Gp_dh_C结构域
为了更进一步了解该基因的亲缘进化关系,运用Mega 4.0软件的相邻连接法构建太子参GAPDH氨基酸序列与其他物种氨基酸序列的系统发育树。分析所用物种的GenBank登录号如下:GU356597(毛竹,Phyllostachysedulis)、P34921(香石竹,Dianthuscaryophyllus)、KC136241(漆菇,Saginasubulata)、HQ184063(刺五加,Eleutherococcussenticosus)、AAQ57193(人参,Panaxginseng)、DQ186631(三七,Panaxnotoginseng)、AAA33780(欧洲赤松,Pinussylvestris)、BAD72793(黑松,Pinusthunbergii)。系统进化分析结果显示,GAPDH在进化上是非常保守的,来自9种植物的GAPDH分为2个大支,隶属裸子植物门松柏纲的欧洲赤松、黑松聚为一支,其余7种被子植物聚为另一支。而在被子植物的次级分支下,单子叶植物纲植物独立为一个分支,另一次级分支为双子叶植物纲植物,且太子参的GAPDH序列与同科香石竹、漆菇的聚为一类,表明该序列在石竹科植物中高度同源(图6)。

图6 GAPDH基因系统进化分析
2.3GAPDH基因组织特异性表达分析
为了分析PhGAPDH基因在太子参不同种植区域、不同器官、不同生长时期中的表达情况,进行了GAPDH基因组织特异性表达分析。结果显示,PhGAPDH基因在7个不同种植区域太子参块根、同一种源4个器官和同一种源茎、叶的4个生长时期中均有稳定表达,且所得扩增结果无非特异性条带和引物二聚体,扩增序列长度与预期大小307 bp相符(图7—9)。作为看家基因,PhGAPDH基因在不同太子参材料中均有稳定表达。

M:DL 500

1~4分别为块根、花、茎、叶; M:DL 500
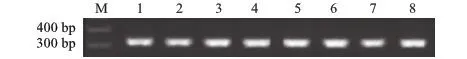
1~4分别为第1~4茎段,5~8分别为第1~4位叶片; M:DL 500
3 结论与讨论
高等植物中的3-磷酸甘油醛脱氢酶主要有2类:一类存在于叶绿体中,参与卡尔文碳循环;另一类存在于细胞质中,主要参与糖酵解过程[15-16]。本研究通过同源克隆技术和cDNA末端快速延伸获得了1段长度为981 bp的太子参GAPDH基因cDNA序列,包含699 bp的部分阅读框,推测其编码232个氨基酸,还含有282 bp的3′UTR。序列分析表明,太子参PhGAPDH基因编码的氨基酸序列与其同科植物香石竹的GAPDH氨基酸序列相似度高达99%,与其他物种的氨基酸序列相似度在92%~95%,可确定本研究所得序列为太子参GAPDH基因序列。CDD结构域预测分析表明,PhGAPDH含有Gp_dh_N和Gp_dh_C结构域,这2个结构域分别对应糖酵解过程中的3-磷酸甘油醛和NAD+合成,据此,推测PhGAPDH基因位于太子参的细胞质中。
根据所建系统进化树,GAPDH基因在进化过程中呈现出极高的保守性,不同物种GAPDH的同源性能够很好反映物种之间的亲缘关系。双子叶植物纲、单子叶植物纲以及松柏纲各聚为一个大支。太子参GAPDH与伞形目的刺五加、人参、三七的3-磷酸甘油醛脱氢酶系统起源较近,隶属双子叶植物纲分支下。而且,其与同科的香石竹、漆菇聚为一个小支,表明该基因为石竹科所共有,该结果也更进一步论证了本研究所得序列为太子参GAPDH基因序列。另外,虽然随着研究的深入,GAPDH基因的功能并非是单一的糖酵解途径关键酶,但是聚类结果表明,作为细胞质中的关键蛋白,其蛋白质结构在高等植物的系统进化过程中被保留下来。
一直以来,GAPDH被认为是仅存于细胞质中的管家基因产物,在同种细胞或组织中表达量恒定,故被广泛用作植物基因表达分析研究中的内参对照基因。但最近许多研究表明,不同类型的细胞和组织中、细胞和器官发育的不同阶段以及各种试验条件等情况下,内参基因的表达水平通常变异较大[17-18]。因此,在基因表达研究中需选择合适的管家基因作内部参照。本研究结果显示,太子参的PhGAPDH基因在不同种源、不同器官以及茎叶不同生长时期均有稳定表达,且其扩增产物特异性强,无引物二聚体。因此,本研究虽未克隆到太子参GAPDH基因的5′端序列,但是结果完全可以满足作为内参基因的要求,这对太子参基因的表达分析及其生物学功能的研究具有重要的开拓意义。
[1] Volkov R A,Panchuk I I,Schoffl F.Heat-stress-dependency and developmental modulation of gene expression: The potential of house-keeping genes as internal standards in mRNA expression profiling using real-time RT-PCR[J].J Exp Bot,2003,54(391):2343-2349.
[2] Quackenbush J.Microarray data normalization and transformation[J].Nat Genet,2002,32:496-501.
[3] 朱华,李珅,赵瑞强,等.三七植物GAPDH基因克隆及序列分析[J].西北植物学报,2006,26(7):1316-1319.
[4] 位明明,王俊生,张改生,等.GAPDH基因表达与小麦生理型雄性不育花药败育的关系[J].分子植物育种,2009,7(4):679-684.
[5] 潘伟明,刘文,杨妙贤,等.银杏GAPDH基因序列的初步克隆[J].广东农业科学,2010,37(8):196-198.
[6] 孙蓉,高静雷,刘姗,等.金龙胆草3-磷酸甘油醛脱氢酶基因的克隆及序列分析[J].中草药,2013,44(19):2732-2735.
[7] 余汇,蒋向军,覃宇燕,等.罗汉果GAPDH基因的克隆及其在基因表达分析中的应用[J].时珍国医国药,2014,25(2):495-498.
[8] 任聪,黄五星,张翔,等.羊蹄GAPDH基因的克隆及序列分析[J].河南农业科学,2015,44(2):115-118.
[9] 贾爱群,李湘,谭宁华,等.太子参环肽B(Heterophyllin B,HB)的酶环化反应[J].中国科学(B辑化学),2005,35(6):455-458.
[10] 杨亚滨,谭宁华,许文彦,等.中药太子参中环肽A和B含量测定的HPLC方法研究[J].云南中医学院学报,2009,32(6):33-36.
[11] 刘训红,陈彬,王玉玺.太子参多糖抗应激和免疫增强作用的实验研究[J].江苏中医,2000,21(10):51-52.
[12] 蔡巧燕,林珊,肖桂清,等.太子参内生真菌体外抗肿瘤、抗氧化活性研究[J].福建中医药大学学报,2011,21(6):41-43,46.
[13] 赵丹,周涛,江维克,等.太子参药材的快速分子鉴定[J].中国中药杂志,2014,39(19):3689-3694.
[14] 肖承鸿,周涛,江维克,等.栽培太子参的遗传多样性与质量分析[J].中草药,2014,45(9):1319-1325.
[15] Martin W,Brinkmann H,Savonna C,etal.Evidence for a chimeric nature of nuclear genomes: Eubacterial origin of eukaryotic glyceraldehyde-3-phosphate dehydrogenase genes[J].Proc Natl Acad Sci USA,1993,90(18):8692-8696.
[16] Petersen J,Brinkmann H,Cerff R.Origin,evolution,and metabolic role of a novel glycolytic GAPDH enzyme recruited by land plant plastids[J].J Mol Evol,2003,57(1):16-26.
[17] Hu R,Fan C,Li H,etal.Evaluation of putative reference genes for gene expression normalization in soybean by quantitative real-time RT-PCR[J].BMC Mol Biol,2009,10(1):93.
[18] Die J V,Roman B,Nadal S,etal.Evaluation of candidate reference genes for expression studies inPisumsativumunder different experimental conditions[J].Planta,2010,232(1):145-153.
Cloning and Sequence Analysis of GAPDH Gene from Pseudostellaria heterophylla
LONG Dengkai,DING Ling,LI Jun,ZHOU Tao*,JIANG Weike,XIAO Chenghong
(Guiyang College of Traditional Chinese Medicine,Guiyang 550002,China)
In order to achieve a valuable reference gene,a partial cDNA sequence ofGAPDHwas cloned fromPseudostellariaheterophyllaby the homology cloning and RACE,which was namedPhGAPDH.The length ofPhGAPDHcDNA was 981 bp,which encoded 232 amino acids with 282 bp 3′UTR.Sequence analysis indicated that the amino acid ofPhGAPDHshowed high similarity with theGAPDHfromDianthuscaryophyllus(99%).The PCR analysis showed thatPhGAPDHhad a consistent expression in roots from different provenances and in different tissues,growth stages.This result showed thatPhGAPDHcould be used as a reliable reference gene in the function research of genes fromP.heterophylla.
Pseudostellariaheterophylla;GAPDHgene; homology cloning; RACE; expression profile
2016-03-20
国家自然科学基金项目(81460579);贵州省研究生工作站建设项目(黔教研合JYSZ字[2014]016);施秉中药材产业科技合作专项计划项目[施中药科合专项(2014)第6号]
龙登凯(1990-),男,贵州天柱人,在读硕士研究生,研究方向:中药资源鉴定与质量控制。 E-mail:lanxitxy@163.com
*通讯作者:周 涛(1968-),女,贵州凯里人,教授,博士,主要从事中药材品质形成的遗传与环境机制研究。 E-mail:taozhou88@163.com
Q785
A
1004-3268(2016)07-0087-06
