血清C反应蛋白荧光免疫层析检测方法的建立
2016-02-07葛宇新丁秋雨钟晓骝栗慧超刘倩史新宇赵晶晶于源华张昊
葛宇新,丁秋雨,钟晓骝,栗慧超,刘倩,史新宇,赵晶晶,于源华,张昊
(1.长春理工大学校医院,长春 130022;2.长春理工大学化学与环境工程学院,长春130022;3.长春理工大学生命科学技术学院,长春 130022)
血清C反应蛋白荧光免疫层析检测方法的建立
葛宇新1,丁秋雨2,钟晓骝2,栗慧超3,刘倩3,史新宇3,赵晶晶3,于源华3,张昊3
(1.长春理工大学校医院,长春 130022;2.长春理工大学化学与环境工程学院,长春130022;3.长春理工大学生命科学技术学院,长春 130022)
针对人体急性炎症反应的快速检测,建立了基于量子点碲化镉(CdTe)的荧光免疫层析分析方法及快速定量检测卡,实现血清中炎症标志物C反应蛋白(CRP)的快速定量检测。该检测卡采用双抗体夹心法,首先利用酶联免疫方法筛选出CRP测定最佳包被抗体与标记抗体,然后通过N-羟基琥珀酰(NHS)和1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(EDC)共价偶联法,将CdTe量子点与CRP鼠源单克隆抗体偶联,制备抗体荧光标记物,同时优化不同条件下单克隆抗体与CdTe量子点的偶联效果,琼脂糖凝胶电泳进行鉴定,进而构建CRP荧光免疫层析检测卡,通过建立量子点荧光强度与CRP标准品浓度之间的定量关系,从而实现人体血清中CRP的定量检测。结果表明,CRP检测卡定量检测线性范围为0.1~1000ng/ml,临床样本测试结果显示与进口试剂具有良好的相关性。因此研究为急性炎症反应的快速诊断,及荧光免疫层析检测卡的研发提供了技术基础。
C反应蛋白;量子点;荧光免疫层析;定量检测
近年来,心肌损伤已经成为严重威胁人类生命健康的疾病之一[1]。C反应蛋白(CRP)相对分子质量115kDa,由5个相同亚基以非共价键的形式相结合,形成对称环状五聚体结构,在过酸或过碱环境中被分解为亚基单体,产生免疫反应[2]。传统观点认为CRP是一种非特异性炎症标志物,但近十年的研究揭示了CRP直接参与了炎症、动脉粥样硬化等心血管疾病,是心血管疾病最强有力的预示因子与危险因子[3]。CRP含量增高与心肌炎症反应及损伤有着密切联系,可以作为心肌损伤的重要指标[4,5]。炎症反应或者细胞损伤时,CRP在血清中含量变化范围较大,最高可达正常值的几千倍;当发生急性心肌梗死时,CRP在24至48小时内迅速升高,3天后下降,1到2周后恢复正常,所以CRP是急性心肌梗死的重要标志物,其快速定量检测对心肌梗死早期诊断具有重要意义[6-10]。
近年来,CRP检测常见方法有比浊法、乳胶凝集法、酶联免疫(ELISA)及胶体金等检测方法[11]。比浊及ELISA法虽准确度高,但操作繁琐,检测所需时间较长。胶体金法虽检测时间短,操作简单,但灵敏度低,不能实现定量检测。量子点(QDs)是一种半导体纳米颗粒,与其它免疫荧光分析方法中通常采用的有机荧光染料相比,光化学特性具有非常明显的优势[12,13]。当QDs纳米颗粒受到外来光源激发,发射荧光光谱窄、散射少、光漂白作用小、光化学性质稳定、不易被生物代谢和化学因素降解[14,15]。量子点能够通过偶联剂与蛋白分子进行共价偶联[16]。利用上述特点,本文以CdTe量子点为标记物,以CRP鼠源单克隆抗体(IgG1)为模式抗体,利用EDC与NHS作为活化剂活化量子点,促进其与抗体的共价偶联。对EDC与NHS加入量、量子点含量、缓冲液pH值、共价偶联时间与温度等条件对偶联结果的影响做了详尽探讨,并研制荧光免疫层析检测卡,其操作简单,10min即可获得检测结果,灵敏度较高,线性范围较宽,可实现血清中CRP定性与定量检测[17]。对临床医学快速检测技术的发展具有重要意义。
1 实验部分
1.1 试剂与仪器
C反应蛋白(CRP)抗原、CRP单克隆抗体MCo1及MCo2(杭州启泰生物技术有限公司,中国);CdTe量子点(海王英特龙生物技术有限公司,中国);羊抗鼠IgG(上海生工生物工程有限公司,中国);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)(Sigma,美国)。
核酸电泳槽DYC-02、电泳仪DYY-6B(北京六一实验仪器公司,中国);小型高速离心机Centrifuge 5427 R(Eppendorf,德国);三维平面点膜仪(上海金标生物科技有限公司,中国);荧光免疫层析检测仪(上海捷宁生物科技有限公司,中国)。
1.2 量子点与抗体偶联最佳条件的研究
1.2.1 包被抗体与标记抗体的筛选
利用ELISA间接法测定CRP单克隆抗体MCo1及MCo2效价,选取效价高的作为包被抗体,效价低的作为标记抗体。具体方法如下:(1)将CRP抗原配制为2μg/ml,倍比稀释4梯度浓度,每浓度两个重复,每孔100μl,置于37℃恒温箱孵育0.5h;(2)弃上清,每孔加入200μl洗涤液(磷酸盐-吐温20缓冲液,PBST),清洗3min,重复3次;CRP抗体按1∶1000、1∶2000、1∶4000、1∶8000、1∶16000、1∶32000、1∶64000、1∶128000比例稀释,分别纵向加入酶标板,每孔100μl,37℃孵育0.5h;(3)弃上清,PBST洗涤,每孔加入100μl HRP-羊抗鼠多抗(1:3000稀释),37℃孵育1h;(4)弃上清,PBST洗涤,加入TMB应用液,每孔100μl,25℃避光反应20min;再加入50μl终止液,使用酶标仪测定波长450nm处吸光度,计算获得抗体效价。
1.2.2 CdTe量子点与CRP单抗共价偶联及条件优化
取1ml 0.1M MES缓冲液(pH 6.0),加入20μl量子点,超声2min,加入EDC溶液(0.1mg/ml)2.5μl,加入NHS溶液(0.1mg/ml)2.5μl,37℃振荡15min。加入CRP单克隆标记抗体(1mg/ml)20μl,25℃恒温水浴锅中振荡反应60min,加入2μl10% BSA封闭,12000rpm离心10min,沉淀加入重悬液(3%Triton-100,3%蔗糖,1%酪蛋白钠,Tris-HCl缓冲液pH6.0)0.3ml,4℃避光,备用。
偶联条件的优化步骤分别为(1)EDC/NHS添加量:按照上述共价偶联步骤,在偶联体系中分别加入体积为160μl、80μl、40μl、20μl、10μl、5μl、2.5μl的EDC/NHS溶液(0.1mg/ml),EDC/NHS体积比为1∶1;(2)CdTe量子点含量:在加入CdTe量子点溶液时,加入体积分别为60μl、40μl、20μl、10μl、5μl;(3)MES缓冲液pH值:0.1M MES缓冲液用0.1M NaOH溶液调节pH值分别为3、4、5、6、7共五个梯度;(4)偶联时间:加入CPR标记抗体后,25℃恒温水浴锅中振荡偶联时间分别为30min,60min,90min,120min,150min;(5)偶联温度:加入CPR标记抗体后,在恒温水浴锅中振荡偶联温度分别为20℃,25℃,30℃,35℃。偶联完成后每组均采用琼脂糖凝胶电泳进行鉴定,获得最佳CdTe标记效果。
1.3 荧光免疫层析检测卡制备
利用三维平面点膜仪进行层析卡试剂包被,质控线为羊抗鼠多抗,包被浓度2.0mg/ml,检测线为CRP单克隆抗体MC01,包被浓度为0.8mg/ml,包被完成后放入37℃烘箱干燥2h备用。层析卡选取Satorius CN140硝酸纤维素膜(NC膜);杰一H5072吸水纸;GLB02玻纤作为样品垫,其处理液含有1%Triton-100,3%蔗糖,1%PEG-20000和0.1% NaCl;Ahlstrom 6613聚酯纤维素膜作为释放垫,其处理液含有0.1%Tween-20,1%海藻糖,0.1% PEG-20000和1%BSA。将吸水纸,NC膜,样品垫及释放垫依次贴于PVC板上,裁剪宽度4mm,放入密封袋中防潮备用。
1.3.1 检测时间的确定
组装试剂卡,每个试剂卡中加入标准品(100ng/ ml),利用荧光定量检测仪每隔1.5min进行一次检测,记录T/C比值,T为检测线,C为质控线。由于标记抗体与包被抗体的量为定值,在层析完成后T线与C线荧光强度也为定值,所以当T/C值趋于固定值时所记录的时间即为检测时间。
1.3.2 标准曲线的建立
采用磷酸盐缓冲液(PBS)将CRP标准品分别稀释为0.16μg/ml、0.8μg/ml、4μg/ml、20μg/ml、100μg/ml、0.5mg/ml,每组浓度5个重复,采用制备的荧光免疫检测卡检测CPR标准品,荧光免疫层析检测仪检测荧光强度,建立不同浓度CRP标准品与荧光强度的线性关系,确定CRP定量检测灵敏度。
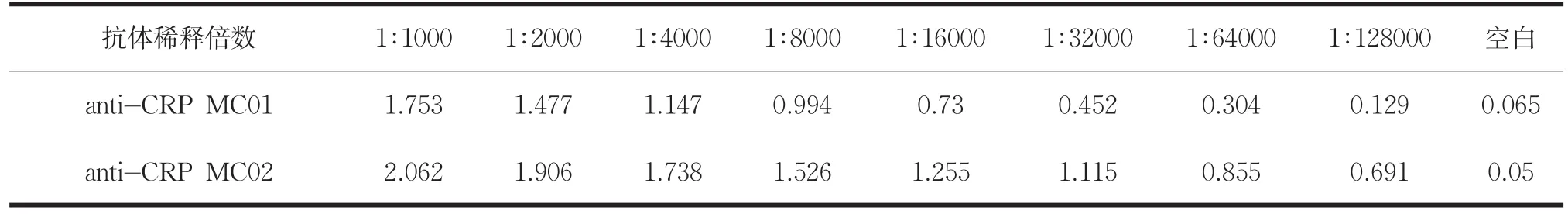
表1 CRP单克隆抗体MC01与MC02效价检测结果
2 结果与讨论
2.1 包被抗体与标记抗体的确定
两种型号CRP单克隆抗体效价检测结果如表1所示,抗体在同等稀释比例条件下,其与抗原的结合能力即抗体效价均为MC02>MC01,因此将MC02作为包被抗体,能够捕获更多抗原,从而提高免疫检测灵敏度,将MC01作为标记抗体,用于检测信号的获取。
2.2 量子点与单抗共价偶联
2.2.1 CdTe量子点表征
采用透射电子显微镜对CdTe量子点粒径、形状及分散度进行表征,结果如图1所示,计算100个量子平均粒径为12 nm,形状均匀,颗粒分散度好,无聚沉现象。
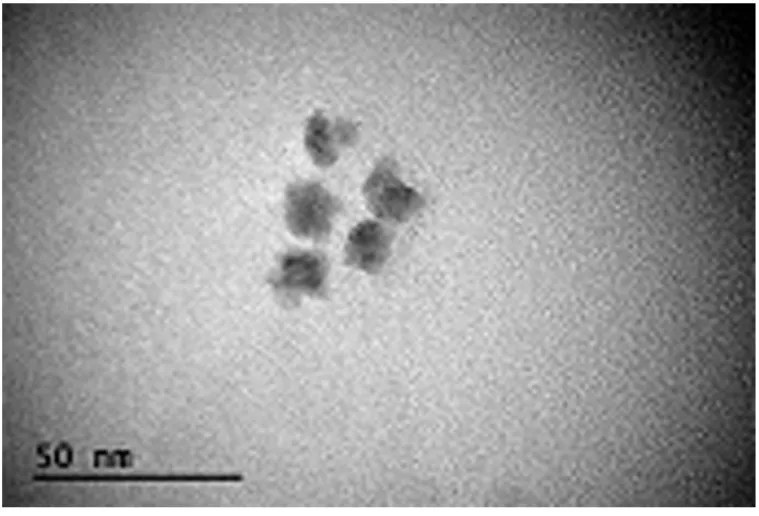
图1 CdTe量子点透射电子显微镜表征
2.2.2 最佳偶联条件的优化
CdTe量子点表面为羧基修饰,带负电荷,在琼脂糖凝胶电泳电场中向正极方向移动;当量子点和蛋白分子通过共价偶联后,形成聚合物,其电泳迁移率下降;如果形成聚合物较大或偶联过量发生团聚时,将无法通过凝胶。因此如图2所示,采用琼脂糖凝胶电泳来鉴定不同条件下CdTe量子点与CRP标记抗体的偶联效果,获得最佳偶联条件。
如图2(A)所示,优化偶联时EDC/NHS比例,孔道1为CdTe量子点,孔道2-8为CdTe量子点与MC01标记抗体偶联过程中,分别加入160~5μl 0.1M EDC溶液的复合物荧光检测。结果表明,随着EDC/NHS含量增加,CdSe量子点与CRP抗体偶联复合物粒径增大,但粒径太大会导致无法从凝胶孔道中跑出;如果EDC/NHS含量过低又会导致活化效率降低,因此如孔道7所示为最佳活化剂含量,即在CdTe量子点与MC01标记抗体偶联过程中加入5μl EDC/NHS。
如图2(B)所示,优化偶联时CdTe量子点含量,孔道1为CdTe量子点,孔道2-6为CdTe量子点与MC01标记抗体偶联时,分别加入量子点体积为5~60μl。结果表明,4号孔道CdTe量子点体积为20μl时,与MC01抗体偶联效果最佳。
如图2(C)所示,优化偶联时MES缓冲液pH值,孔道1是CdTe量子点,孔道2-6为CdTe量子点与MC01标记抗体偶联时,MES缓冲液pH值分别为3-7。结果表明,随着反应溶液pH值由3上升到5过程中,CdSe量子点与CRP抗体偶联产物粒径过大,说明在此pH值条件下偶联复合物发生聚集,堵塞在孔道中;当反应溶液pH值为7时,量子点与抗体偶联效率下降,条带分为两层。因此,如图中孔道5所示,当反应溶液pH=6时,偶联效果最佳。
如图2(D)所示,优化偶联反应时间,孔道1是CdTe量子点,孔道2-6为CdTe量子点与MC01标记抗体偶联时,反应时间分别为150~30min。结果表明,偶联时间过长,易发生偶联复合物团聚,条带滞留(2-4孔道);时间过短,偶联率低,粒径小,条带迁移过快(6孔道)。因此,如5号孔道所示,当偶联反应为60min时为偶联效果最佳。
如图2(E)所示,优化偶联反应温度,孔道1是CdTe量子点,孔道3-6为CdTe量子点与MC01标记抗体偶联时,反应温度分别为35-20℃。结果表明,最佳偶联温度为25℃(5孔道)。
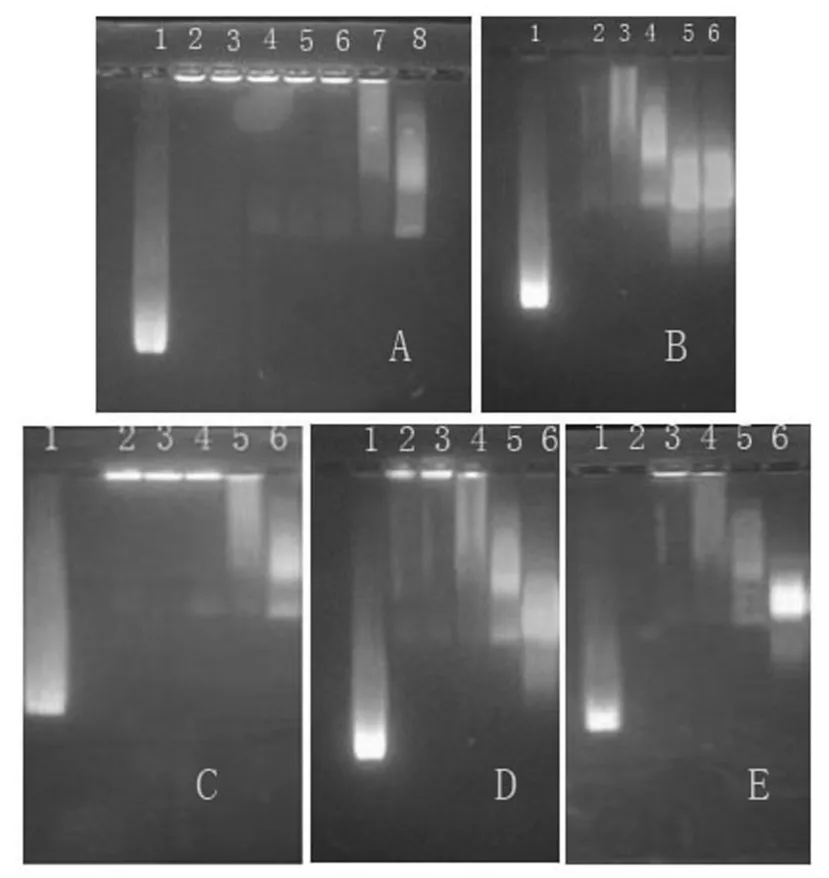
图2 CdTe量子点与MC02标记抗体偶联条件优化
2.3 检测时间的确定
制备的试剂卡加入100μl浓度为800ng/ml CRP标准品,每隔1.5min进行一次荧光检测,其T/C比值结果如图3所示,当反应时间大于9min后,T/C比值趋于稳定,因此,最佳检测时间为9min。
2.4 CRP定量检测标准曲线及灵敏度
制备的CRP检测卡采用双单克隆抗体夹心免疫层析检测法,当待检测样本CRP含量刚好达到检测卡灵敏度时,质控线(C线)与检测线(T线)同时显色。通过对倍比稀释的CRP标准品溶液进行检测,浓度在0.1~1000ng/ml范围内,T线呈浅红色到红色的梯度变化,结果如图3所示,孔道1-8其CRP抗原浓度依次为0ng/ml,0.1ng/ml,10ng/ml,100ng/ ml,200ng/ml,400ng/ml,800ng/ml,1000ng/ml,当低于0.1ng/ml时T线不显色,但是通过荧光定量检测仪可以捕获荧光信号,当加样量低于0.05ng/ml时荧光定量检测仪捕获不到信号,所以试剂卡的灵敏度为0.05ng/ml。
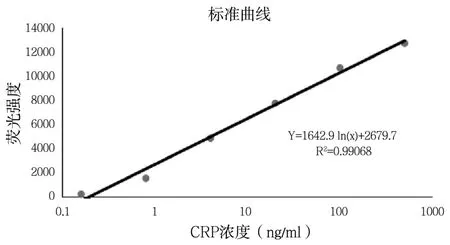
图3 检测时间优化结果

图4 CRP标准溶液荧光检测卡测试结果
采用荧光检测仪对检测卡的荧光信号进行测定,以荧光强度为Y轴,以CPR标准品浓度为X轴,绘制定量检测标准曲线,结果如图4所示,CRP标准品浓度与荧光强度呈正线性相关,相关系数R2大于0.99。
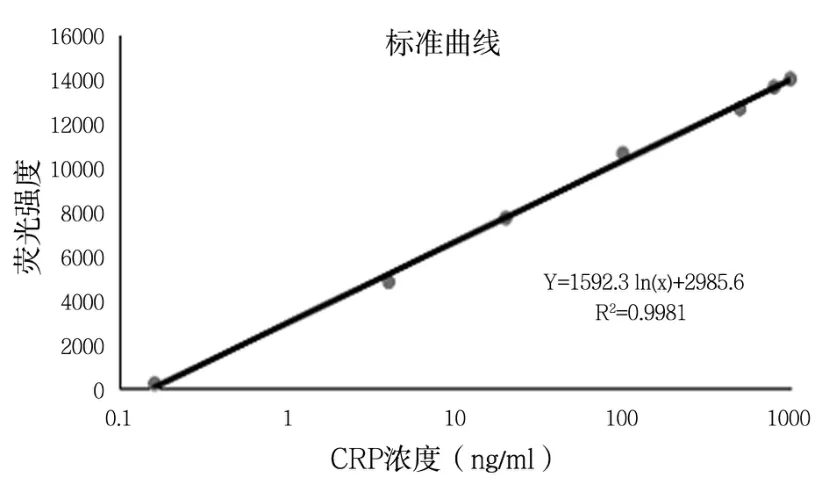
图5 CRP定量检测标准曲线
3 结论与展望
本论文以荧光量子点CdTe为标记物,通过EDC与NHS实现量子点与CPR单克隆抗体的共价偶联,从而建立了双单克隆抗体夹心荧光免疫层析CPR定量检测方法,制备了CRP荧光免疫层析检测卡,结合荧光检测仪,实现了CPR的定量检测。该方法制备的荧光试纸条检测CRP线性范围为0.1~1000ng/ml,最低检测限0.05ng/ml。与传统ELISA方法相比,荧光免疫层析试纸条定量检测方法无需繁琐的多次加样、反复洗板步骤,且10min内即可完成单个样品的检测,因此该定量检测方法在临床上对AMI的快速准确检测具有重要的意义。
[1]Takashi Omura,Keitaro Ogawa,Mayu Hashimoto,et al.Acute ST elevation myocardial infarction in an adult patient with anomalous origin of the left coronary artery from the pulmonary artery[J].Journal of Cardiology Cases.2014,9(3):121-123.
[2]Ngom B,Guo Y,Wang X,et al.Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants:a review[J].Analytical&Bioanalytical Chemistry,2010,397(3):1113-1135.
[3]鄢盛恺.超敏C反应蛋白的测定在动脉粥样硬化疾病诊治中的应用[J].诊断学理论与实践,2002,1(4):267-269.
[4]张晓慧,李光韬,张卓莉.C反应蛋白与超敏C反应蛋白的检测及其临床意义[J].中华临床免疫和变态反应杂志,2011,5(1):74-79
[5]Eisenhardt SU,Thiele JR,Bannasch H,et al.C-reactive protein:how conformational changes influence inflammatory properties[J].Cell Cycle,2009,8(23):3885-3892.
[6]王金和,程佩兰.C反应蛋白的临床研究进展[J].国外医学临床生物化学与检验学分册,2004,5(25):471-473.
[7]Duclos TW.Function of creactive protein[J].Annals of Medicine,2000,32(4):274-278.
[8]Volanakis JE.Human C-reactive protein:expression,strure,and function[J].Molecular Immunolony,2001,38(2-3):189-197.
[9]张新军,章茂顺.C反应蛋白作为急性冠脉综合征的危险预测因子[J].国外医学:临床生物化学与检验学分册,2002,23(3):173-175.
[10]钟文军.血清肌红蛋白、心肌肌钙蛋白I和超敏C反应蛋白联合检测对急性心肌梗死患者的诊断价值[J].临床和实验医学杂,2011,10(15):1144-1145.
[11]宋娜,张家云,余小红,等.两种检测方法测定C反应蛋白的比较[J].检验医学,2012,4(27):257-260.
[12]Yang Q,Gong X,Song T,et al.Quantum dot-based innunochromatography test strip for rapid,quantitative and sensitive detection of alpha fetoprotein[J]. Biosentsors&Bioelectronics,2011,30(1):145-150.
[13]Peng X.Schlamp MC,Alivisatos AP,et al.Epitaxial growthofhighlyluminescentCdSe/CdSCore/ Shell nanocrystals with photostability and electronic accessibility[J].Journal of the American Chemical Society,1997,119(30),7019-7029.
[14]Bruchez M Jr,Moronne M,Gin P,Weiss S,Alivisatos AP.Semieonduetor nanocrystals as fluorescent biologicallabels[J].Seience,1998,281(5385):2013-2016.
[15]Caroline S.Quantum dots get wet[J].Seience,2003,4(300):80-81.
[16]Wu X,Liu H,Liu,et al.Immunofluorescent labeling of cancer marker her2 and other cellular targets with semiconductor quantum dots[J].Nature Biotechnology,2003,21(1):41-46.
[17]钟晓骝.心肌损伤免疫荧光检测方法及试剂卡[D].长春:长春理工大学,2016
Quantitation Determination of CRP in Serum with Fluorescence Immune Chromatography
For rapid detection of human acute inflammatory response,a fluorescence immuno-chromatographic analysis method of double monoclonal antibody sandwich ELISA was developed,which based on quantum dots of cadmium telluride(CdTe),for the rapid and quantitative detection of inflammatory marker C-reactive protein(CRP)in serum.In this work,at first,capture antibody and labeled antibody for CPR detection were screened by ELISA.Second,CdTe quantum dots and CRP murine monoclonal antibodies were covalent binding by N-hydroxysuccinimide(NHS)and 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride(EDC),as well as the best condition of covalent binding was optimized and identified by agarose gel electrophoresis.After that,fluorescent immuno-chromatographic test strip for CPR rapid detection was prepared.In addition,the quantitative relationship between the quantum dot fluorescence intensity and the concentration of CRP standard was established,the results showed that the linear range of quantitative determination of CRP test strip was from 0.1 to 1000ng/ml,the experimental test strip and commercial reagents were used in clinical serum samples detection,the results showed a good correlationship.In a word,this work can provide valubale basis for the rapid diagnosis of acute inflammatory reactions and the development of fluorescence immunoassay chromatography test strip.
CRP;quantum dot;fluorescence immunoassay chromatography;quantitation determination
R375
A
1672-9870(2016)06-0129-05
2016-07-19
吉林省科技发展计划项目(20140309013YY)
葛宇新(1971-),女,本科,主管护士,E-mail:837349751@qq.com
张昊(1985-),女,博士,讲师,E-mail:853287300@qq.com
GE Yuxin1,DING Qiuyu2,ZHONG Xiaoliu2,LI Huichao3,LIU Qian3,SHI Xinyu3,ZHAO Jingjing3,YU Yuanhua3,ZHANG Hao3
(1.Hospital of Changchun University of Science and Technology,Changchun 130022;2.School of Chemistry and Environmental Engineering,Changchun University of Science and Technology,Changchun 130022;3.School of Life Science and Technology,Changchun University of Science and Technology,Changchun 130022)
