鸡新城疫-传染性支气管炎-传染性法氏囊病三联灭活疫苗安全性及效力试验
2016-02-07沈佳姜北宇章振华李林史爱华叶丽娜张建伟
沈佳,姜北宇,章振华,李林,史爱华,叶丽娜,张建伟
(北京市农林科学院畜牧兽医研究所,北京100097)
鸡新城疫-传染性支气管炎-传染性法氏囊病三联灭活疫苗安全性及效力试验
沈佳,姜北宇,章振华,李林,史爱华,叶丽娜,张建伟*
(北京市农林科学院畜牧兽医研究所,北京100097)
为评价以悬浮培养制备的鸡传染性法氏囊病毒(IBDV)抗原液为组份之一的鸡新城疫(ND)-传染性支气管炎(IB)-传染性法氏囊病(IBD)三联灭活疫苗的安全性及效力,实验室制备3批疫苗,按照《中国兽药典》附录对疫苗进行物理性状、无菌检验、安全及效力试验。结果显示3批次疫苗物理性状、无菌检验均合格;2倍剂量注射21日龄的SPF鸡,14 d后剖检注射部位未见炎症反应,疫苗吸收良好,说明疫苗安全;疫苗免疫SPF鸡后21 d, ND和IB 血凝抑制(HI)抗体,IBD中和抗体均合格,攻毒实验证明,免疫鸡10/10保护,对照鸡5/5发病或死亡。表明以悬浮培养制备的IBDV抗原液生产的三联灭活疫苗安全有效。
鸡新城疫;传染性支气管炎;传染性法氏囊病;三联灭活苗;效力
鸡新城疫(Newcastle Disease, ND)、传染性支气管炎(Infectious Bronchitis, IB)和传染性法氏囊病(Infectious Bursa Disease, IBD)是目前危害我国养禽业发展的三种重要病毒性传染病,给养禽业造成巨大的经济损失。控制这3种家禽疫病的有效手段是进行疫苗的免疫接种[1-3]。传统的IBDV抗原制备的采用鸡胚成纤维细胞(CEF)进行增殖[4], ND La Sota株和IB M41株抗原液采用鸡胚接种,收获鸡胚尿囊液获得,抗原液经过灭活和超滤浓缩后按一定比例混合,制成三联灭活疫苗[5-6]。传统的IBDV抗原液制备方法工艺繁杂,滴度不高,为了提高IBDV抗原液的病毒滴度,我们引入DF-1细胞[7]替代CEF细胞,利用生物反应器悬浮培养DF-1细胞生产IBDV抗原,并以此为组分之一制备了3批新支法三联灭活疫苗,并对3个批次的ND-IB-IBD三联灭活疫苗进行安全性及效力评价。
1 材料与方法
1.1 材料
1.1.1 抗原制备用病毒株 NDV La Sota株:由中国兽药监察所保存,经SPF鸡胚增殖复壮, HA效价为1∶29~1∶210,毒价为109.0EID50/0.1 mL;IBV M41株:由中国兽药监察所引入冻干毒,经SPF鸡胚增殖复壮为毒种,毒价为106.5EID50/0.1 mL;IBDV BJQ902株由本研究室1990年野外分离[8],经SPF鸡胚增殖复壮和CEF细胞传代适应,最后在DF-1细胞继续传代,建立IBDV DF-1适应毒种,毒价为107.5~108.5TCID50/0.1 mL。
1.1.2 攻击用强毒株 NDV北京株,毒价为108.3ELD50/0.1 mL; IBDV BJQ902囊毒株,毒价为106.0BID50/0.2 mL。
1.1.3 DF-1细胞株 购自上海艾研生物科技有限公司,由本研究室传代保存。
1.1.4 鸡胚与试验鸡 10日龄SPF鸡胚和21日龄SPF鸡,购自北京实验动物中心。SPF鸡胚用于毒种繁殖和毒价测定,SPF鸡用于动物实验。
1.1.5 主要试剂耗材 Cytodex 1微载体(General Electric);DMEM高糖培养基;FBS胎牛血清(GIBCO);细胞培养瓶(美国康宁);硫乙醇酸盐培养基(TG)、酪胨琼脂(GA)、葡萄糖蛋白胨培养基(GP)(北京中海生物科技有限公司);10号注射用白油(中国石化集团杭州炼油厂生产);司本80、吐温80(自上海大众制药厂生产)。
1.1.6 主要仪器设备 孵化器(北京海江);隔离器(天津津航);NBS 115 2L生物反应器(Eppendorf);ClassⅡA2生物安全柜(新加坡ESCO);锥形板粘度计(美国博勒飞);HF90 CO2培养箱(香港利康);Centrifuge 5417R 台式离心机(Eppendorf);高压灭菌锅(日本三洋);JTMS0-ABI型胶体磨(沈阳新光机械厂制造)
1.2 方法
1.2.1 抗原液制备
1.2.1.1 NDV La Sota株病毒抗原液的制备 将种毒用生理盐水作1000倍稀释,经尿囊腔途径接种10日龄SPF鸡胚, 每批次大约接种600枚,0.1 mL/胚,接种后在37 ℃下继续孵化,定期照蛋,弃去24 h内的死胚,收获24 h~120 h的死胚及120 h活胚尿囊液,测定尿囊液的HA效价及EID50,抗原液置-20 ℃冰箱中备用。
1.2.1.2 IBV M41株病毒抗原液的制备 将种毒用生理盐水作100倍稀释,经尿囊腔途径接种10日龄SPF鸡胚, 0.1 mL/胚,接种后在37 ℃下继续孵化,定期照蛋,弃去接种后24 h内的死胚,将48 h的活胚置-4 ℃冰箱冷冻过夜,收获尿囊液,测定EID50,置-20 ℃冰箱中备用。
1.2.1.3 IBDV BJQ902病毒抗原液的制备 2 L反应器中加入3~4 g处理好的微载体(经无Ca2+、Mg2+的PBS缓冲液浸泡过夜,115 ℃高压灭菌30 min)以及1.5 L含5% FBS的高糖DMEM,设定温度37 ℃,溶氧DO 40%,搅拌速度50 r/min。取18个已贴壁长满DF-1的T225细胞瓶,胰酶消化,无菌条件下接种到反应器中,培养24~36 h后,取样显微镜观察,细胞完全长满载体表面即可接种病毒。将种毒参照杨霞等[9]的方法按0.005 MOI接种含2% FBS高糖DMEM的病毒维持液,培养36 h收获病毒液,置-20 ℃冰箱中备用并测定TCID50。
1.2.2 抗原液的浓缩、灭活和灭活检验
1.2.2.1 病毒液的浓缩和灭活 利用姜北宇等[10]介绍的方法将检验合格的NDV和IBV病毒抗原液浓缩至原体积的1/4,IBDV抗原液不浓缩。浓缩抗原液以及未浓缩的IBDV抗原液加入最终浓度为2 mL/L 甲醛溶液置37 ℃恒温摇床内灭活16 h。分别对灭活后的病毒液取样,进行灭活检验。
1.2.2.2 灭活检验 NDV和IBV抗原液的灭活检验均是取灭活后的病毒液经尿囊腔接种10日龄SPF鸡胚,每种毒液接种10枚,0.2 mL/胚。37 ℃下孵育,定期照蛋,剔除24 h内死亡鸡胚,观察5 d。5 d后接种NDV的鸡胚收获尿囊液进行HA试验,若病毒液HA均为阴性时将毒液混合后盲传1代,再收获鸡胚尿囊液进行HA试验;接种IBV的鸡胚5 d后取出逐个剖检。IBDV抗原液的灭活检验是取灭活后的病毒液经鸡胚绒毛尿囊膜接种10日龄SPF鸡胚,共接种10枚,0.2 mL/胚,37 ℃孵育,定期照蛋,剔除24 h内死亡鸡胚,观察5 d,5 d后取出逐个剖检,记录阳性鸡胚数。
1.2.3 灭活疫苗的制备 将经过浓缩灭活的NDV、IBV抗原液以及未浓缩的IBDV抗原液按1∶1∶1的比例混合,以吐温80及司本80为乳化剂,10号白油为佐剂,使用胶体磨制备油包水型疫苗,油水比为2∶1。乳化时开启胶体磨,将油相倒入胶体磨料斗,然后缓慢加入油相的 1/2水相,进行预混,再将胶体磨间隙调小并提高胶体磨转速乳化2.5 min,即可制备出稳定的w/o疫苗。
1.2.4 疫苗的检验
1.2.4.1 物理性状 观察疫苗外观情况;取一清洁吸管,吸取少量疫苗滴入水中,观察疫苗扩散情况;取样1 mL采用锥形板粘度计测定;取疫苗5 mL,装于离心管中,以3500 r/min离心15 min,观察疫苗分层情况。
1.2.4.2 无菌检验 取灭活苗1 mL接种用50 mL TG培养基中,置37 ℃,培养3 d。然后对培养物进行移植,分接种TG小管和GA斜面各2支,每支0.2 mL,一支置37 ℃,另一支置25 ℃。另外再取0.2 mL接种1支GP小管,置25 ℃,均培养5 d,观察有无细菌生长[11]。
1.2.4.3 安全性检验 21日龄SPF雏鸡10只,各胸肌注射疫苗0.6 mL(双倍剂量),观察14 d,观察期结束后扑杀试验鸡,进行解剖,观察疫苗局部吸收情况及鸡只各脏器的变化。
1.2.4.4 ND效力检验 21日龄SPF鸡40只,其中免疫组3组,每组10只,健康对照和攻毒对照各5只。免疫组分别用3批三联灭活疫苗免疫,胸肌注射20 μL/只。接种后3周对所有鸡只采血,分离血清测ND HI抗体。采血后30只免疫鸡和5只攻毒对照鸡用NDV强毒北京株攻毒,肌肉注射105.0ELD50/只,剩余5只鸡作为健康对照,观察鸡只临床症状14 d。
1.2.4.5 IB效力检验 21日龄SPF鸡35只,其中免疫组3组,每组10只,健康对照5只。免疫组30只鸡用H120活疫苗经滴鼻途径做基础免疫,1 羽份/只,基础免疫3周后,采血待测IB HI抗体,采血后,分别用3批三联灭活疫苗胸肌注射免疫,0.3 mL/只。灭活苗免疫后3周,采血分离血清,连同灭活苗免前血清一起测定IB HI抗体。1.2.4.6 IBD效力检验 21日龄SPF鸡40只,其中免疫组3组,每组10只,健康对照和攻毒对照各5只。免疫组分别用3批三联灭活疫苗免疫,胸肌注射疫苗0.3 mL/只。疫苗接种4周后对所有鸡只采血,分离血清测定IBD中和抗体[12],采血后免疫组鸡连同攻毒对照鸡5只滴鼻及口服途径攻击IBDV BJQ902株法氏囊强毒,0.2 mL/只(含毒106.0BID50),攻毒后观察3 d,记录发病及死亡数,扑杀存活鸡,逐只剖检,观察记录法氏囊等病理变化。
2 结 果
2.1 抗原液制备、浓缩和灭活检验结果
2.1.1 NDV La Sota抗原液制备、浓缩和灭活检验结果 将3批NDV La Sota株病毒抗原液浓缩至原体积的1/4,病毒的HA效价由1∶29~1∶210上升1∶211~1∶212,提高了两个滴度,病毒含量则由为108.3~108.5EID50/0.1 mL上升到108.9~109.1EID50/0.1 mL;灭活的抗原液接种10日龄鸡胚进行检验,均为阴性。结果见表1。

表1 NDV La Sota 抗原液生产及检验结果
2.1.2 IBV M41抗原液制备、浓缩和灭活检验结果 将3批IBV M41株病毒抗原液浓缩至原体积的1/4,病毒含量由为106.3~106.7EID50/mL上升到106.7~107.1EID50/mL,提高了两个滴度;灭活的抗原液接种10日龄鸡胚进行检验,均为阴性。结果见表2。
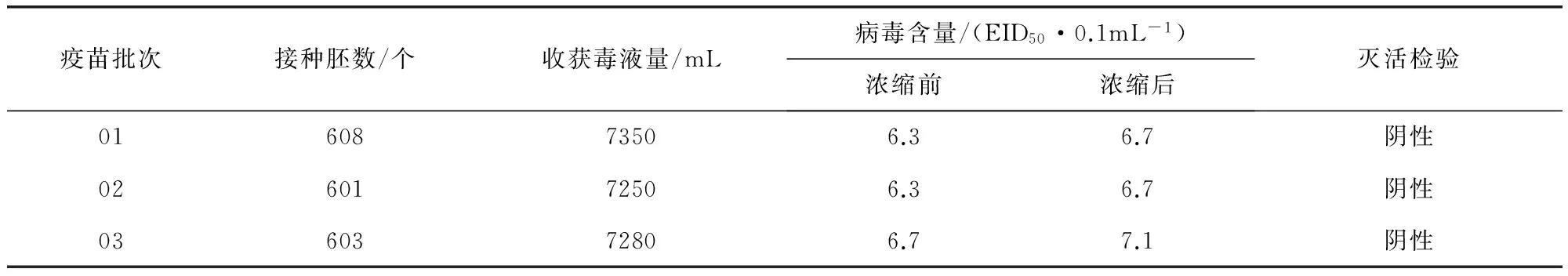
表2 IBV M41抗原液生产及检验结果
2.1.3 IBDV抗原液制备及检验结果 将3批采用DF-1细胞悬浮培养工艺制备的IBDV抗原液进行病毒含量测定,病毒含量为108.1~108.5TCID50/0.1 mL。进行灭活检验,结果均为阴性。表结果见表3。

表3 IBDV抗原液生产及检验结果
2.2 疫苗物理性状和无菌检验结果 制备的3个批次的ND-IB-IBD三联灭活疫苗均为乳白色油乳剂,剂型为油包水,黏度测量值为78~80 cP,3500 r/min离心15 min,底部出水均在0.5 mm 以下或不分层,疫苗无菌检验为阴性。所有检验结果都符合标准。
2.3 疫苗的安全性实验结果 采用实验室制备的3批ND-IB-IBD三联灭活疫苗,以双倍剂量(0.6 mL)接种21日龄SPF鸡。结果证明,采用3批三联苗经皮下和肌肉接种途径接种21日龄的SPF雏鸡,10只免疫试验鸡均精神良好、饮食正常,注射部位未见异常情况,鸡只生长发育正常,均未引起任何局部及全身反应;剖检试验鸡,注射部位无肿胀、溃烂等异常反应,疫苗吸收良好。
2.4 疫苗的效力试验结果
2.4.1 ND-IB-IBD三联苗ND部分效力试验 3批疫苗免疫接种3周后采血测ND HI抗体,免疫组抗体平均滴度为4.1~4.3 log2;对照组抗体平均滴度为2.4 log2。免疫鸡连同对照鸡用NDV强毒北京株攻击,每只肌肉注射105.0EID50,免疫组攻毒保护率均是100%;攻毒对照组全部死亡。结果见表5。

表5 三联苗ND部分效力试验结果
*保护率=(攻毒对照阳性率-免疫组阳性率)/攻毒对照阳性率×100%
2.4.2 ND-IB-IBD三联苗IB部分效力试验 用H120活疫苗经滴鼻途径免疫21日龄SPF鸡, H120免后3周IB HI抗体达到4.2~4.6 1og2(1∶18~1∶24),三联苗加强免疫后3周, IB HI抗体明显上升,达7.2~8.4 log2(1∶147~1∶337),是免疫前的3倍以上。

表6 三联苗IB部分效力试验结果
2.4.3 ND-IB-IBD三联苗IBD部分效力试验 3批疫苗免疫接种4周后采血测IBD中和抗体结果见表7,免疫组中和抗体滴度分别为26606、25983及27622,对照组中和抗体滴度为0。对照组攻毒后鸡只精神萎顿,羽毛松乱,剖检发现法氏囊水肿、出血或者黄化等病理变化,5/5阳性,免疫组10/10鸡未出现任何法式囊病的临床和剖检的病理变化。

表7 三联苗IBD部分效力试验结果
*保护率=(攻毒对照阳性率-免疫组阳性率)/攻毒对照阳性率×100%
3 讨论与小结
由于传代细胞具有无外源因子污染、易于规模化培养等优点,因此利用其作为细胞基质培养病毒制备的抗原具有纯净和免疫原性高的特点,接种后不良反应轻,较为安全,伴随着生物反应器技术在过去的20年内的快速腾飞, 大规模培养动物细胞是当前各大生物公司产业化生产疫苗的首要选择[13]。百特疫苗2002年利用Vero细胞生产流感疫苗,诺华公司通过MDCK细胞培养技术生产出甲型HIN1流感疫苗,利用33016-PF细胞生产流感疫苗[14]等。很多基于该项工艺的疫苗不断问世,也在不断启发着我们,是不是可以对现有的疫苗工艺进行升级改造?此前本研究室制备的鸡传染性法氏囊疫苗是利用1990年从北京地区某鸡场发病鸡群分离到的超强毒株,经SPF鸡胚传代复壮后,又在鸡胚成纤维细胞(CEF)上继续传代,最后培育而成的细胞适应株,毒价在106.5~7.5TCID50/0.1 mL,经过浓缩后制成疫苗。本次试验的IBDV抗原是采用IBDV BJQ902毒株经过DF-1细胞适应后感染生物反应器悬浮培养的DF-1细胞培养所收获的病毒液,IBDV种毒毒价≥107.5TCID50/0.1 mL,制备的抗原液毒价达到108.1~8.5TCID50/0.1 mL,抗原液的病毒含量不经浓缩即达到了用SPF鸡胚制备CEF原代细胞所制备抗原液的毒价,不经浓缩即可用于疫苗制备。
采用DF-1细胞悬浮培养的方法制备IBDV抗原液,并结合传统方法采用鸡胚接种病毒制备的NDV和IB抗原液,共制备了3个批次的ND-IB-IBD三联灭活疫苗样品。在疫苗效力检验方面,IB部分通过先用H120活疫苗做基础免疫,再用试验用灭活苗加强免疫,IB HI抗体明显上升,由4.2~4.6 1og2(1∶18~1∶24),达7.2~8.4 log2(1∶147~1∶337)是免疫前的3倍以上,符合药典的标准。ND部分的效力检验均采用测定免疫后血清抗体的高低来进行评价,其中ND部分免3周后,免疫组HI平均几何滴度≥4 log2,对照组≤2 log2,符合药典的标准。IBD部分免后4周,中和抗体平均滴度均1∶20000以上远远高于药典的1∶5000。攻毒试验证明,3批疫苗免疫组的攻毒保护率均为100%。
结果证明,采用应用生物反应器悬浮培养DF-1细胞生产鸡传染性法氏囊病毒抗原液的新工艺可以替代传统的CEF原代细胞制备IBDV抗原工艺,疫苗的免疫效果完全可以达到兽药典中IBD部分的标准。应用此工艺制备出的ND-IB-IBD三联灭活疫苗对ND和IB部分的免疫效力无影响,且更加符合我国家禽市场需求,减少接种次数,免疫一次即可有效控制三种传染病的发生与流行,降低鸡群的应激反应,保证了农民的增收致富。
[1] SAIL B W. 禽病学[M]. 高福, 苏敬良, 索勋, 主译. 第12版. 北京: 中国农业出版社, 2012: 210-239.
[2] 殷震, 刘景华. 动物病毒学[M]. 北京: 科技出版社, 1997: 652-664.
[3] Lasher H N, Shane S M. Infectious bursal disease [J]. World Poult Sci J, 1994, 50: 133-166.
[4] 李大山, 方红梅, 吴金, 等. 鸡新城疫、传染性支气管炎、传染性法氏囊病三联活疫苗的研究[J]. 中国兽药杂志, 2002, 36(9):22-24.
[5] 马增军, 李建国, 陈翠玲,等. 鸡新城疫-减蛋综合征-传染性法氏囊病三联油乳剂灭活疫苗的研究[J]. 中国兽药杂志, 2002, 36(2): 30-32.[6] 张建伟, 李林, 章振华, 等. 鸡新城疫-传染性支气管炎-H9亚型禽流感三联灭活疫苗的制备及检验[J]. 安徽农业科学, 2011, 39(14): 8617-8618.
[7] Himly M, Foster D N, Bottoli I,etal. The DF-1 chicken fibro-blast cell line; Transformation induced by diverse oncogenes andcell death resulting from infection by avian leukosis viruses [J]. Virology, 1998, 248: 295-304.
[8] 郑世兰, 刘福致. 鸡传染性法氏囊病病原的分离, 细胞毒的培育与鉴定[J]. 中国兽医杂志, 1994, 20(11): 12-14.
[9] 杨霞, 周欣, 陈陆, 等. 鸡IBDV在微载体微型反应器DF-1细胞系上繁殖特性研究[J]. 中国兽医学报, 2013, 33(10): 1519-1526.
[10]姜北宇, 刘月焕, 景小冬, 等. 禽用疫苗病毒浓缩技术的研究[J]. 华北农学报, 2007, 22(5):165-171.
[11]中国兽药典委员会. 兽用生物制品质量标准汇编(2004-2006)[S]. 北京: 中国农业科技出版社, 2006: 51-53.
[12]李林, 景小冬, 章振华, 等. 鸡传染性法氏囊病灭活疫苗免疫鸡中和抗体效价与攻毒保护力的相关关系[J]. 中国兽医科学, 2011, 41(7): 717-722.
[13]Tree J A, Richardson C, Fooks A R,etal. Comparison of large-scale mammalian cell culture systems with egg culture for the production of influenza virus A vaccine strains[J]. Vaccine, 2001, 19(25/26): 3444-3450.
[14]Reisinger K S, Block S L, Izu A,etal. Subunit influenza vaccines produced from cell culture or in embryonated chicken eggs: comparison of safety, reactogenicity, and immunogenicity [J]. The Journal of Infectious Diseases, 2009, 200(6): 849-857.
(编辑:李文平)
Safety and Efficacy Test to the Newcastle Disease,Infectious Bronchitis and Infectious Bursal Disease Trivalent Inactivated Vaccine
SHEN Jia, JIANG Bei-yu, ZHANG Zhen-hua, LI Lin, SHI Ai-hua, YE Li-na, ZHANG Jian-wei*
(InstituteofAnimalHusbandryandVeterinaryMedicine,BeijingAcademyofAgricultureandForestrySciences,Beijing100097,China)
The purpose of this study is to evaluate the safety and efficacy of the newcastle disease, infectious bronchitis and infectious bursa disease (suspension cultured antigen) trivalent inactivated vaccine. 3 batches of vaccine were prepared in the laboratory. The physical properties, sterility test, safety and efficacy of the vaccine were tested according to the “Chinese Veterinary Pharmacopoeia”. The results showed that the physical properties, sterile test were all qualified to 3 batches of vaccine. Safety tests showed that no inflammatory response was found at the injection site and the vaccine was absorbed 14 days after double doses vaccine were injected to the 21 day old SPF chicken. Efficacy tests show that ND HI, IB HI titer and IBD neutralizing antibody titer were all qualified to the standard 21 days after vaccination. The challenge tests showed that 10/10 were protected to the immunized chickens and 5/5 were positive to the challenge chickens which had clinical symptoms or died with specific symptoms or lesions. The trivalent inactivated newcastle disease, infectious bronchitis and infectious bursa disease (suspension cultured antigen) vaccine is safe and effective.
newcastle disease; infectious bronchitis; infectious bursa disease; triple inactivated vaccine; efficacy
北京农林科学院一般项目(QNJJ201409)
沈佳,硕士,从事兽用生物制品的工艺改进与研发。
张建伟。E-mail: jweizhang@sina.com
2016-09-21
A
1002-1280 (2016) 12-0001-06
S852.65
