牛副流感病毒3型毒株的分离鉴定及基因组遗传变异分析
2016-02-07孙明李岩刘巧荣张鲁安乔明明李静邓小雨冯向辉刘伯华陈西钊
孙明,李岩,刘巧荣,张鲁安,乔明明,李静,邓小雨,冯向辉,刘伯华,陈西钊*
(1. 北京世纪元亨动物防疫技术有限公司,北京 100094;2. 新疆生产建设兵团畜牧兽医工作总站,乌鲁木齐 830063)
牛副流感病毒3型毒株的分离鉴定及基因组遗传变异分析
孙明1,李岩2,刘巧荣1,张鲁安2,乔明明1,李静2,邓小雨1,冯向辉1,刘伯华1,陈西钊1*
(1. 北京世纪元亨动物防疫技术有限公司,北京 100094;2. 新疆生产建设兵团畜牧兽医工作总站,乌鲁木齐 830063)
从新疆地区某牛场出现发热、咳嗽等症状的多例病牛的肺组织中分离得到3株牛副流感病毒3型,分别命名为XJ03、XJ022、XJ023,对其中两株病毒XJ03和XJ023的基因组进行序列测定,测序结果显示,XJ03和XJ023毒株基因组全长分别为15474 bp(GenBank登录号为KU198929)和15475 bp,其核苷酸同源性为99.89%。同代表性的牛副流感病毒基因组比对发现,与我国的山东毒株SD0835同源性最高为99.3%,均属C型BPIV。在C型毒株中,与南韩12Q061分离株(C型)同源性最低为97.5%。F、N、HN、L、P、M蛋白基因氨基酸序列分析显示,与SD0835毒株相应序列对比,同源性分别为99.63%、92.15% 、99.48%、99.28%、98.50%和100%,部分氨基酸发生了新的变异。试验结果将为今后更好地开展BPIV3防控奠定基础。
牛副流感病毒;分离鉴定;基因组分析
牛副流感病毒3型(Bovine Parainfluenza virus type 3, BPIV3)为单股负链RNA病毒目、副黏病毒科、呼吸道病毒属成员,是引起牛呼吸道疾病综合征的重要病原之一[1-2]。1959年Reisinger等在美国首次分离到BPIV3[3],2002年童泽恩等在国内首次报道了疑似该病的病例[4]。目前该病毒已广泛存在于世界各国。BPIV3感染牛可表现出从隐性感染到严重的呼吸道疾病等多种不同的临床症状,最常见的为咳嗽、发烧、鼻分泌物多。牛感染BPIV3后可引起组织损伤和免疫抑制,常继发细菌或支原体感染引起支气管肺炎而导致牛呼吸道疾病综合征,给养牛业带来严重危害和极大的经济损失。
BPIV3可分为A、B、C三个基因型,在亚洲、澳大利亚、阿根廷、美国等国家或地区均同时存在2个或3个基因型[5-8]。我国也从黑龙江和山东分别分离到A型和C型BPIV3[9-10]。王海勇等[11]对我国12个省份的牛群进行了BPIV3的血清学调查,总体阳性率高达77.6%,表明BPIV3在我国已广泛流行,迫切需求对该病毒进行深入研究以有效防控BPIV3感染。
2014年10月,新疆某牛场的牛群内出现咳嗽、发烧症状,初步怀疑为BPIV3感染,并分离获得三株BPIV3。为进一步分析我国西北地区流行的BPIV的基因特征和变异特征,本研究对该分离株进行鉴定和全基因组测序,并与国内外代表性毒株基因组序列对比分析,以期为该病的流行病学、免疫预防等方面的研究提供相关参考。
1 材料与方法
1.1 材料
1.1.1 病料来源 采集三头疑似BPIV3感染病牛肺作为病毒分离的病料,编号为03、022、023。
1.1.2 细胞和培养基 牛肾细胞(MDBK)为本实验室保存;DMEM购自GIBCO公司;胎牛血清购自新西兰MOREGATE。1.1.3 主要试剂和仪器 RNA提取试剂购自Qiagen公司;AMV Reverse Transcriptase、RNase inhibitor、GoTaq DNA Polymerase购自Promega公司;dNTP购自北京华美生科生物技术有限公司;Trans 2K DNA Marker购自北京全式金生物技术有限公司;TGRANDIENT PCR仪购自HYBAID公司;UVI Firereader XS 凝胶成像系统购自广州市华粤瑞科科学器材有限公司。牛副流感实时荧光RT-PCR检测试剂盒为北京世纪元亨动物防疫技术有限公司生产。
1.1.4 软件信息 DNAMAN 6.0 汉化版,美国Lynnon Biosoft公司开发。
1.2 方法1.2.1 病料的处理 将采集的三份牛肺分别剪碎装入无菌研磨器中研磨,加适量含青霉素、链霉素(各100 U/mL)的DMEM培养液,研磨后于3000 r/min离心10 min,取上清用0.22 μm滤膜过滤除菌。
1.2.2 病毒分离培养 用含8%胎牛血清的DMEM培养基培养MDBK细胞,待细胞长至单层处于对数生长期时,接种上述处理的病料样品,37 ℃吸附1 h,加入含2%胎牛血清的维持液,37 ℃、5% CO2培养箱中培养3~4 d,每天观察细胞病变(CPE),适时传代至出现CPE,当80%的细胞出现CPE时收毒,-80 ℃反复冻融3次后,4000 r/min离心15 min,取上清待检。
1.2.3 病毒鉴定
1.2.3.1 RT-PCR鉴定 按照北京世纪元亨动物防疫技术有限公司生产的牛副流感实时荧光RT-PCR检测试剂盒说明书对MDBK细胞培养物进行鉴定。
1.2.3.2 电镜观察 参考文献方法[12]对细胞培养液进行负染,进行电镜观察。
1.2.3.3 TCID50测定 将收获的第5代病毒上清液用不含血清的DMEM培养基进行稀释,每个稀释度做8个重复,每孔接种100 μL,37 ℃孵育2 h。吸取病毒液,用PBS洗一遍,每孔加200 μL细胞维持液继续在CO2培养箱培养。每天观察记录CPE,5 d后判定结果,同时设阴性对照(维持液)。
1.2.3.4 血凝试验 参考文献方法[12]进行。
1.2.4 全基因组测序与分析
1.2.4.1 引物设计与合成 根据GenBank上发表的BPIV3全基因组序列设计引物(表1),引物由上海捷瑞生物技术有限公司合成。

表1 依据BPIV3基因序列设计的引物
1.2.4.2 病毒总RNA的提取 按照Qiagen的RNA提取试剂盒说明书进行RNA提取。
1.2.4.3 全基因组的扩增 用合成的13对引物分别进行RT-PCR扩增,扩增体系如下:5×Buffer 5 μL(含MgCl2),2.5 mmol/L dNTPs 2 μL,10 μmol/L上游和下游引物2 μL,Taq DNA聚合酶(5 U/μL)1 μL, AMV反转录酶(10 U/μL)0.2 μL,RNA酶抑制剂(40 U/μL)0.3 μL,无菌无核酸酶水12.5 μL,病毒总RNA 2 μL。扩增程序:42 ℃ 60 min,95 ℃ 5 min,95 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min,35个循环,72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶进行电泳。
1.2.4.4 基因的测序 从琼脂糖凝胶中回收目的基因,将目的基因连接到PMD19-T载体,连接产物转化至DH5α感受态细胞,挑取单菌落接种于含氨苄青霉素(100 μg/mL)的LB液体培养基中,37 ℃震荡培养过夜,取菌液进行PCR鉴定,将阳性菌液送北京美吉生物技术有限公司进行测序。根据重叠区域将各片段依次拼接,获得完整基因序列。
1.2.4.5 系统进化分析 用DNAman生物软件将获得的全基因组序列与GenBank上发表的BPIV3序列进行同源性比对分析,构建系统进化树,分析所分离毒株的遗传变异特征。
2 结果
2.1 病毒的分离 将03、022、023分别接种MDBK,72 h后出现CPE,经传代以后出现CPE的时间缩短,从第3代开始病毒趋于稳定。病变初期细胞出现圆缩,随时间延长细胞融合更加明显,出现合胞体(图1A)。对照组细胞培养72h后生长良好,未见细胞发生病变(图1B)。将分离的病毒分别命名为XJ03、XJ022、XJ023。
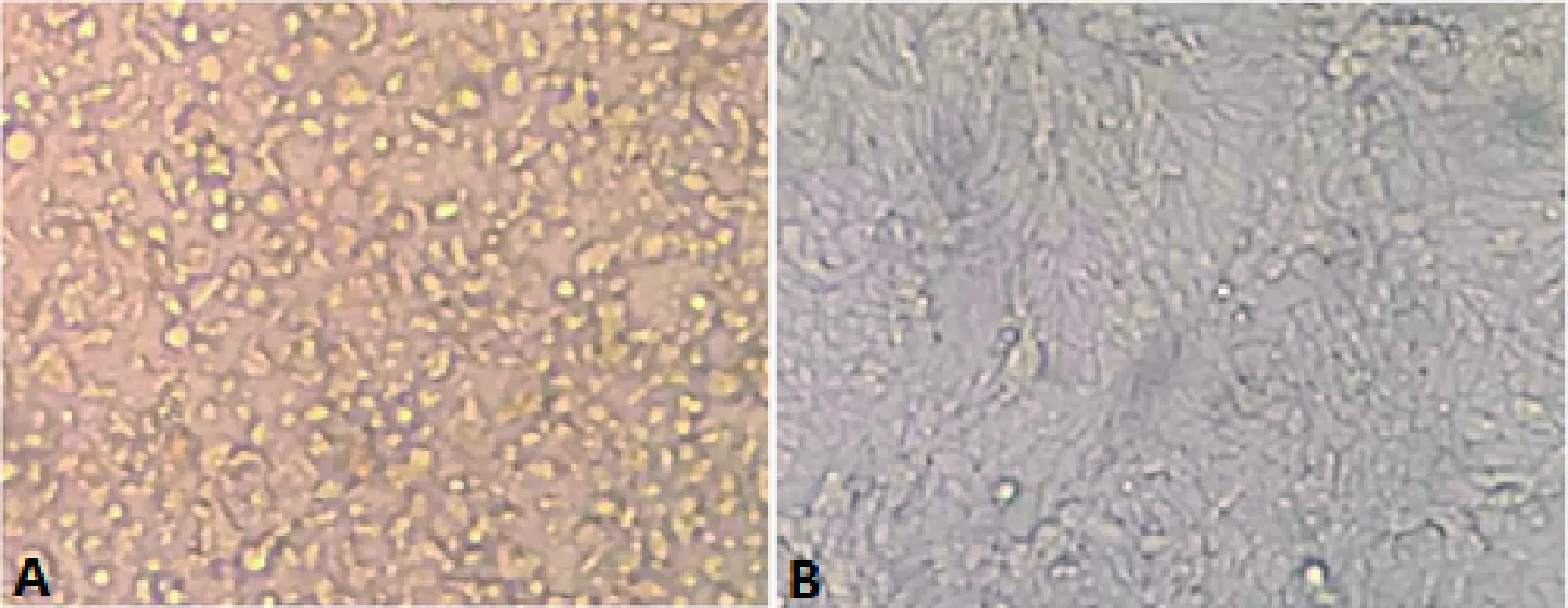
A:接毒后72 h XJ03株感染引起的CPE;B:阴性对照图1 牛副流感病毒分离培养显微观察图(400×)
2.2 病毒鉴定
2.2.1 RT-PCR鉴定 用牛副流感实时荧光RT-PCR检测试剂盒分别对XJ02、XJ022、XJ023进行鉴定,结果为阳性(图2),表明分离的三个病毒均为BPIV3。

1: XJ023;2: XJ03;3: XJ022;4:阳性对照;5:阴性对照图2 XJ02、XJ022、XJ023牛副流感病毒实时荧光RT-PCR检测结果
2.2.2 电镜观察 图3电镜照片显示,BPIV为圆形、椭圆形等不规则形态,有核衣壳,直径约为150~200 nm。
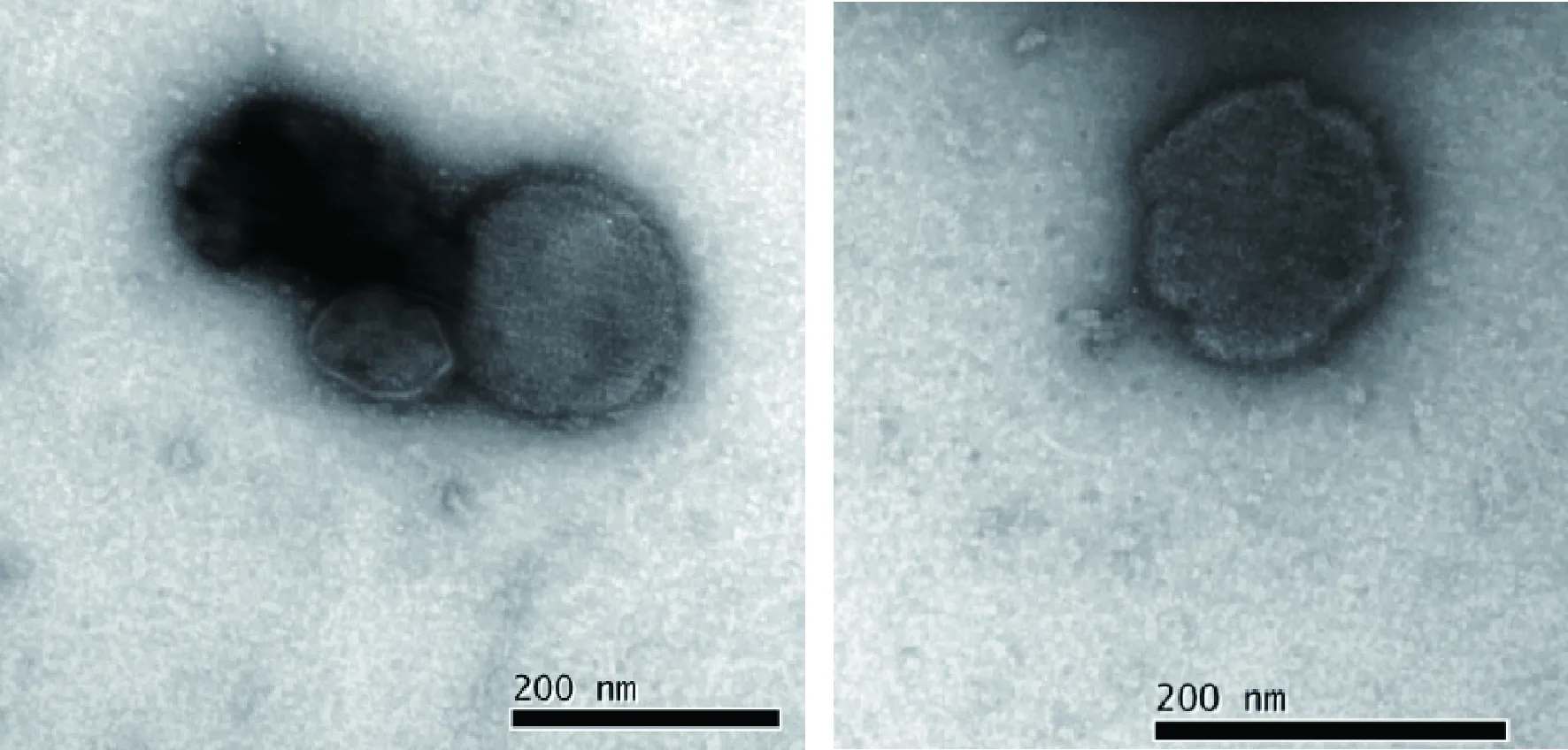
图3 电镜下不同形态的牛副流感病毒粒子(100000×)
2.2.3 TCID50测定 按照Reed-Muench计算法进行计算,第5代细胞毒(XJ03毒株)的病毒含量为107.0TCID50/mL。
2.2.4 血凝试验 分离的牛副流感病毒能凝集鸡和猪的红细胞,XJ03、XJ022、XJ023三株病毒的凝集效价分别达到32和128。
2.3 基因的测序及序列分析 经测序,XJ03和XJ023的基因组全长分别为15474 bp和15475 bp,应用DNAstar将其与有代表性的BPIV3进行同源性比较,结果见图4,分离的两株BPIV3均与12Q061、HS9、TVMDL16同源性较高,与我国的山东毒株SD0835同源性最高,为99.3%。以M基因进行系统进化分析,结果见图5,分离的XJ03和XJ023均与SD0835处于同一分支,属C型BPIV3。XJ03分离株与SD0835毒株相比,F、N、HN、L、P和M氨基酸同源性分别为99.63%、92.15%、99.48%、99.28%、98.50%和100%。
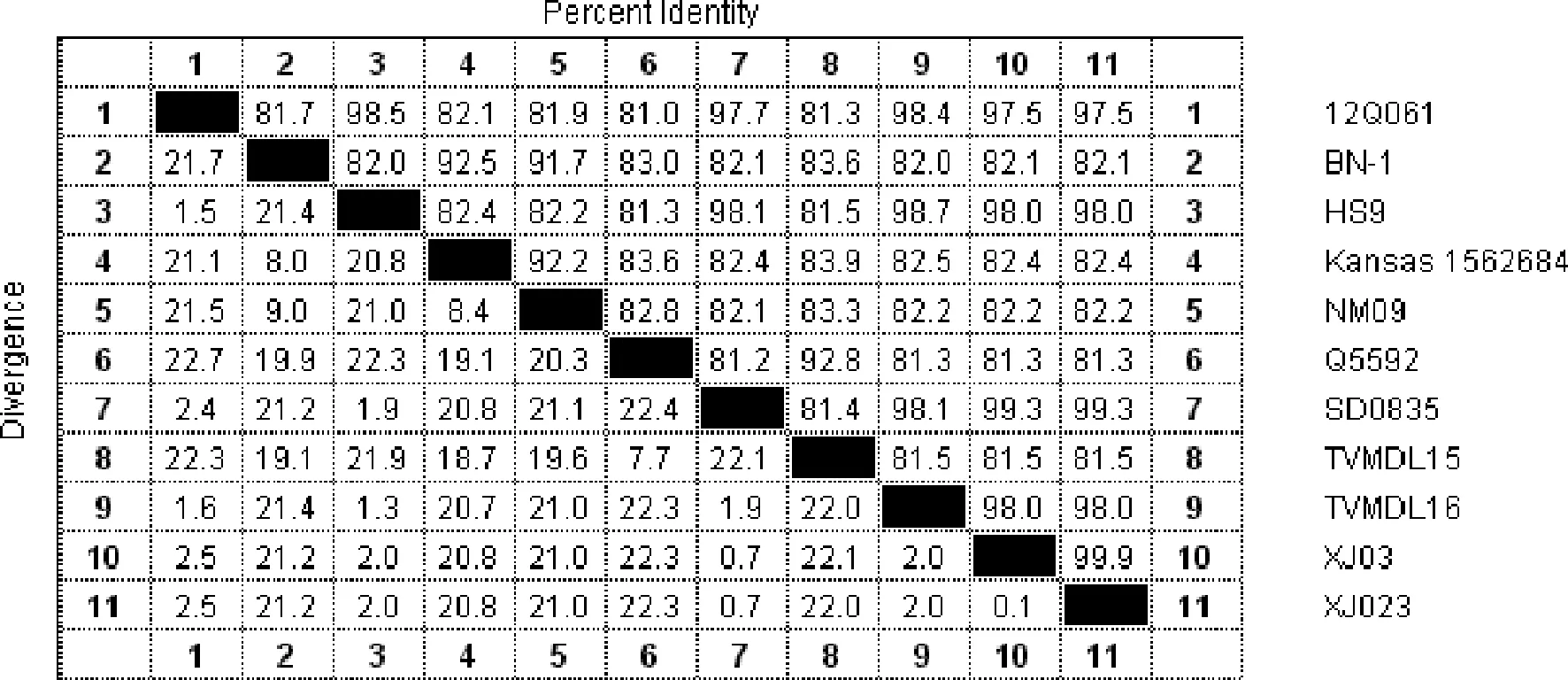
图4 XJ03和XJ023与其他毒株全基因的同源性比较
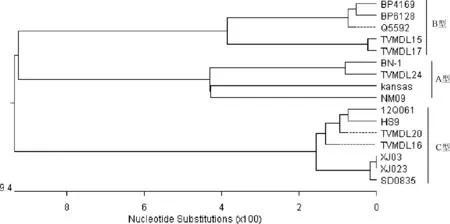
图5 XJ03和XJ023与其他BPIV3代表株的M基因系统进化分析
与SD0835分离株相比,F氨基酸有2处发生了变异,分别为第10位由T变成了I、第522位由S变成了R;HN基因有3处发生了变异,分别是46位由T变成了A,59位由G变成了S,254位由K变成了R;N基因有8处发生了变异,分别是16位由L变成了I,113位由S变成了G,194位由Q变成了R,220位由A变成了S,402位由I变成了S,452位由V变成了A,465位由N变成了D;P基因有9处发生了变异,分别是45位由V变成了A,47位由D变成了V,53位由G变成了E,149位由T变成A,227位由Y变成了H,245位由E变成了D,322位由Y变成了H,329位由L变成了V,339位由I变成了V。
3 讨论
BPIV3是牛呼吸道综合症(也常称为“运输热”)的主要病原之一,也是引起奶牛繁殖障碍的重要病原,是目前全世界范围内危害牛群健康的主要问题,并给养牛业带来了巨大的经济损失。本研究采用MDBK细胞从新疆某牛场出现发烧、咳嗽和流产的病牛肺组织中分离出3株牛副流感病毒。经鉴定该分离株能凝集鸡和猪的红细胞,与董秀梅报道的一致[13]。基因组测序结果显示,XJ03和XJ023的基因全长分别为15474 bp和15475 bp,XJ03基因组序列已经提交到GenBank,登录序列号为KU198929。
BPIV3分A、B、C三个基因型,A型BPIV3主要存在于北美、中国、日本。B型BPIV3最初分离自澳大利亚,最近在美国、阿根廷也发现B型毒株;C型BPIV3分布于中国、韩国、日本。之前认为美国只存在A型BPIV3,John D. Neill等通过对多个BPIV3美国分离株的全基因测序及系统进化分析发现,美国也同样存在B型和C型BPIV3。通过全基因测序和系统进化分析,本研究从新疆牛场分离到的XJ03和XJ023均为C型BPIV3,与我国山东分离株SD0835同源性为99.3%,系统进化分析也表明所分离毒株与SD0835分离株最近。与SD0835分离株相比,除M 蛋白外,F、HN、N、P和L蛋白氨基酸均发生了新的变异,这些变异是否影响病毒毒力还需进一步研究。
John D. Neill认为各基因型内存在潜在的亚型,并推测亚型与毒株的地域分布相关[14]。经系统进化分析,本研究分离的XJ03和XJ023与山东分离株SD0835形成一单独分支,与韩国分离株12Q061、美国分离株TVMD16等其它C型BPIV3遗传关系较远,这与John D. Neill的观点相符。目前还没有证据表明不同基因型对牛的致病力是否存在差异。但不同基因型的交叉保护效果存在明显差异,如BPIV3 NVSL株的多抗血清对B型和C型BPIV3的中和效价要远远低于对A型BPIV3代表毒株SF-4的中和效价[14];使用单一基因型的疫苗可能达不到理想的保护效果。因此,防控BPIV3的传播还需要多价疫苗的开发。
本研究分离鉴定了三株C型BPIV3,并对其中两株进行了全基因测定,为其在诊断和疫苗开发等方面的进一步研究奠定了基础。
[1] Snowder G D, Van Vleck L D, Cundiff L V,etal. Bovine respiratory disease in feedlot cattle environmental, genetic, and economic factors[J]. J Anim Sci, 2006, 84(8): 1999-2008.
[2] Ellis J A. Bovine parainfluenza-3 virus[J]. Vet Clin North Am Food Anim Pract, 2010, 26(3) : 575-593.
[3] Reisinger, R C, Heddleston, K L, Manthei, C A. Isolation of bovine parainfluenza-3 virus in chick embryos[J]. J Am Vet Med Assoc, 1959, 135(3): 147-152.
[4] 童泽恩, 王锁柱, 郭殿仁, 等. 一起疑似牛副流感的诊断和治疗报告[J]. 中国动物检疫, 2002,19(8): 40.
[5] Zhu Y M, Shi H F, Gao Y R,etal. Isolation and genetic characterization of bovine parainfluenza virus type 3 from cattle in China[J]. Vet Microbiol, 2011, 149(3/4): 446-451.
[6] Horwood P F, Gravel J L, Mahony T J. Identification of two distinct bovine parainfluenza virus type 3 genotypes[J]. J Gen Virol, 2008, 89(7): 1643-1648.
[7] Qiao D, Janke B H, Elankumaran S. Molecular characterization of glycoprotein genes and phylogenetic analysis of two swine paramyxoviruses isolated from United States[J]. Virus Genes, 2009, 39(1): 53-65.
[8] Oem J K, Lee E Y, Lee K K,etal. Molecular characterization of a Korean bovine parainfluenza virus type 3 isolate[J]. Vet Microbiol, 2013, 162(1): 224-227.
[9] 刘鹏, 侯喜林, 周玉龙, 等. 牛副流感病毒3型的分离鉴定[J]. 微生物学通报, 2009, 36(9):1384-1389.
[10]朱远茂, 蔡红, 董秀梅, 等. 我国牛副流感3型山东分离株的研究[C]. 第八届全国会员代表大会第十五次学术研讨会论文集1031-1034.
[11]王海勇, 童钦, 王炜, 等. 我国牛副流感病毒3型血清学调查[J]. 中国预防兽医学报, 2014, 36(2): 154-156.
[12]殷震, 刘景华. 动物病毒学[M]. 第二版. 北京:科学出版社, 1999: 343-354.
[13]董秀梅. 牛副流感病毒3型山东分离株致病性研究及荧光定量RT-PCR的建立[D]. 北京: 中国农业科学院, 2012.
[14]John D, Neill, Julia F,etal. Identification and genome characterization of genotype B and genotype C bovine parainfluenza type 3 viruses isolated in the United States[J]. BMC Veterinary Research, 2015, 112(11): 1-6.
(编辑:李文平)
Isolation, Identification and Genomic Characterization of Bovine Parainfluenza Viruses Type 3
SUN Ming1, LI Yan2, LIU Qiao-rong1, ZHANG Lu-an2, QIAO Ming-ming1, LI Jing2,DENG Xiao-yu1, FENG Xiang-hui1, LIU Bo-hua1, CHEN Xi-zhao1*
(1.BeijingAnhealLaboratoriesCo.,Ltd,Beijing100094,China;2.XinjiangProductionAndConstructionCorps,AnimalHusbandryandVeterinaryWorkStation,Urumqi, 830063,China)
Three strains of bovine parainfluenza viruses type 3(BPIV3) were successfully isolated from lung tissues of sick cattle with symptom of fever and cough emerged at a farm in Xinjiang region, and further identified by SYBR green RT-PCR. Their genome sequences were characterized. Three isolates of BPIV3 in total were obtained and designated as XJ03, XJ022 and XJ023 respectively. Genomic characterization of the two isolate XJ03 and XJ023 showed their whole genome lengths were 15475 bp and 15477 bp respectively, and were phylogenetically most closely related to the BPIV SD0835, with 99.3% identity at nucleotide, they all belong to BIPV3 genotype C. Among isolates of BIPV3 genotype C, the isolates XJ03 and XJ023 exhibited the lowest nucleotide similarity with South Korean 12Q061 strain (97.5%). In comparison to strains SD0835, the F, N, HN, L, P and M protein of isolate XJ03 have 99.63%, 92.15%, 99.48%, 99.28%, 98.50% and 100% amino acid sequence identity to those of SD0835, respectively, and there exist several new amino acid mutations. These results would be helpful for the diagnosis and control of BPIV3.
bovine parainfluenza virus; isolation and identification; genomic characterization
孙明,博士,从事分子病毒学诊断技术研究。
2016-06-28
A
1002-1280 (2016) 11-0017-05
S852.65
