酶解辅助提取陈皮中橙皮苷的工艺优化
2016-02-07宁娜韩建军薛东芳陈彪胡宇莉
宁娜, 韩建军, 薛东芳, 陈彪, 胡宇莉
(1.铜仁职业技术学院药学院,贵州 铜仁 554300;2.贵州省中兽药工程研究中心,贵州 铜仁 554300;3. 西南大学生命科学学院,重庆 400715;4.重庆市动物疾病预防控制中心,重庆 401120)
酶解辅助提取陈皮中橙皮苷的工艺优化
宁娜1,2, 韩建军1,2, 薛东芳3, 陈彪3, 胡宇莉4
(1.铜仁职业技术学院药学院,贵州 铜仁 554300;2.贵州省中兽药工程研究中心,贵州 铜仁 554300;3. 西南大学生命科学学院,重庆 400715;4.重庆市动物疾病预防控制中心,重庆 401120)
为了优化纤维素酶辅助提取陈皮中橙皮苷的工艺,在单因素试验基础上,选取酶解温度、酶解pH值、酶用量、酶解时间作为自变量,以橙皮苷收率为响应值,利用Box-Behnken 中心组合设计原理和响应面分析法,研究各自变量及其相互作用对橙皮苷提取效果的影响,并优化该酶解辅助提取条件。优选得到橙皮苷的最佳酶解辅助提取工艺为:酶解温度50 ℃、酶解pH值5.0、酶用量8.9 mg/g、酶解时间47 min。在此最佳工艺条件下,纤维酶辅助提取橙皮苷的收率为5.24 mg/g,与理论预测值(5.26 mg/g)的相对误差仅为0.38%。优选的提取工艺简单、稳定,为工业化生产提供参考依据。
陈皮;橙皮苷;纤维素酶;乙醇回流法;提取工艺
陈皮为芸香科植物橘CitrusreticulataBlanco及其栽培变种的干燥成熟果皮,其性温味苦、辛,具有理气健脾、燥湿化痰之功效,主治食欲减少、痰湿咳嗽等症[1]。陈皮含有黄酮类、多糖类、挥发油等成分,其中橙皮苷是陈皮的主要药效成分[1-2]。研究表明橙皮苷可改善肉仔鸡小肠粘膜形态结构、促进肉仔鸡肠道对营养物质的吸收[3]、提高肉仔鸡屠宰性能、促进肉仔鸡的免疫器官生长[4]、提高断奶仔猪的免疫机能[5]等作用。
陈皮的传统提取方法有煎煮法[6]、渗漉法[6]、回流法[7]等。酶解辅助提取法是指在传统溶剂法的基础上,利用生物酶降解细胞壁及间质中的成分,破坏植物细胞壁结构,通过降低细胞的渗透阻力促进有效成分的溶出,具有催化效率高、专一性强、反应条件温和等特点[8]。目前已有学者将酶解辅助提取法应用于钩藤中钩藤碱[9]、花生壳中木犀草素[10]、山药中多糖[11]等成分的传统回流提取工艺中,以达到缩短提取时间、提高有效成分收率、减少溶剂用量等目的。本文首次将酶解辅助提取法应用于陈皮中橙皮苷的提取研究,并通过响应面分析法优化该提取工艺,以期为陈皮中橙皮苷的工业化生产提供参考依据。
1 材料与方法
1.1 仪器 Waters 2695高效液相色谱仪,美国Waters公司;pHS-3C精密pH计,上海雷磁仪器厂;BP211D电子天平,北京赛多利斯科学仪器有限公司;KQ-600TDB超声波清洗器,昆山市超声仪器有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂。
1.2 药品与试剂 橙皮苷对照品,中国食品药品检定研究院,纯度为95.3%;陈皮药材,成都荷花池中药材市场,经本院梁玉勇教授鉴定;纤维素酶,宁夏和氏璧生物技术有限公司,酶活力为20000 U/g;水为重蒸水;甲醇为色谱纯,其他试剂均为分析纯。
1.3 方法
1.3.1 橙皮苷的HPLC测定
1.3.1.1 色谱条件 参考《中华人民共和国兽药典》[1],具体色谱条件为:Diomansil-C18柱(4.6 mm×250.0 mm,5 μm);流动相:甲醇-醋酸-水(35∶4∶61);流速:1.0 mL/min;柱温:28 ℃;检测波长:283 nm;进样量:20 μL。该色谱条件下理论塔板数以橙皮苷峰计算不低于2000。
1.3.1.2 橙皮苷的提取 酶解辅助提取陈皮的工艺流程如下:陈皮→干燥、粉碎成粗粉(过40目筛)→酶解→回流提取→合并提取液→减压浓缩至50 mL→测定橙皮苷含量。通过参考文献[7]及结合预试验结果,确定回流提取的工艺条件为:加入20倍量70%乙醇,在75 ℃条件下回流提取60 min。
1.3.1.3 橙皮苷收率的计算 精密吸取陈皮提取液0.1 mL至25 mL容量瓶中,并用甲醇定容至刻度,摇匀,经0.45 μm 滤膜过滤,取续滤液20 μL注入液相色谱仪,记录峰面积,计算橙皮苷收率。橙皮苷收率按如下公式进行计算:橙皮苷收率(mg/g)=提取得到的橙皮苷质量(mg)/陈皮药材质量(g)。
1.3.2 单因素试验
1.3.2.1 酶解温度 准确称取10 g陈皮粉末,加入100 mL柠檬酸-柠檬酸钠缓冲溶液,在酶解pH值 5.0、酶用量9 mg/g、酶解时间50 min的条件下,考察不同酶解温度(40、45、50、55、60 ℃)对橙皮苷收率的影响。
1.3.2.2 酶解pH值 准确称取10 g陈皮粉末,加入100 mL柠檬酸-柠檬酸钠缓冲溶液,在酶解温度 50 ℃、酶用量9 mg/g、酶解时间50 min的条件下,考察不同酶解pH值(4.0、4.5、5.0、5.5、6.0)对橙皮苷收率的影响。
1.3.2.3 酶用量 准确称取10 g陈皮粉末,加入100 mL柠檬酸-柠檬酸钠缓冲溶液,在酶解温度 50 ℃、酶解pH值 5.0、酶解时间50 min的条件下,考察不同酶用量(5、7、9、11、13 mg/g)对橙皮苷收率的影响。
1.3.2.4 酶解时间 准确称取10 g陈皮粉末,加入100 mL柠檬酸-柠檬酸钠缓冲溶液,在酶解温度 50 ℃、酶解pH值 5.0、酶用量9 mg/g的条件下,考察不同酶解时间(10、30、50、70、90 min)对橙皮苷收率的影响。
1.3.3 响应面法优化试验 在单因素试验基础上,根据Box-Behnken中心组合设计原理,以橙皮苷收率为考察指标,对酶解温度、酶解pH值、酶用量、酶解时间进行4因素3水平试验,具体试验因素水平安排见表1。
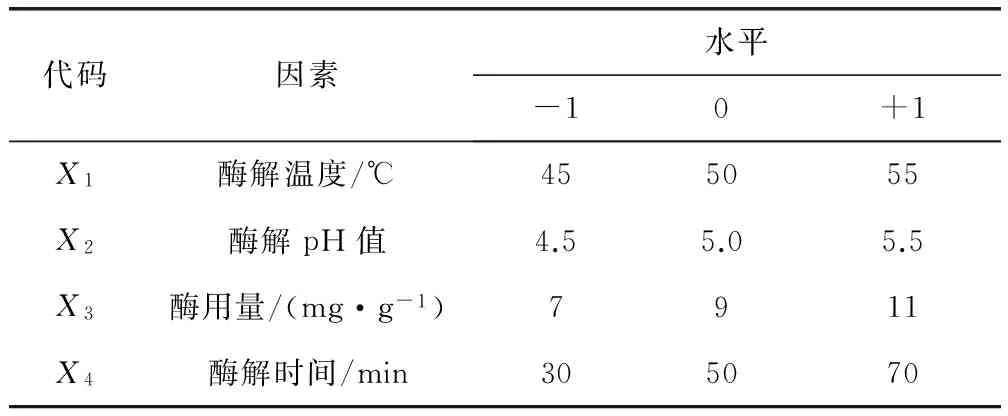
表1 Box-Behnken设计因素及水平
1.3.4 不同提取方法对橙皮苷收率的影响 平行比较传统回流提取法和酶解辅助提取法对陈皮中橙皮苷提取的影响。其中传统回流提取法的具体提取操作为: 准确称取10 g陈皮粉末,加入100 mL柠檬酸-柠檬酸钠缓冲溶液,在提取pH值为 5.0、提取温度为50 ℃的条件下提取47 min后收集滤液,向药材中加入20倍量70%乙醇,在75 ℃条件下回流提取60 min,合并滤液并减压浓缩至50 mL,经过适当稀释后取续滤液按照1.3.1项下色谱条件进行HPLC测定,并计算橙皮苷收率。酶解辅助提取法的具体操作为:准确称取10 g陈皮粉末,加入100 mL柠檬酸-柠檬酸钠缓冲溶液,在酶解温度50 ℃、酶解pH值5.0、酶用量8.9 mg/g的条件下酶解时间47 min收集滤液,向药材中加入20倍量70%乙醇,在75 ℃条件下回流提取60 min,合并滤液并减压浓缩至50 mL,经过适当稀释后取续滤液按照1.3.1项下色谱条件进行HPLC测定,并计算橙皮苷收率。
2 结果与分析
2.1 橙皮苷的HPLC测定结果 在1.3.1.1项色谱条件下测定橙皮苷对照品及陈皮药材得到的结果图见图1。峰面积Y与小檗碱浓度X(μg/mL)的回归方程为:Y=133592.06X-12001.40(R2=0.9999),线性范围为:8.64~51.84 μg/mL。
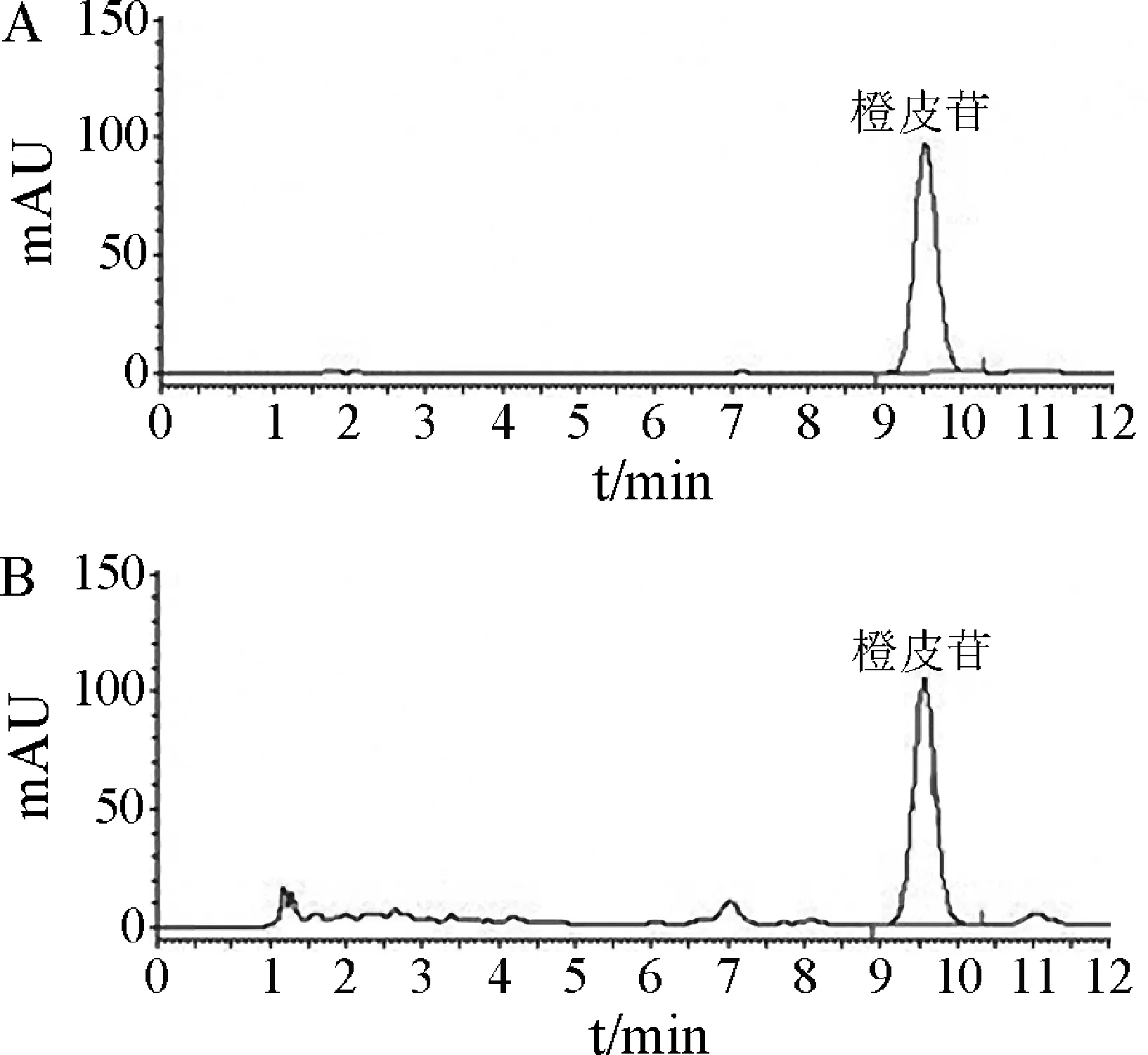
图1 橙皮苷对照品(A)和陈皮药材(B)的HPLC图
2.2 单因素试验结果
2.2.1 酶解温度 酶解温度对橙皮苷收率的影响见图2。由图2可知,橙皮苷收率随着酶解温度的升高先增大后减小。当酶解温度为50℃时,橙皮苷收率最大。
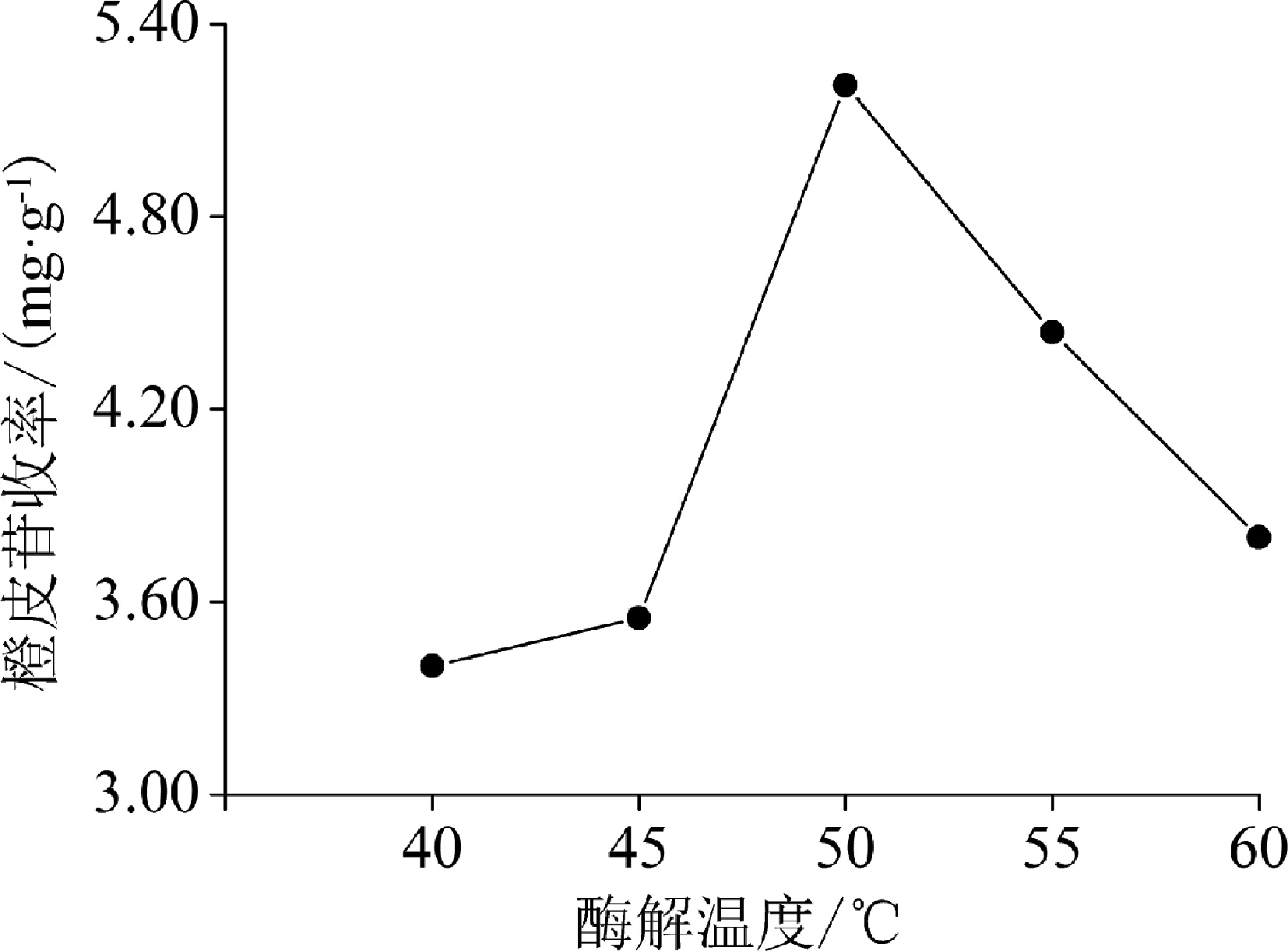
图2 酶解温度对橙皮苷收率的影响
2.2.2 酶解pH值 不同酶解pH值对橙皮苷收率的影响见图3。由图3可知,橙皮苷收率随着酶解pH值的增大先增大后减小。酶解pH值为5.0时,橙皮苷收率最大。
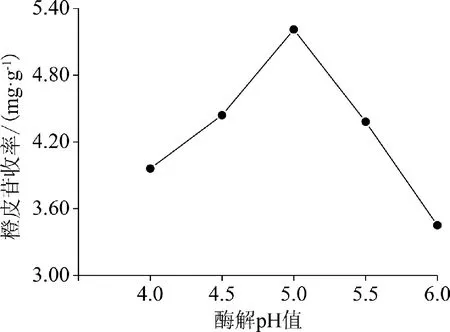
图3 酶解pH值对橙皮苷收率的影响
2.2.3 酶用量 不同酶用量对橙皮苷收率的影响见图4。由图4可知,橙皮苷收率随着纤维素酶用量的增加先增大后减小。纤维素酶用量为9 mg/g时,橙皮苷收率最大。
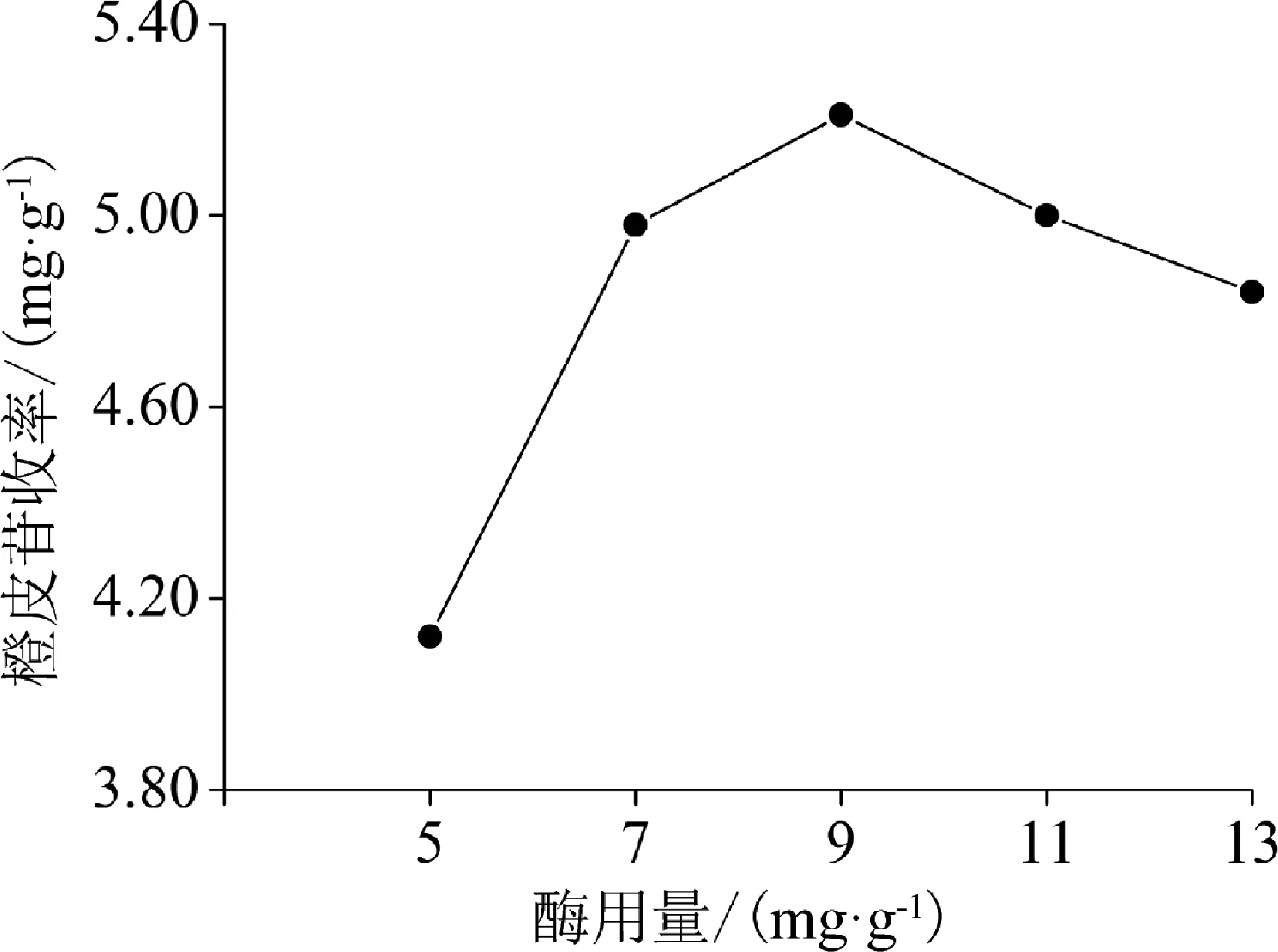
图4 酶用量对橙皮苷收率的影响
2.2.4 酶解时间 不同酶解时间对橙皮苷收率的影响见图5。由图5可知,橙皮苷收率随着酶解时间的延长而升高。当酶解时间超过50 min后,橙皮苷收率的增加趋于平缓。
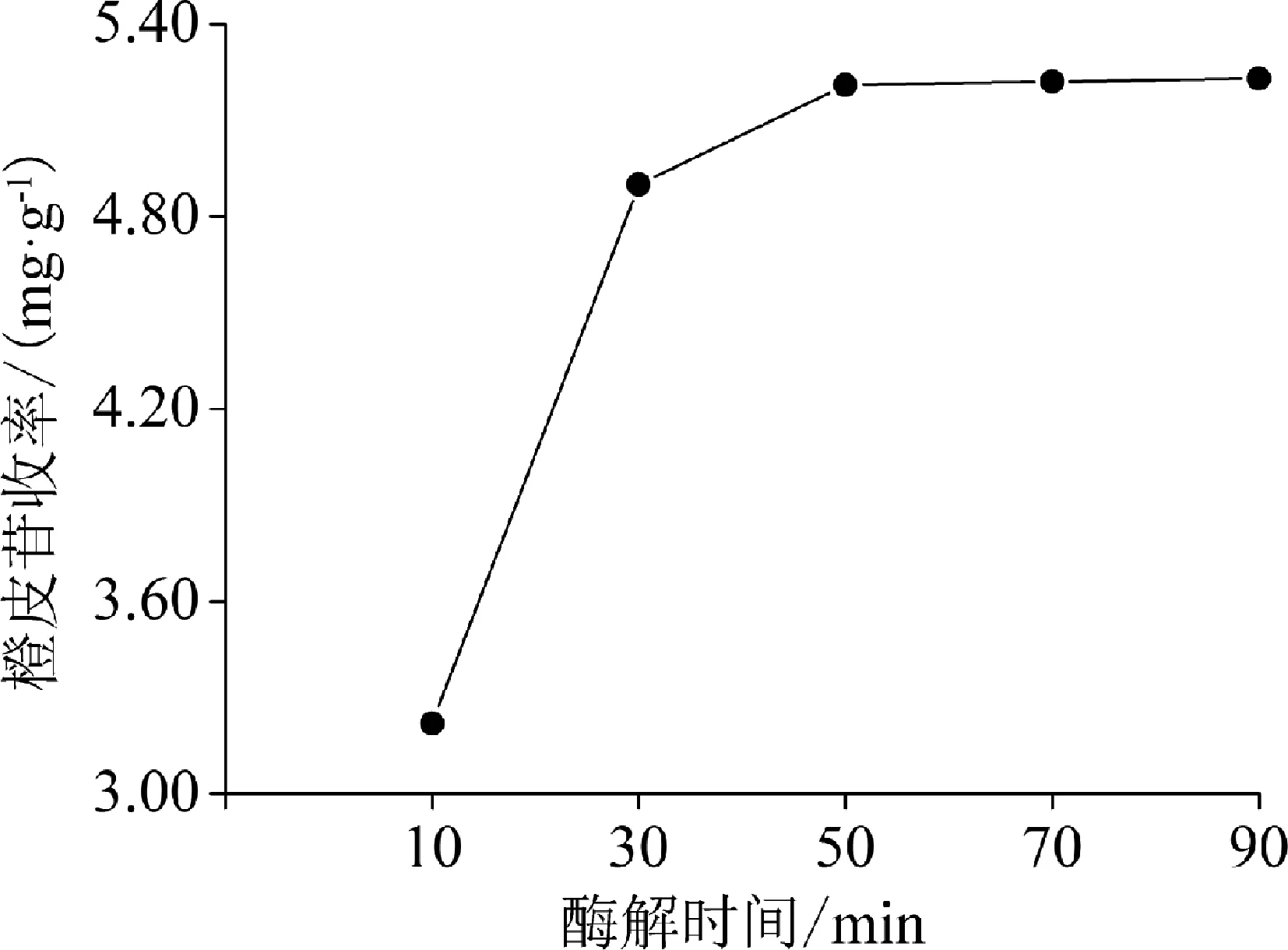
图5 酶解时间对橙皮苷收率的影响
2.3 响应面试验优选最佳工艺条件
2.3.1 响应面试验设计结果 响应面试验设计及结果见表2,通过Design-Expert 8.0.6软件拟合得到影响橙皮苷收率的回归方程:Y=5.260+0.078X1+0.072X2-0.052X3-0.033X4-0.040X1X2+0.120X1X3+0.180X1X4-0.055X2X3+0.010X2X4-0.045X3X4-0.610X12-0.610X22-0.560X32-0.091X42。橙皮苷收率的二次多项回归模型方差分析结果见表3。由表3数据可知,模型极显著(P<0.01),失拟项不显著(P>0.05),回归模型的复相关系数R2为0.9866,校正后的复相关系数RAdj2为0.9709,说明所选变量可解释响应值97.09%的变化,利用此回归方程对试验结果进行分析是可靠的。模型变异系数CV值为0.32%(<10%),说明本试验具有较高的可靠性与精密度,信噪比S/N值为27.379(>4),说明回归方程具有较高的拟合度与可信度。由F值可知各因素对橙皮苷收率的影响程度顺序为:酶解温度>酶解pH值>酶用量>酶解时间。由P值可知回归方程一次项中,X3对橙皮苷收率的影响显著(P<0.05),X1、X2对橙皮苷收率的影响极显著(P<0.01);二次项中X42对橙皮苷收率的影响显著(P<0.05),X12、X22、X32对橙皮苷收率的影响极显著(P<0.01);交互项中X1X3、X1X4对橙皮苷收率的影响极显著(P<0.01)。
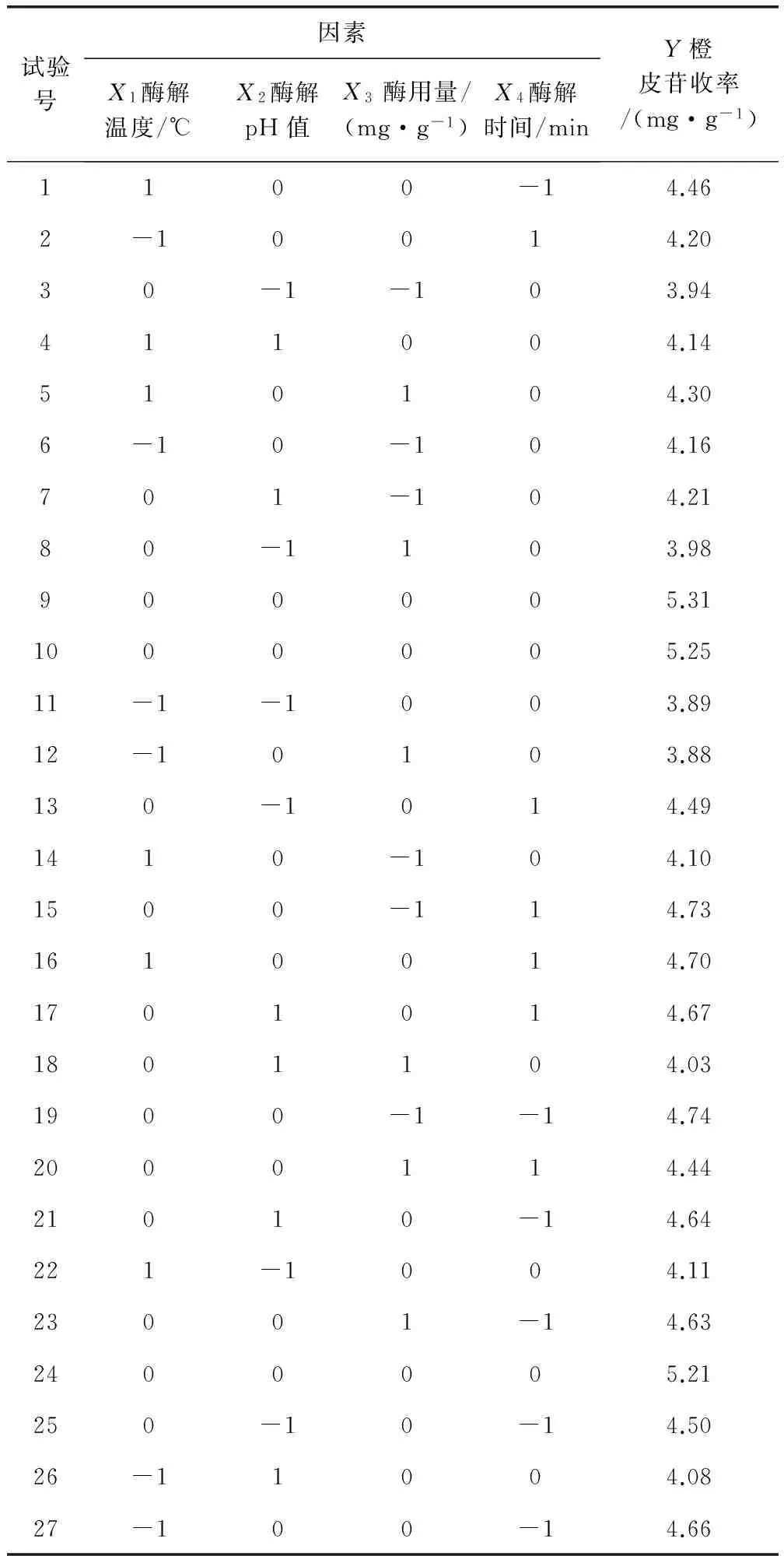
表2 Box-Behnken试验设计及结果
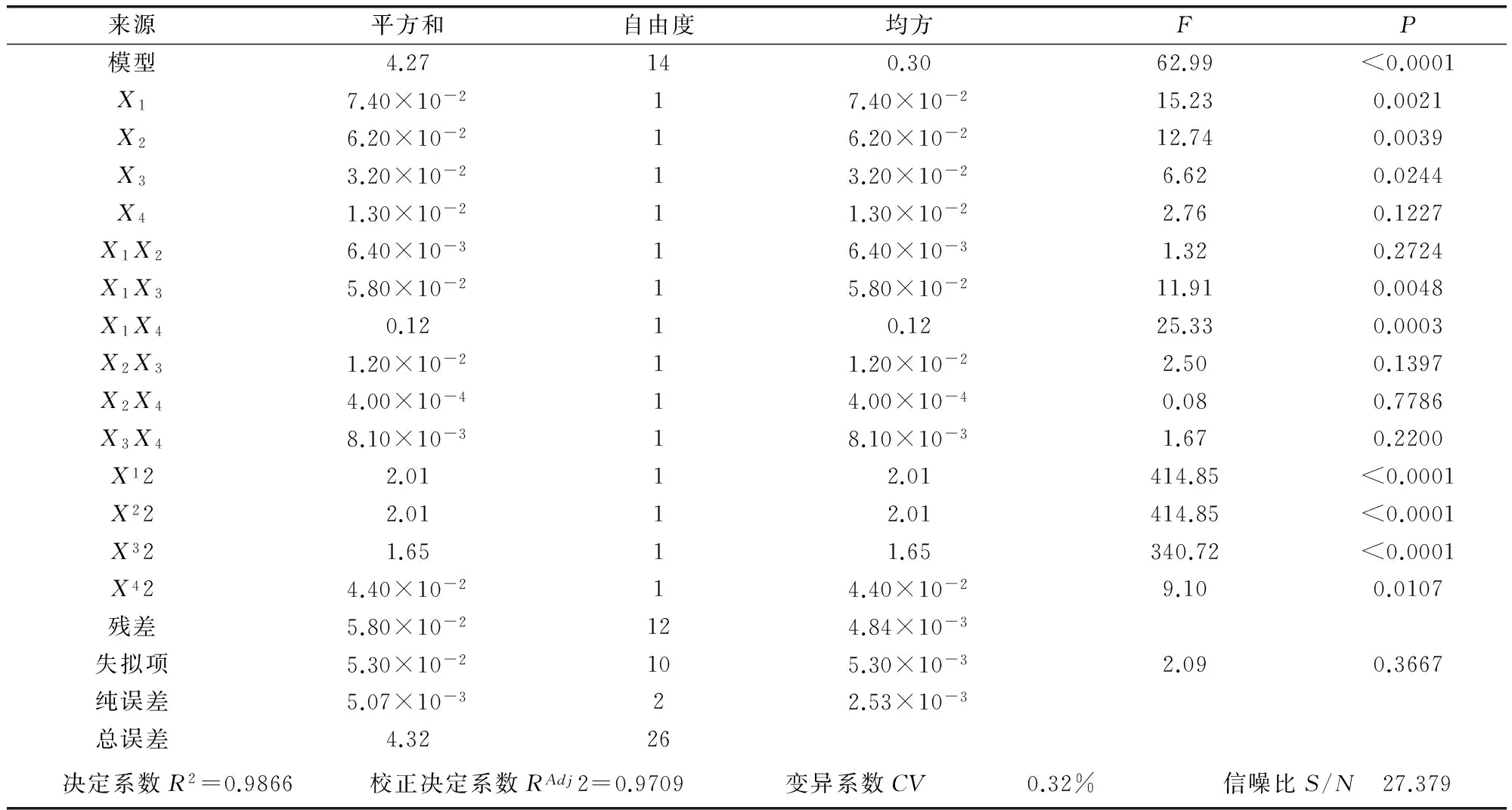
表3 回归方程的方差分析
2.3.2 响应面分析 经Design-Expert 8.0.6软件对模型进行分析,得到各因素对橙皮苷收率影响的响应面图见图6。响应曲图可直观反映各因素交互作用对橙皮苷收率的影响,曲面越陡峭则表示影响越显著。由图6可知,酶解温度与酶用量、酶解温度与酶解时间对橙皮苷收率的影响较显著,与上述方差分析结果一致。
2.3.3 最佳工艺条件的确定及验证试验 通过Design-Expert 8.0.6软件分析,得到最佳酶解辅助提取陈皮中橙皮苷的工艺条件为:酶解温度50.20 ℃、酶解pH值5.03、酶用量8.92 mg/g、酶解时间47.35 min,在此条件下,橙皮苷的理论收率为5.26 mg/g。考虑到操作的可行性,将最佳酶解工艺条件修正为:酶解温度50 ℃、酶解pH值5.0、酶用量8.9 mg/g、酶解时间47 min。在该工艺条件下,对陈皮进行3次平行提取试验,结果表明橙皮苷的平均收率为5.24 mg/g,RSD为0.67%(n=3),试验结果与模型预测相对误差仅为0.38%。另取同等质量陈皮3份,不加纤维素酶,其他操作均与酶解法相同。结果表明,传统回流提取法中橙皮苷的平均收率仅为2.76 mg/g,RSD为0.91%(n=3)。
3 讨论与小结
陈皮主产于我国四川、广东、浙江、福建等地。陈皮的传统提取方法(如煎煮法[6]、渗漉法[6]、回流法[7])存在提取效率低、溶剂用量大、耗时长等缺点。本研究首次将酶解辅助提取法应用于陈皮提取中,即在传统回流提取的基础上,加入酶解预处理步骤,以期为陈皮中橙皮苷的工业化提取提供参考。
在单因素试验中,就酶解温度而言,橙皮苷收率随酶解温度的升高而增大,当酶解温度达到50 ℃后,随着酶解温度的进一步升高而呈下降趋势,这是由于环境温度过低,不利于酶活性的发挥,环境温度过高则会引起酶变性、失活,从而影响橙皮苷收率;就酶解pH值而言,橙皮苷收率随着酶解pH值的增大而增大,当时酶解pH达到5.0后,随着酶解pH值的进一步升高而呈下降趋势,这是由于酶活力受环境pH值影响,过高或过低均不利于酶活性的发挥,从而影响橙皮苷收率;就酶用量而言,橙皮苷收率随着酶用量的增加而增大,当酶用量为9 mg/g时,酶相对于底物已达到饱和,继续增加酶用量则相对过剩的酶会包裹住药材颗粒,从而阻碍有效成分的溶出;就酶解时间而言,橙皮苷收率随着酶解时间的延长而增大,当酶解时间超过50 min后,随着酶解时间的进一步延长而无明显变化。
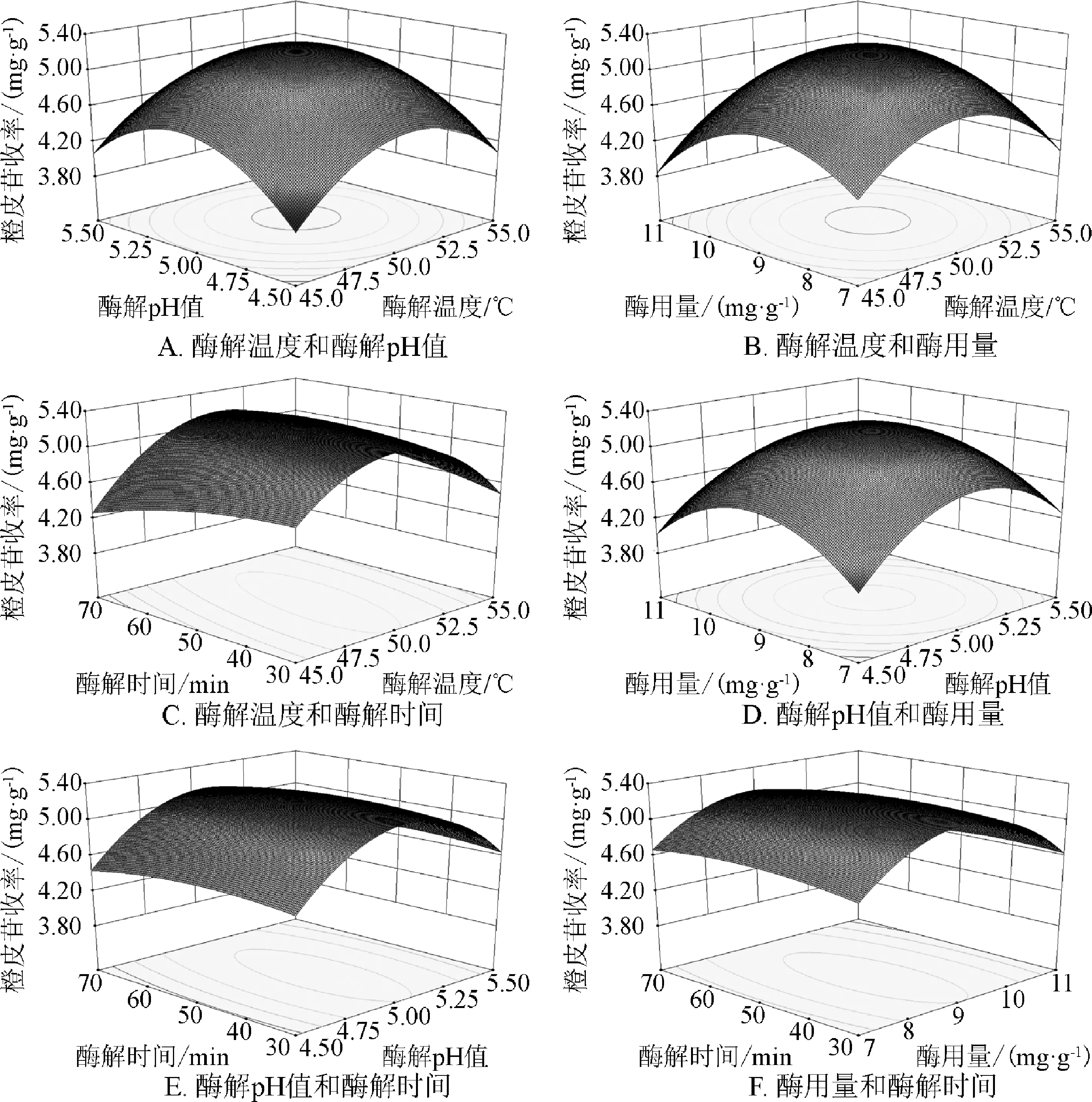
图6 各因素相互作用对橙皮苷收率影响的响应面图
通过响应面试验优选得到陈皮中橙皮苷的最佳酶解辅助提取工艺条件为:酶解温度50 ℃、酶解pH值5.0、酶用量8.9 mg/g、酶解时间47 min。该优选的工艺稳定可行,与传统方法相比,橙皮苷收率有较大提高。该提取工艺中的反应条件温和易控、溶剂消耗量少、耗时短,为陈皮中橙皮苷的工业化生产提供参考依据。
[1] 中国兽药典委员会. 中华人民共和国兽药典2010年版二部[S].
[2] 赵秀玲. 陈皮生理活性成分研究进展[J]. 食品工业科技, 2013, 34(12): 376-381.
[3] 曹贵彬, 易凤珍, 游金明, 等. 陈皮苷制剂对爱拔益加肉鸡生长性能, 免疫器官指数及小肠黏膜形态结构的影响[J]. 动物营养学报, 2014, 26(3): 710-717.
[4] 王海良, 崔虎, 吕慧源, 等. 橙皮苷对肉仔鸡生产性能、屠宰性能及免疫机能的影响[J]. 中国畜牧杂志, 2013, 49(20): 57-60.
[5] 刘英, 王之盛, 周安国. 橙皮苷、绿原酸对断奶仔猪生长、抗氧化和免疫机能的影响[J].中国兽医学报, 2009, 29 (9): 1233-1236.
[6] 蔡庆顺, 钟小群, 余华. 陈皮不同提取工艺橙皮苷提取率分析[J]. 中成药, 2010, 32(6): 1067-1070.
[7] 韦正, 杨丽, 李旻, 等. Box-Behnken效应面法优化陈皮中橙皮苷及川陈皮素提取工艺[J]. 中国实验方剂学杂志, 2013, 19(10): 17-20.
[8] 王云洁, 闫治攀, 白福祖. 酶法在中药提取中的应用进展[J]. 中国中医药信息杂志, 2013, 20(9): 110-112.
[9] 吴卫, 唐振祥, 李素珍. 酶解法辅助提取钩藤中钩藤碱的工艺优选[J]. 中国实验方剂学杂志, 2015, 21(10): 23-25.
[10]熊清平, 张强华, 石莹莹, 等. 酶法辅助提取花生壳中木犀草素的工艺研究[J]. 中国酿造, 2012, 31(1): 46-49.
[11]董义, 沈才洪, 曾里, 等. 酶解辅助提取山药多糖的研究[J]. 河南工业大学学报(自然科学版), 2015, 36(3): 56-60.
(编辑:陈希)
Optimization of Enzyme-assisted Extraction Process for Hesperidin from Citrusreticulata
NING Na1,2, HAN Jian-jun1,2, XUE Dong-fang3, CHEN Biao3, HU Yu-li4
(1.DepartmentofPhamrmacy,TongrenVocationalandTechnicalCollege,Tongren,Guizhou554300,China; 2.EngineeringResearchCenterofVeterinaryTraditionalChineseMedicineinGuizhou,Tongren,Guizhou554300,China; 3.SchoolofLifeSciences,SouthwestUniversity,Chongqing400715,China; 4.AnimalDiseasePreventionandControlCenterofChongqing,Chongqing401120,China)
Hesperidin fromCitrusreticulatawas extracted by cellulase-assisted extraction process. On the basis of single factor experiments, enzymolysis temperature, pH value, cellulase dosage and enzymolysis time were chosen as independent variables and hesperidin yield as response value. Box-Behnken central composite design and response surface methodology were adopted to study the interaction of the receptive variables and their influence on the hesperidin yield, as well as the optimized extraction process. The optimum extraction condition were as follows: enzymolysis temperature 50 ℃, pH 5.0, cellulase dosage 8.9 mg/g, enzymolysis time 47 min. Under this condition, the hesperidin yield was up to 5.24 mg/g, the relative error was merely 0.38% compared to the predicted value (5.26 mg/g). The optimum extraction condition is simple and stable, and which serves as references for industrial large scale production.
Citrusreticulata; hesperidin; cellulase; ethanol refluxing method; extraction process
贵州省农业类工程技术研究中心项目(黔科合农G字[2015]4001号)
宁娜,博士,副教授。从事药用资源的开发利用工作。E-mail: ningnaok@163.com
2015-12-30
A
1002-1280 (2016) 03-0024-06
S853.7
