黄芪生脉饮对模拟运输应激大鼠肺脏组织TLR4和NF-κB p50 mRNA表达的影响
2016-02-07牟唐维薛长定魏明洁张慧张翥蒋会会王晓谦彭远义王自力
牟唐维,薛长定,魏明洁,张慧,张翥,蒋会会,王晓谦,彭远义,王自力
(西南大学动物科技学院,重庆 400715)
黄芪生脉饮对模拟运输应激大鼠肺脏组织TLR4和NF-κB p50 mRNA表达的影响
牟唐维,薛长定,魏明洁,张慧,张翥,蒋会会,王晓谦,彭远义,王自力*
(西南大学动物科技学院,重庆 400715)
为了探讨模拟运输应激对大鼠肺脏组织TLR4和NF-κB p50 mRNA表达的影响及黄芪生脉饮的调控作用,本文将30只SD雄性大鼠随机分为对照组、模型组和中药组,给中药组大鼠连续灌服黄芪生脉饮7 d,对照组、模型组灌服等量生理盐水,然后将模型组和中药组大鼠每日置于35 ℃、60 r/min的水平摇床摇晃2 h,连续3 d,模拟运输过程中的摇晃、高温、拥挤等因素,构建大鼠运输应激模型,实时荧光定量PCR法测定大鼠肺组织TLR4和NF-κB p50 mRNA表达的变化。结果表明:模型组大鼠肺组织TLR4 mRNA表达量显著低于对照组和中药组(P<0.05),中药组大鼠肺组织TLR4 mRNA表达量显著高于对照组(P<0.05),模型组大鼠肺组织NF-κB p50 mRNA表达量显著低于对照组和中药组(P<0.05),且对照组和中药组NF-κB p50 mRNA表达量无显著差异(P>0.05)。因此,黄芪生脉饮可通过降低大鼠肺脏组织中TLR4 mRNA的表达、增强NF-κB p50 mRNA表达来达到抑制TLR4-NF-κB信号通路的激活,进而控制下游的炎性信号通路及炎性细胞因子的表达,起到抑制运输应激大鼠肺组织炎症的作用。
黄芪生脉饮;模拟运输应激;大鼠肺脏组织;TLR4;NF-κB p50
随着现代畜牧集约化养殖规模的不断扩大,畜禽长途运输变得越来越普遍,常引起动物出现运输应激,导致动物消瘦、惊恐、易怒、抗病能力下降,生产性能,免疫水平以及畜产品品质降低[1],特别是免疫抑制性疾病和诱发应激动物严重的肺炎[2],给畜禽生产带来了巨大经济损失[3]。
现有研究表明,TLR4是参与非特异性免疫的重要蛋白质分子,同时也是连接特异性免疫与非特异性免疫的桥梁,可识别病原微生物,激活机体产生免疫细胞应答[4],还可通过结合相应配体引起信号的传导,启动炎症相关基因的转录,造成多种炎症介质的释放[5],其中,NF-κB是TLR4介导的信号转导的下游转录因子[6],激活后将调控与炎症反应和固有免疫反应相关基因转录[7],可诱导下游信号的级联式反应,引起严重炎性反应,导致疾病恶化[8]。因此,本文通过构建大鼠模拟运输应激模型,研究模拟运输应激对大鼠肺脏组织TLR4和NF-κB p50 mRNA表达的影响及黄芪生脉饮的干预作用,探讨黄芪生脉饮对运输应激致肺组织炎性损伤的防治效果,为研制可有效防治运输应激性肺炎的药物提供试验依据。
1 材料与方法
1.1 药品与试剂 黄芪、五味子、党参和麦冬,重庆市北碚区中医院;SYBR Green(批号:172-5264),美国Bio-Rad公司;RNAiso Plus(批号:D9108A)和RNA Reagent Kit(批号:DRR047R),大连宝生物公司;Trizol(批号:A9507-1)、cDNA反转录试剂盒(批号:AK3101),大连TakaRa公司。
1.2 仪器设备 BIO-RAD7500型实时荧光定量PCR仪,HITACHI CT15RE型高速冷冻离心机,德国BIOMETRA Trobot PCR仪,SHZ-82恒温振荡培养箱。
1.3 方法
1.3.1 中药制剂 取黄芪40 g、党参30 g、麦冬20 g和五味子10 g等药物加入10倍蒸馏水浸泡30 min后,武火煮沸,文火煎煮2 h后,双层纱布过滤,再加入8倍蒸馏水文火煎煮1.5 h,纱布过滤后合并两次滤液,旋转蒸发仪浓缩为1 g生药/mL的药液,于4 ℃条件保存。
1.3.2 动物分组及处理 SD雄性大鼠30只,体重250±20 g,购自第三军医大学实验动物中心。将大鼠置于25±2℃,65%~75%湿度条件下适应性饲养7 d后,随机分为对照组、模型组和中药组,每组10只。
按照5 g/kg剂量给各组大鼠灌服黄芪生脉饮2 mL,对照组和模型组大鼠灌服同等剂量生理盐水,每日1次,连续7 d。参照文献方法[9]对大鼠进行模拟运输应激处理,即每日9∶00~11∶00将模型组及中药组大鼠置于恒温振荡培养箱中,按35 ℃、60 r/min条件水平摇床上摇晃2 h,连续3 d,利用摇床模拟运输过程中的摇晃、高温、拥挤等因素进行处理。
1.3.3 样品采集及处理 在第3天摇晃结束后,对所有大鼠进行乙醚吸入麻醉,颈椎脱臼处死后于75%酒精中浸泡5 min,无菌剖取肺脏组织,液氮冻存,-80 ℃保存;Trizol法提取肺组织总RNA反转录,实时荧光定量PCR法检测大鼠肺组织中TLR4及NF-κB p50 mRNA表达量的变化。
1.3.4 引物设计及合成 根据GeneBank中大鼠TLR4、NF-κBp50及β-actin基因序列,Primer 5软件设计引物,由上海生工生物工程股份有限公司合成。各基因引物序列如下:
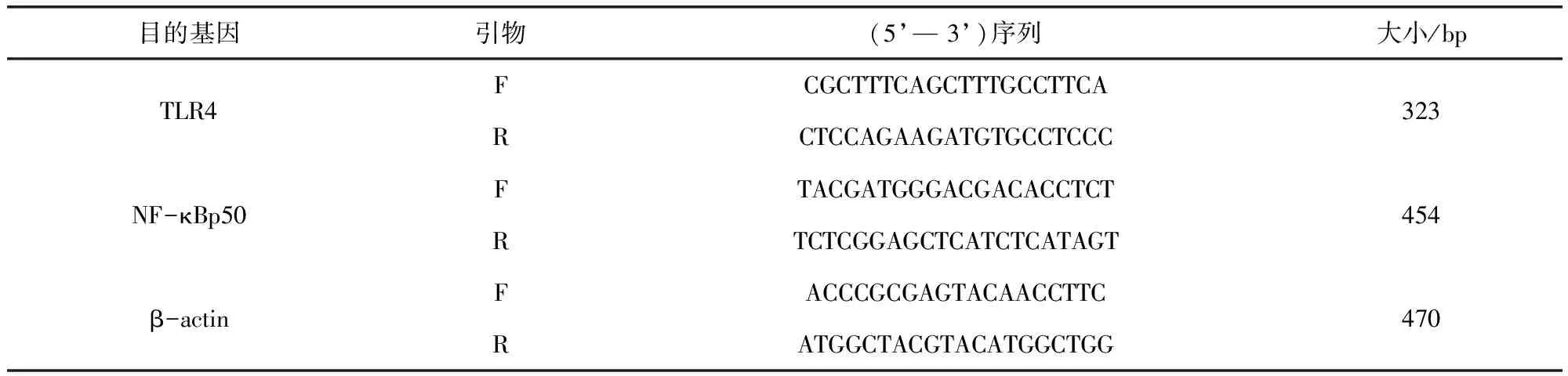
表1 各基因引物序列
1.3.5 大鼠肺脏组织中TLR4和NF-κB p50 mRNA的检测 提取大鼠肺脏组织的总RNA,按照反转录试剂盒说明,将RNA反转录cDNA后,进行实时荧光定量PCR反应扩增目标基因序列,反应条件为:95 ℃预变性30 min,95 ℃变性10 s,退火(TLR4 64.5 ℃、NF-κB p50 60 ℃、Actin 60 ℃)30 s,65 ℃延伸5 s,共进行39个循环,95 ℃延伸30 s。
1.4 数据处理与分析 通过荧光定量PCR法测定各基因的荧光阈值(Ct),运用2-ΔΔCt方法计算目的基因的表达值,并以“平均数(标准差SD)”表示,采用SPSS13.0软件进行单因素方差分析(one-way ANOVA)。
2 结果
2.1 基因扩增曲线、溶解曲线结果 图1-2为大鼠肺脏组织各基因扩展曲线和溶解曲线。扩增曲线均稳定进入平台期,说明模板的浓度适宜;溶解曲线呈单峰,表明无引物二聚体及其他的非特异性扩增产物,结果可信。
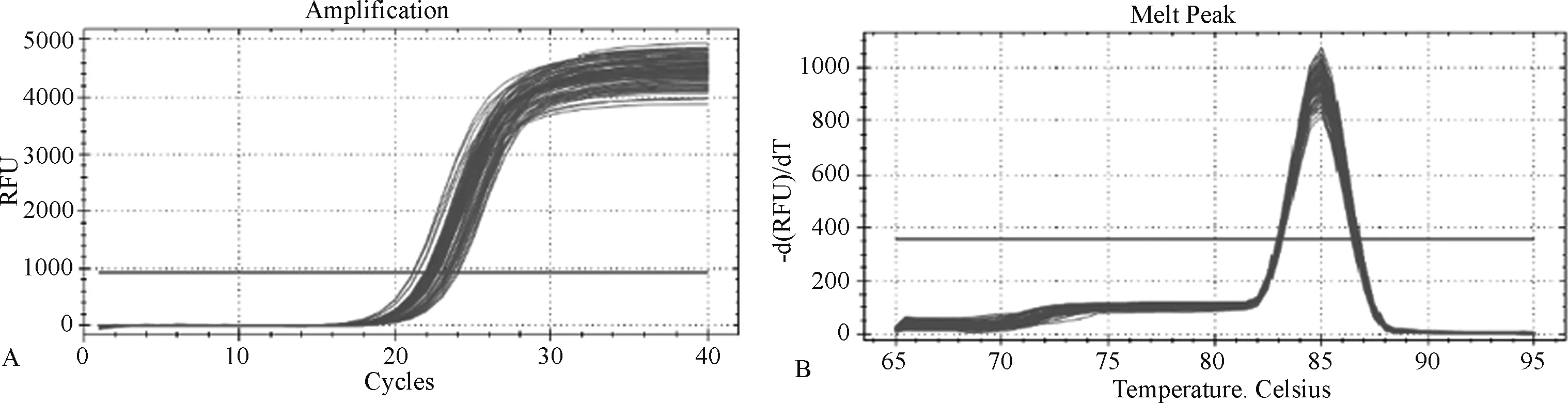
图1 大鼠TLR4基因的扩增曲线(A)和溶解曲线(B)
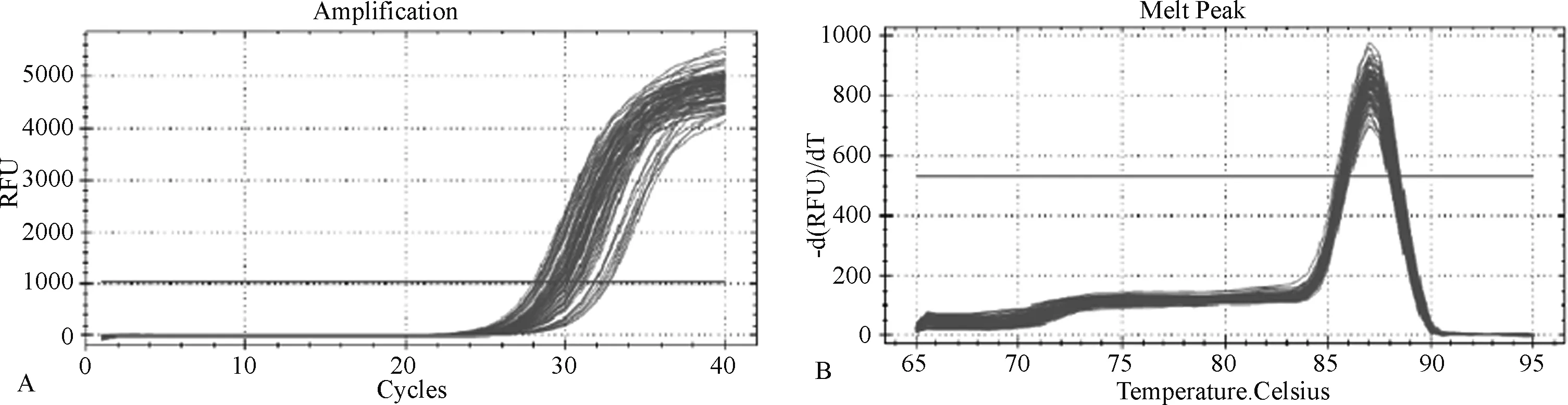
图2 大鼠NF-κBp50基因的扩增曲线(A)和溶解曲线(B)
2.2 黄芪生脉饮对模拟运输应激致大鼠肺组织TLR4 mRNA表达的影响

表2 黄芪生脉饮对模拟运输应激大鼠肺组织TLR4 mRNA表达的影响
各组之间相比,相同字母差异不显著(P>0.05),不同字母表示差异显著(P<0.05),下同。
由表2可知,模型组大鼠肺组织TLR4 mRNA表达量显著高于对照组和中药组(P<0.05),中药组大鼠肺组织TLR4 mRNA表达量则显著高于对照组(P<0.05)。
2.3 黄芪生脉饮对模拟运输应激致大鼠肺组织 NF-κB p50 mRNA表达的影响

表3 黄芪生脉饮对模拟运输应激大鼠肺组织NF-κB p50 mRNA表达的影响
由表3可知,模型组肺组织NF-κB p50 mRNA表达量显著低于对照组和中药组(P<0.05),对照组和中药组肺组织NF-κB p50 mRNA表达量差异不显著(P>0.05)。
3 分析与讨论
运输应激是动物在运输途中的禁食限水、拥挤环境及颠簸等因素的作用下,产生了适应性和防御性反应,是影响动物生产的重要因素之一[10]。据研究,长途运输应激会使动物呼吸系统免疫机制受到影响,易发生呼吸道、肺部感染性及炎性疾病[11-12],引发肉牛全身综合性病理症候群,其发病率可达80%,死亡率达40%以上。
中兽医理论认为运输应激综合征属于虚症范畴,主要分为气血两虚、湿热内蕴、脾胃虚弱和肝气郁结[14]等,临床以气血两虚型较为常见,治宜益气生津、宁心安神,可用归脾汤、黄芪生脉饮等治疗,黄芪生脉饮是由黄芪、党参、麦冬和五味子四味药组成,具有益气滋阴,养心补肺之功效[15]。研究表明,黄芪生脉饮具有强心、改善周围血液循环等作用,调节和促进机体活动能力,增强新陈代谢的功能[16]。
3.1 黄芪生脉饮对模拟运输应激大鼠肺组织TLR4 mRNA表达的影响 TLRs是启动天然免疫防御反应的关键因素,而TLR4是已经发现的TLRs家族之一,主要是识别革兰氏阴性细菌的脂多糖,进而诱导下游信号通路,如NF-κB等信号通路来激发机体组织炎性反应,在炎性反应发生中起到关键作用[17,18]。
本研究表明,大鼠模型组肺脏组织TLR4 mRNA表达水平显著高于对照组,说明在模拟运输条件下,大鼠机体抵抗力下降,细菌感染导致肺组织受到损伤,模型组大鼠肺组织TLR4 mRNA表达水平显著高于中药组,说明黄芪生脉饮可通过干预大鼠肺脏组织中TLR4 mRNA的表达,进而控制TLR4下游的炎性信号通路及炎性细胞因子的表达,参与控制局部炎症反应,起到防治运输应激的作用。
现有研究表明,黄芪多糖对LPS引起的大鼠心肌肥大具有保护作用,其机制可能与抑制TLR4/NF-κB信号通路有关[19];黄芪皂苷可阻止MYD88,TLR4受体的激活,提高超氧化物歧化酶的活性,对于胃部炎症具有治疗作用[20];黄芪可以减弱LPS-TLR4信号转导途中的p38和ERK的活性和激活增殖蛋白激酶磷酸酶(MKP-1)从而减少LPS作用的巨噬细胞的IL-6、iNOS和COX-2的产生[21];党参对机体的部分损伤有保护作用,并且具有抗炎、抗应激、抗缺氧作用[22],还可使巨噬细胞增多,吞噬能力增强,可以增强细胞内DNA、RNA、ATP酶等的活性等;麦冬可促进体液和细胞免疫功能[23],增强小鼠网状内皮系统的吞噬能力,具有良好的免疫增强和刺激作用;五味子也具有免疫兴奋的作用[24]。
3.2 黄芪生脉饮对模拟运输应激大鼠肺组织NF-κB p50 mRNA表达的影响 NF-κB是一种普遍存在的转录因子,为p50/p65异源二聚体,在受到病原体等各种因素影响时被激活和释放,可诱导前炎性基因表达,介导机体组织的天然免疫反应和炎性反应[25-26];研究表明,NF-κB的负反馈调节主要通过p105/p50及IκBα执行,其中p50二聚体可以通过竞争DNA结合位点降低NF-κB介导的效应[27]。因此,抑制NF-κB信号通路的激活有助于控制组织炎症的发生。
本研究表明,模拟运输应激可引起大鼠肺组织NF-κB p50 mRNA表达量显著下降,且低于对照组和中药组,中药可维持大鼠肺组织NF-κB p50 mRNA表达量于正常水平,表明黄芪生脉饮能通过增强p105/p50介导的NF-κB的负反馈调节来抑制NF-κB信号通路,达到减轻肺部损伤的作用。研究表明,黄芪能够抑制NF-κB的核转位,从而影响下游蛋白的表达并且黄芪皂苷能够完全抑制LPS和TNF-α介导的内皮细胞的NF-κB核转位和NF-κB-DNA结合的活性,从而发挥抗炎作用[21];黄芪多糖联合丹参酮对阻断大鼠NF-κB转导通路过度激活及降低细胞因子MIF(巨噬细胞移动抑制因子)具有显著疗效[28];且黄芪甲苷对后负荷过载型心肌肥厚具有抑制作用,其作用机制与抑制TNF-α、IL-1β参与介导的TLR4-NF-κB通路的信号转导有关[29]。
综上所述,黄芪生脉饮可通过降低大鼠肺脏组织中TLR4 mRNA的表达、增强NF-κB p50 mRNA表达来达到抑制TLR4-NF-κB信号通路的激活,进而控制下游的炎性信号通路及炎性细胞因子的表达,参与控制局部炎症反应,起到抑制运输应激大鼠肺组织炎症的作用。
[1] Kannan G, Kouakou B, Terrill T H,etal. Endocrine, blood metabolite, and meat quality changes in goats as influenced by short-term, preslaughter stress[J]. J Anim Sci. 2003, 81(6): 1499-1507.
[2] Min ka N S, Ayo J O. Physiological responses of food animals to road transportation stress[J]. African Journal of Biotechnology, 2013, 9(40): 6601-6613.
[3] Allen I C, Wilson J E, Schneider M,etal. NLRP12 suppresses colon inflammation and tumors genesis through the negative regulation of no canonical NF-κ B signaling [J]. Immunity, 2012, 36(5): 742-754.
[4] 马文涛, 杨来启, 林玉梅,等. 应激对大鼠血清皮质醇及白细胞介素2、6、8水平的影响[J]. 中国心理卫生杂志. 2002, 1: 14-15.
[5] Derijk R, Michelson D, Karp B,etal. Exercise and circadian rhythm-induced variations in plasma cortisol differentially regulate interleukin-1 beta (IL-1 beta), IL-6, and tumor necrosis factor-alpha (TNF alpha) production in humans: high sensitivity of TNF alpha and resistance of IL-6[J]. J ClinEndocrinolMetab. 1997, 82(7): 2182-2191.
[6] 陈洁,姜虹. TLR4信号通路与炎性反应[J]. 医学综述. 2009(19): 2902-2904.
[7] Nomura F, Akashi S, Sakao Y,etal. Cutting edge: endotoxin tolerance in mouse peritoneal macrophages correlates with down-regulation of surface toll-like receptor 4 expression[J]. J Immunol. 2000, 164(7): 3476-3479.
[8] Jobin C, Sartor R B. TheI kappa B/NF-kappa B system: a key determinant of mucosalinflammation and protection[J]. Am J Physiol Cell Physiol. 2000, 278(3): C451-C462.
[9] 舒班超, 麻武仁, 尹朋,等. 运输应激对大鼠空肠形态与热休克蛋白家族mRNA表达的影响[J]. 中国兽医杂志, 2012(11):9-13.
[10]裴志花, 王开, 马红霞,等. 运输应激及其对动物免疫功能影响的研究进展[J]. 中国兽医杂志, 2012, 48(1): 81-83.
[11]杜永学,夏迎华. 牛运输应激呼吸综合征的防治[J]. 今日畜牧兽医,2013,12:56.
[12]邓治邦, 钟一鸣, 小崔. 火鸡气囊病的诊治[J]. 中国预防兽医学报, 1994, 4: 015.
[13]石艳华, 姜福义. 煌绿滴鼻法在兔巴氏杆菌检测中的应用[J]. 中国养兔杂志, 1999 (6): 16-16.
[14]杨恒怀. 家畜应激综合症的辨证论治[J]. 中兽医医药杂志,2001,01:23-25.
[15]许剑琴. 中兽医学(精简版)[M]. 北京:中国农业出版社. 2014, 187-199.
[16]刘燕娟,王飞雪,郝建峰,等. 黄芪生脉饮临床应用及基础研究进展[J]. 现代中西医结合杂志. 2009, 16:1961-1963.
[17]Kawai T, Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity [J]. Immunity. 2011, 34(5): 637-650.
[18]詹雪灵,高杰, 吴补领. Toll样受体2和4信号通路在炎症治疗中的作用和意义[J]. 国际口腔医学杂志. 2014, 3:304-308.
[19]孙雪芳,王洪新,梁灵君,等.黄芪多糖通过TLR4/NF-κB信号通路抑制脂多糖诱导的大鼠心肌细胞肥大[J]. 中国药理学通报. 2013,2:208-212.
[20]张莲,周语平,刘光炜. 黄芪皂苷对大鼠萎缩性胃炎的治疗作用及对MyD88、TLR4受体的影响[J]. 中国实验方剂学杂志. 2013,2:226-229.
[21]况荣华, 周林, 傅颖珺.中药以LPS-TLR4为作用靶点的抗炎机制的研究进展[J].南昌大学学报(医学版).2011, 51(10):89-91.
[22]冯佩佩, 李忠祥, 原忠. 党参属药用植物化学成分和药理研究进展[J]. 沈阳药科大学学报. 2012, 04:307-311.
[23]于学康. 麦冬的药理作用研究进展[J]. 天津药学. 2012, 04:69-70.
[24]郭冷秋,张鹏,黄莉莉,等. 五味子药理作用研究进展[J]. 中医药学报. 2006, 4:51-53.
[25]Allen I C, Wilson J E, Schneider M,etal. NLRP12 suppresses colon inflammation and tumors genesis through the negative regulation of no canonical NF-κB signaling [J]. Immunity. 2012, 36(5): 742-754.
[26]Brasier A R. The NF-kappaB regulatory network.[J]. Cardiovascular Toxicology, 2006, 6(2):111-130.
[27]苏剑东, 吴灵飞. NF-κB与细胞凋亡[J]. 世界华人消化杂志, 2007(12):1411-1416.[28]杨志霞. 黄芪多糖丹参酮对心衰大鼠心肌NF-κB通路过度激活及MIF表达的干预效应[D].北京中医药大学,2012.5-6.
[29]何海洋. 黄芪甲苷对心肌肥厚的抑制作用与TLR-4/NF-kappaB信号通路相关[D]. 辽宁医学院, 2013.
(编辑:陈希)
Effects of Huangqi Shengmai Decoction on TLR4 and NF-κB p50 mRNA Expression in Lung of Rat Injured with Transport Stress
MOU Tang-wei, XUE Chang-ding, WEI Ming-jie, ZHANG Hui, ZHANG Zhu,JIANG Hui-hui, WANG Xiao-qian, PENG Yuan-yi, WANG Zi-li*
(CollegeofAnimalScienceandTechnology,SouthwestUniversity,Chongqing400715,China)
In order to investigate the effects of Huangqi Shengmai Decoction on TLR4 and NF-κB p50 mRNA expression in lung of rat injured with transport stress. There are 30 healthy male SD rats were divided in randomly into control group, model group and Chinese herb group. Then, the rats of Chinese herb group were irrigated Huangqi Shengmai Decoction for 7 d, while the rats of control groupand model group were irrigated normal salinein same dose. Then the rats of model group and Chinese herb group were put in simulated transport with 35 ℃, 60 r/min horizontal shaker for 3 d in order to simulate the transport process of shaking, temperature, congestion and other factors. And then the TLR4 and NF-κB p50 mRNA expression level in lung of rat were detected via real-time PCR. The results show that the model group TLR4 mRNA expression level in lung of rat is significantly higher than that of Chinese herb group and control group (P<0.05), while Chinese herb group is higher than control group in significantly (P<0.05). The expression level of lung tissue NF-κB p50 mRNA of the model group is lower than that of control group and Chinese herb group in significantly (P<0.05),while Chinese herb group and control group have no significant difference. Therefore, Huangqi Shengmai Decoction could decrease the TLR4 mRNA expression level, and increase the NF-κB p50 mRNA expression level of lung in rat,to restrain the activation of TLR4-NF-κB signal-pathway, then to control the inflammation signal-path way and cytokines expression, which will restrain the lung tissue inflammations of rat in transport stress.
Huangqi Shengmai Decoction; simulated transport stress; lung tissue of rat; TLR4; NF-κB p50
国家现代农业(肉牛牦牛)产业技术体系建设专项基金资助(CARS-38);西南大学国家级大学生创新创业训练计划(201410635009)
牟唐维,从事中兽医学及中药免疫药理学方面研究。
王自力。E-mail:wzl9698@126.com
2016-04-20
A
1002-1280 (2016) 06-0039-05
S853.74
