氨苄西林在鸡排泄物中的残留消除规律
2016-02-07王波张杨杨谢恺舟刘建宇刘亚楠高强郭辉生张跟喜戴国俊王金玉
王波,张杨杨,谢恺舟*,刘建宇,刘亚楠,高强,郭辉生,张跟喜,戴国俊,王金玉
(1.扬州大学动物科学与技术学院,江苏扬州225009;2.江苏省动物遗传繁育与分子设计重点实验室,江苏扬州225009)
氨苄西林在鸡排泄物中的残留消除规律
王波1.2,张杨杨1.2,谢恺舟1.2*,刘建宇1.2,刘亚楠1.2,高强1.2,郭辉生1.2,张跟喜1,2,戴国俊1,2,王金玉1,2
(1.扬州大学动物科学与技术学院,江苏扬州225009;2.江苏省动物遗传繁育与分子设计重点实验室,江苏扬州225009)
为了研究氨苄西林(AMP)在鸡排泄物中残留消除规律,将鸡排泄物用乙腈去蛋白处理,再用饱和的二氯甲烷萃取后,在酸性条件下上清液用水杨醛沸水浴衍生化后,在激发波长354 nm、发射波长445 nm处用高效液相色谱荧光检测器检测。结果显示:该方法测定鸡排泄物中AMP的检测限为1.2 μg/kg(S/N≥3)、定量限为3.5 μg/kg(S/N≥10)。AMP在鸡排泄物样品中平均回收率为74.96 % ~ 80.41 %,变异系数均低于9.77 %。试验鸡按体重以60.0、120.0 mg/(kg·d)剂量内服AMP,每天给药1 次,连续5 d。AMP在投药第1 d时,鸡排泄物中AMP残留量被检测到,投药第5 d时达到峰值。休药后AMP在鸡排泄物中残留量迅速降低。正常剂量组,休药第7 d时,AMP在鸡排泄物中残留量低于检测限。双倍剂量组,在休药第9 d时,鸡排泄物中AMP残留量低于检测限。AMP在鸡排泄物中的残留量与给药剂量呈正相关,鸡排泄物中高含量AMP残留存在较大的环境风险。
氨苄西林;高效液相色谱荧光检测法;残留消除;鸡排泄物
氨苄西林(Ampxicillin,AMP),是半合成耐酸广谱青霉素,不仅抗菌谱广,而且杀菌能力强。因此,AMP被广泛用于家禽养殖中。虽然鸡的排泄物经处理后可添加到动物饲料中作为很好的蛋白质饲料来源,但养殖户抗生素的滥用和休药期不按规定执行而导致抗生素在鸡排泄物中残留,随着食物链的传递,最终对人类健康构成威胁。我国农业部与欧盟都有最高残留限量(MRLs)规定,AMP在动物可食性组织中的MRLs为50 μg/kg[1-2]。
目前,国内外研究AMP的残留检测方法虽有微生物法[3]、试管扩散法[4]、HPLC法[5-7]、HPLC-MS/MS[8]等报道,但关于AMP在鸡排泄物中的残留消除规律研究尚未见报道。本试验按体重分别以60.0、120.0 mg/(kg·d)剂量给京海黄鸡每天内服AMP 1 次,连续5 d,测定从投药期到休药期不同时间AMP在鸡排泄物中的残留量变化,研究鸡排泄物中AMP的残留消除规律,为AMP环境风险的正确评估及鸡排泄物中AMP去除技术研究,实现鸡排泄物的循环再利用提供依据。
1 材料与方法
1.1 标准物质、主要试剂及配置 AMP标准物质:纯度99.00%,德国Dr. Ehrenstorfer 赠送;兽用氨苄西林钠粉剂:江苏倍康药业有限公司;水杨醛、三氯乙酸、磷酸二氢钾、磷酸氢二钾和二氯甲烷:均为分析纯;乙腈:色谱纯,德国Merck有限公司;超纯水(本实验室自制)。
AMP标准储备液:准确称取AMP适量置于10 mL棕色容量瓶中,用无菌超纯水溶解并定容至刻度;即成0.5 mg/mL的AMP标准液,置于-35 ℃冰箱中密封保存。
1.2 主要仪器 高效液相色谱仪(带两台515型高压泵、配2475型荧光检测器等,美国Waters公司);高速冷冻离心机(D-37520型,德国Osterode am Harz公司);漩涡混合器(G560E型,美国Scientific Industries公司);分析天平(Ax205型,瑞士Mettler Toledo公司);超纯水制备仪(SMARTPURE,美国Thermo公司)等。
1.3 方法
1.3.1 供试动物处理及样品采集 随机选取90 只28 周龄京海黄鸡产蛋鸡,体重1.8±0.2 kg,分成3 组,分别为氨苄西林正常剂量组30只,给药剂量60.0 mg/(kg·d)、氨苄西林双倍剂量组30 只,给药剂量120.0 mg/(kg·d)、空白对照组30只。给药前分别称重、编号、单笼饲养。前预期7 天,饲喂全价饲料(不含任何药物),自由采食、饮水。用无菌超纯水先将氨苄西林钠粉剂配成净含量50 mg/mL的水溶液。各试验组鸡按上述剂量分别将药物注入到鸡嗉囊中,每天8∶30左右内服给药1 次,连续5 d,自给药日起一直到停药后15 d,每天17∶30左右采集各试验组鸡排泄物,在-80 ℃冰箱中保存待测。
1.3.2 样品的提取、净化与衍生化 准确称取 5 g鸡排泄物匀浆液放入50 mL具塞离心管中,加入乙腈溶液10 mL,漩涡混匀振荡2 min,以8000 × g的离心力在5 ℃条件下离心10 min。将上清液转到另一只50 mL具塞离心管中,重复提取剩余的残渣1 次,合并上清液后,加入20 mL饱和的二氯甲烷,漩涡混匀振荡2 min,以6500 × g的离心力在10 ℃条件下离心10 min。转移上层水相置于15 mL玻璃离心管中,用真空干燥器抽干,加入10 mL超纯水振荡溶解。从中取100 μL溶解后的溶液置于10 mL玻璃离心管中,再分别加入100 μL 15 %的三氯乙酸溶液、20 μL水杨醛后,漩涡混匀振荡1.5 min,在沸水浴中进行衍生化反应1 h。将衍生化样品取出冷却至室温后,转移到2 mL离心管中,用500 μL 50 %乙腈溶液分两次洗涤10 mL玻璃离心管,转移并合并至2 mL离心管中,最后再用50 %乙腈溶液定容到2 mL。以20000 × g的离心力离心15 min,上清液经0.22 μm滤膜过滤后,供HPLC测定。
1.3.3 色谱操作条件及参数 色谱柱:Athena C18,5 μm,250 mm × 4.6 mm, id;荧光检测器:激发波长为354 nm,发射波长为445 nm;流动相:A 相0.01 moL/L磷酸二氢钾溶液,用0.1 moL/L磷酸氢二钾溶液调pH至5.5;B 相乙腈溶液,梯度洗脱程序见表1;流速1.0 mL/min;进样体积:100 μL;柱温:40 ℃。

表1 梯度洗脱程序
1.3.4 标准曲线的制备 用空白基质提取液将AMP标准储备液稀释成浓度分别为3.5、12.5、62.5、125.0、250.0 μg/kg的AMP标准工作液。准确吸取各浓度点AMP标准工作液100 μL,按衍生化步骤衍生,重复测定每个浓度点的AMP衍生化产物4 次,取色谱峰面积平均值绘制AMP浓度(C)- AMP色谱峰面积(A)的标准曲线,求出AMP线性回归方程和相关系数。
1.3.5 添加回收率和精密度的测定 准确称取5.0 g匀浆的空白鸡排泄物放入50 mL具塞离心管中,分别添加AMP低、中、高浓度的标准工作液,使AMP在空白鸡排泄物中含量依次为3.5、5.0、25、125 μg/kg,经样品提取、净化和衍生化后,取100 μL进样,进行HPLC检测,计算添加回收率。按AMP药物的浓度高低将回收率检测后剩余的样品分别混合成3份,在同1 天、同1 星期内的不同时间,用同一台HPLC分别重复测定低、中、高三种药物浓度的样品6 次,求得日内、日间变异系数。
1.3.6 检测限和定量限的测定 把一定质量浓度的AMP标准溶液添加到空白基质提取液中,经1.3.2样品的提取、净化与衍生化后,取上清液用HPLC进行分析测定,以样品检测时的信噪比大于等于3和10分别作为AMP检测方法的检测限和定量限。
1.3.7 AMP在鸡排泄物中残留量的分析测定 按照外标定量的方法,把AMP在鸡排泄物中测得的峰面积带入AMP标准曲线回归方程(如果实测样品的含量超过标准曲线的线性浓度范围,可以对样品提取液和衍生化后溶液进行稀释后再测定),即能得到鸡排泄物中AMP的残留量。
2 结果
2.1 色谱分离 由图1显示,在筛选好的最佳色谱条件下,测得鸡排泄物中AMP的保留时间为15.3 min左右,色谱峰为基线分离峰且峰形较好,空白提取液在上述时间内无干扰峰。
2.2 标准曲线 以AMP的色谱峰面积(A)为横坐标、进样前AMP的质量浓度(C,μg/kg)为纵坐标作图,得到AMP标准曲线。AMP在3.5 μg/kg~250.0 μg/kg线性范围内,其线性回归方程为C= 0.0181 A-1.7605,相关系数r为0.9998。
2.3 样品的添加回收率和精密度 由表2可知,当AMP在空白鸡排泄物样品中添加水平分别为3.5、5.0、25.0、125.0 μg/kg时,鸡排泄物样品中AMP平均添加回收率为74.96 % ~ 80.41 %,变异系数均低于9.77 %。其日内、日间变异系数分别均低于8.74 %、11.59 %。结果表明:该检测方法可靠性、重复性均符合要求。
2.4 灵敏度 用本试验建立的分析测定方法,测得AMP在鸡排泄物中的检测限为1.2 μg/kg(S/N≥3)、定量限为3.5 μg/kg(S/N≥10),表明此方法的灵敏度能满足AMP在鸡排泄物中残留检测的要求。
2.5 鸡排泄物中AMP残留量的分析测定 AMP在鸡排泄物中的残留量测定结果及其消除曲线分别见表3、图2。
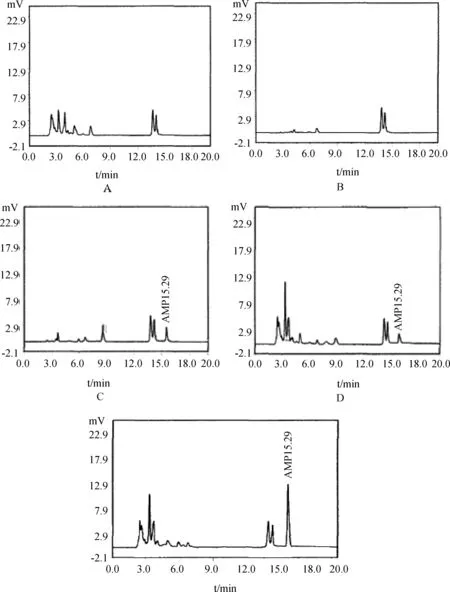
A.空白鸡排泄物;B.水杨醛;C.AMP(20.0 ng/mL)标准品D.添加AMP(25.0 μg/kg)标准品的空白鸡排泄物;E. AMP给药后的鸡排泄物图1 鸡排泄物中AMP的HPLC图
添加浓度/(μg·kg-1)回收率/%变异系数/%日内变异系数/%日间变异系数/%3.574.96±4.616.157.3611.595.076.53±4.545.937.1911.2325.076.69±7.499.778.7410.56125.080.41±6.217.725.689.57
由表3、图2可见,试验组鸡按体重分别以60.0、120.0 mg/(kg·d)剂量内服给药AMP,每天 1 次,连续5 d。投药第1 d时,在鸡排泄物中就能检测到AMP残留,第5 d时,AMP残留量达峰值。正常剂量组在休药第5 d时,鸡排泄物中AMP残留量低于检测限;双倍剂量组在休药第7 d时,鸡排泄物中AMP残留量低于检测限。鸡排泄物中AMP的残留量与给药剂量的大小呈正相关。

表3 鸡排泄物中AMP的残留量
注:ND. 未检测到,“-”未检测
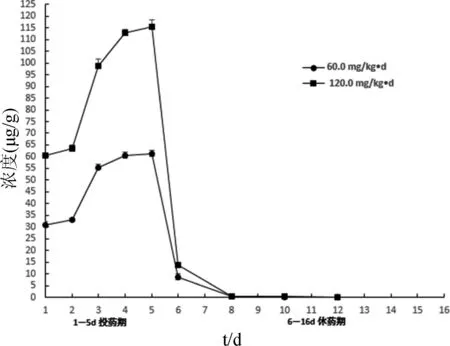
图2 鸡排泄物中AMP的残留消除曲线
3 讨论
3.1 检测器的选择与衍生条件的优化 目前,氨苄西林(AMP)的HPLC检测方法国内外虽有不少报道[9-10],但选择的检测器有紫外检测器、荧光检测器等。本试验选择荧光检测器(Waters 2475型)进行检测,采用衍生化反应使AMP的母体β-内酰胺产生荧光发色基团。通过邻苯二甲醛、水杨醛、苯甲醛、甲醛等衍生化试剂进行比较发现,目标物与水杨醛的衍生产物具有较高的灵敏度,所以本试验选用水杨醛作为衍生试剂。AMP衍生化条件为:100 μL 15%三氯乙酸、水杨醛20 μL、100 ℃ 沸水浴1 h。
3.2 鸡排泄物中AMP的残留消除规律 试验组鸡按体重分别以60.0、120.0 mg/(kg·d)剂量内服给药AMP,每天1 次,连续5 d。试验结果表明:在投药第1 d时,AMP在鸡排泄物中残留量被检测到,投药第5 d时达到峰值。休药后AMP在鸡排泄物中残留量迅速降低,AMP在鸡排泄物中的半衰期较短。正常剂量组,休药第7 d时,AMP在鸡排泄物中残留量低于检测限。双倍剂量组,在休药第9 d时,AMP在鸡排泄物中残留量低于检测限。鸡排泄物中的AMP残留量与给药剂量的大小呈正相关,AMP在鸡排泄物中高含量残留存在较大的环境风险。
[1] 中华人民共和国农业部.动物性食品中兽药最高残留限量[S].
[2] Commission Regulation (EU) No 37/2010 of 22 December 2009 on pharmacologically active substances and their classification regarding maximum residue limits in food stuffs of animal origin [Z].
[3] 李文平,阚鹿枫,马浩.微生物法测定鸡肉组织中的氨苄西林残留[J].中国兽药杂志,2004,38(9):20-22.
[4] 吴遐,绍辉,王鑫,等.试管扩散法检测牛乳中β-内酰胺类抗生素残留研究[J].东北农业大学学报,2011,42(5):31-35.
[5] Heeyong L,Jung S L,Hye S L.Simultaneous determination of ampicillin and metampicillin in biological fluids using high-performance liquid chromatography with column switching[J].Journal of Chromatography B,1995,664:335-340.
[6] Valentina G,Guglielmo D. Liquid chromatography with fluorescence detection of amoxicillin and ampicillin in feeds using pre-column derivatization[J].Analytica Chimica Acta,2003,483:69-72.
[7] Verdon E, Couedor P.Determination of ampicillin residues in milk by ion-pair reversed phase high performance liquid chromatography after precolumn derivatization[J].Journal of Pharmaceutical and Biomedical Analysis,1996,14:1201-1207.
[8] Sun L R, Jia L F, Xie X,etal. Quantitative analysis of amoxicillin, its major metabolites and ampicillin in eggs by liquid chromatography combined with electrospray ionization tandem mass spectrometry [J].Food Chemistry,2016,192:313-318.
[9] Luo W H,Jr Catharina Y W,Harold C T.Rapid method for the determination of ampicillin residues in animal muscle tissues by high-performance liquid chromatography with fluorescence detection[J].Journal of Chromatography B,1997,694:401-407.
[10]Luo W H, Eugene B H,Jr Catharina Y W,etal. Simultaneous determination of amoxicillin and ampicillin in bovine milk by HPLC with fluorescence detection [J]. Journal of Agricultural and Food Chemistry,1997,45:1264-1268.
(编辑:陈希)
Ampxicillin Residue Depletion in Chicken Excrement
WANG Bo1.2, ZHANG Yang-yang1.2, XIE Kai-zhou1.2*, LIU Jian-yu1.2, LIU Ya-nan1.2,GAO Qiang1.2, GUO Hui-sheng1.2, ZHANG Gen-xi1.2, DAI Guo-jun1.2, WANG Jing-yu1.2
(1.CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China; 2.KeyLaboratoryforAnimalGenetic,Breeding,ReproductionandMolecularDesignofJiangsuProvince,Yangzhou225009,China)
A study on Ampxicillin (AMP) residue depletion was conducted in chicken excrement. AMP was deproteinized from chicken excrement with acetonitrile, the analyte was extracted by saturated dichloromethane. The supernatant was reacted with salicylaldehyde under acidic and boiling conditions. Finally, AMP was determinated by high performance liquid chromatography (HPLC) with fluorescence detector. The excitation wavelength was set at 354 nm and emission wavelength was set at 445 nm. The average recovery in chicken excrement was 74.96 %~80.41 % with coefficients of variation (CV) lower than 9.77 %. The limit of detection (LOD) was 1.2 μg/kg(S/N ≥ 3)and the limit of quantitation (LOQ) was 3.5 μg/kg(S/N ≥ 10). After the chickens were orally administered successively AMP of 60.0 mg/kg and 120.0 mg/kg of body weight one time every day for 5 days, AMP residues in chicken excrements was detected at the first day, the maximum residues of AMP in chicken excrement were at the 5th day. Normal dose group, AMP residues in chicken excrement was lower than LOD at the 7th withdrawal day. Double dose group, AMP residues in chicken excrement was lower than LOD at the 9th withdrawal day. The residues of AMP in chicken excrement were all positively correlated with AMP orally administered doses. There are environmental risks with high residues of AMP in chicken excrement.
Ampxicillin;HPLC with fluorescence detection;residue depletion;chicken excrement.
国家肉鸡产业技术体系专项(CARS-42-G23);江苏高校优势学科建设工程资助项目(201410);扬州大学"新世纪人才工程"资助项目(201406)
王波,硕士,从事畜产品安全生产与环境控制的研究。
谢恺舟。E-mail:yzxkz168@163.com
2016-03-23
A
1002-1280 (2016) 06-0033-06
S859.84
