猪繁殖与呼吸综合征病毒入侵受体唾液酸黏附素的表达与纯化
2016-02-06马红芳乔松林张改平
侯 婕,李 睿,马红芳,乔松林,张改平*
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 河南省动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002)
猪繁殖与呼吸综合征病毒入侵受体唾液酸黏附素的表达与纯化
侯 婕1,2,李 睿2*,马红芳1,2,乔松林2,张改平1,2*
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 河南省动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002)
为了探究猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)假定受体唾液酸黏附素(sialoadhesin,Sn)的结构生物学信息及其在PRRSV入侵过程中所发挥的作用,利用昆虫表达系统(果蝇胚胎细胞,S2细胞)表达了猪源Sn v-set Ig-like 结构域重组蛋白,并进行了Western blotting检测、质谱检测及镍柱纯化试验。结果表明,成功表达了目的重组蛋白,表达的重组蛋白序列与Sn v-set Ig-like 结构域目的蛋白序列100%匹配,且获得的重组蛋白具有生物学活性,纯度高达99%。
猪繁殖与呼吸综合征病毒; 唾液酸黏附素; v-set Ig-like结构域; S2细胞
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是一种由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的高度接触性传染性疾病。1987年,PRRS最早在美国养猪场中发现,其主要特征是妊娠母猪的繁殖障碍、各年龄阶段猪的呼吸性疾病,还会引起猪机体严重的免疫抑制现象[1-6]。1996年,我国学者郭宝清等首次从国内流产猪胎中分离到PRRSV[7]。该病自发现以来,在我国广泛流行,造成重大经济损失,严重影响我国养猪业的健康发展[8]。
PRRSV是一种有囊膜的单股正链RNA病毒。由于PRRSV 对养猪生产的危害巨大,加之本身具有易变异和持续性感染等特性,一直是兽医领域的重点研究对象,其中PRRSV的入侵机制一直是研究热点。大量研究已证实,PRRSV是通过宿主细胞表面受体介导病毒入侵宿主细胞,巨噬细胞和树突状细胞是该病毒的主要宿主细胞[9]。目前,国内外已鉴定多种与PRRSV入侵相关受体,如硫酸乙酰肝素(heparin sulphate,HS)、唾液酸黏附素(sialoadhesin,Sn) 和CD163(cluster of differentiation 163)等,它们共同协助完成PRRSV的入侵和复制增殖过程[10-11]。其中,Sn是在部分分化巨噬细胞表面表达的凝集素,是唾液酸黏附素家族成员。自1985年Sn首次在绵羊红细胞上被发现,特别是猪源Sn作为PRRSV感染靶细胞的假定受体发现以来,研究学者采用多种方式和方法对PRRSV与Sn相互作用进行了研究。Duan等[12]用猪肺泡巨噬细胞(porcine alveolar macrophage,PAM)膜蛋白免疫小鼠筛选获得了1株单克隆抗体,将其命名为mAb41D3,该单抗可保护PAM细胞不感染PRRSV。Delputte等[13]研究发现,在PRRSV感染过程中,HS和Sn协调作用:PRRSV 首先与HS 相互作用使病毒聚集到细胞表面,但是这一作用十分微弱;随后PRRSV与Sn 结合增强了第一步的结合作用,然后在网格蛋白介导的内吞作用下病毒-受体复合物内化进入细胞内。这一过程中,PRRSV内吞不依赖HS,该过程Sn可单独完成,但是在HS存在的情况下,Sn更容易结合病毒完成内吞。对Sn在PRRSV体外感染PAM的过程进行深入研究发现,PRRSV M蛋白与GP5蛋白形成异源二聚体,通过GP5与PAM细胞表面受体Sn相互作用介导PRRSV 内吞并形成内吞小体,然后在CD163受体协助下内吞[14]。所以,Sn在PRRSV感染靶细胞的吸附和内吞过程中发挥着重要作用,是PRRSV入侵的必需受体。进一步研究发现,Sn的v-set Ig-like 结构域在PRRSV入侵过程中起主要作用[15],但目前其结构生物学机制尚不清楚,这成为深入理解Sn作用机制及PRRSV 入侵过程的阻碍。
为此,本研究利用昆虫表达系统(果蝇胚胎细胞,S2细胞)克隆表达并纯化了猪源Sn的v-set Ig-like 结构域,旨在为后续的结构生物学研究及进一步从结构生物学角度阐明Sn在PRRSV感染过程中的具体作用及PRRSV入侵的分子机制奠定分子基础。
1 材料和方法
1.1 材料
果蝇胚胎细胞(drosophila schneider-2cell,S2细胞)和大肠杆菌DH5α 感受态细胞为河南省动物免疫学重点实验室保存。
pMT/Bip/V5-HisA载体、pCoBlast载体、猪源Sn全长cDNA均为河南省动物免疫学重点实验室保存。
1.2 工具酶及试剂
Phusion高保真DNA聚合酶、BglⅡ和MluⅠ内切酶、T4 DNA连接酶、DNA Marker DL2000均购自大连TaKaRa公司。彩虹246广谱蛋白质Marker (5~246 ku)购自北京索莱宝科技有限公司。Cellfectin Ⅱ脂质体转染试剂、Schneider’s Drosophila Medium (SFM)、Blasticidin购自美国Invitrogen公司。AEC底物显色试剂盒、质粒提取试剂盒、DNA纯化回收试剂盒及抗组氨酸(His)标签抗体均购自北京天根生化科技公司。
1.3 引物设计
根据GenBank中发表的猪源Sn序列设计1对引物[引物序列见表1,由生工生物工程(上海)股份有限公司合成],分别引入BglⅡ和MluⅠ酶切位点,用以扩增Sn v-set Ig-like结构域蛋白基因片段。
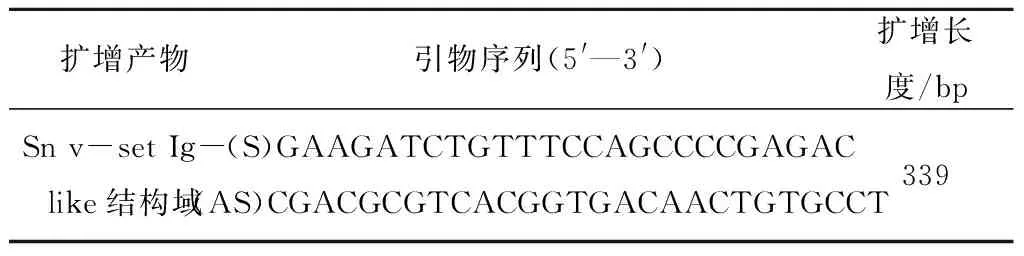
表1 试验所用PCR引物
1.4 Sn v-set Ig-like 结构域蛋白基因的扩增
以猪源Sn全长cDNA为模板,用Phusion高保真DNA聚合酶扩增目的基因。PCR反应体系为50 μL:S 2.5 μL(10 μmol/L)、AS 2.5 μL(10 μmol/L)、dNTP 4 μL(2.5 mmol/L)、5×H Buffer (含Mg2+)10 μL、Phusion高保真 DNA聚合酶0.5 μL、ddH2O 29.5 μL、Sn全长cDNA 1 μL进行PCR扩增。扩增条件为:98 ℃预变性2 min;98 ℃变性25 s,54 ℃退火25 s,72 ℃延伸15 s,30个循环;而后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳分析检测。
1.5 Sn v-set Ig-like 结构域重组载体的构建
用北京天根生化科技公司的DNA纯化回收试剂盒纯化PCR 扩增产生的Sn v-set Ig-like 结构域蛋白目的基因片段,将纯化后的PCR 产物及表达载体pMT/Bip/V5-HisA用限制性内切酶BglⅡ和MluⅠ于37 ℃进行双酶切。应用回收试剂盒将表达载体pMT/Bip/V5-HisA和酶切目的基因片段纯化后进行连接,连接反应体系为10 μL:Sn v-set Ig-like结构域蛋白目的基因片段5 μL、pMT/Bip/ V5-HisA载体3 μL、T4 DNA连接酶缓冲液1 μL、T4 DNA连接酶1 μL。16 ℃连接8 h后,转化大肠杆菌DH5α 感受态细胞,挑选散在的菌落进行PCR检测,检测样品经1% 琼脂糖凝胶电泳鉴定,鉴定正确的阳性克隆送生工生物工程(上海)股份有限公司测序。
1.6 细胞转染与稳定细胞筛选
向无血清的SFM中加入10 μL Cellfectin Ⅱ,轻轻混匀,室温放置30 min;将4 μg经除菌的重组载体质粒和pCoBlast筛选载体溶入100 μL SFM中,混匀后,室温静置30 min备用;二者轻轻混合均匀后,再室温静置15 min。将脂质体/重组载体质粒混合物缓慢滴加至S2细胞培养物中,28 ℃静置转染12 h,然后将孔中转染混合液吸出,加入3 mL含胎牛血清的培养基(SM),28 ℃静置培养2 d。待细胞生长状态良好,将孔中原有培养液吸出,向每个培养孔中加入3 mL含25 μg/mL Blasticidin的新鲜SM培养基,轻摇混匀后,28 ℃静置培养3 d,然后观察筛选情况。2~3 d换液1 次,待对照细胞全部死亡后,即筛选得到具有Blasticidin抗性和目的基因的稳定重组果蝇S2细胞。
1.7 重组细胞的诱导表达
用无血清培养基SFM扩大培养筛选得到的稳定重组细胞至1 L。待细胞数达到3~6×105个/mL,加入终浓度0.75 mmol/L的CuSO4溶液进行诱导表达,诱导120 h后离心,收取诱导表达上清液。浓缩上清液后进行15%SDS-PAGE电泳及抗组氨酸标签Western blotting鉴定,将诱导表达条带切下,送生工生物工程(上海)股份有限公司进行质谱检测。
1.8 镍柱纯化目的重组蛋白
使用镍NTA亲和柱,用20 mmol/L pH值8.0的 Tris-HCl、150 mmol/L NaCl的缓冲液平衡5个柱体积。将含目的重组蛋白的细胞诱导表达上清液缓慢流过镍柱,上样结束后用20 mmol/L pH值8.0的 Tris-HCl、150 mmol/L NaCl缓冲溶液进行平衡5个柱体积,然后分别用含20、50、150 mmol/L咪唑的20 mmol/L Tris-HCl及150 mmol/L NaCl洗脱液依次从低浓度到高浓度进行洗脱,收集洗脱液,收集完后取样品进行15%SDS-PAGE电泳检测。
2 结果与分析
2.1 Sn v-set Ig-like 结构域蛋白基因的PCR扩增结果
以猪源Sn全长cDNA为模板,利用设计的上游引物S和下游引物AS进行PCR,以Phusion高保真DNA聚合酶扩增Sn v-set Ig-like 结构域目的基因片段,用1%琼脂糖凝胶电泳检测扩增产物,结果显示,扩增出了与预期大小相同的339 bp条带。表明成功扩增出目的基因片段(图1)。

M.DNA Marker; 1.Sn v-set Ig-like 结构域图1 Sn v-set Ig-like结构域的PCR扩增
2.2 pMT/Sn v-set Ig-like 结构域重组载体的菌落PCR鉴定
将构建的pMT/Sn v-set Ig-like 结构域重组载体转化克隆菌大肠杆菌DH5α,经菌落PCR 筛选阳性重组子,结果显示,目的基因片段339 bp已插入表达载体,重组载体构建成功(图2)。后经测序鉴定,插入目的基因片段正确(测序结果未列出)。
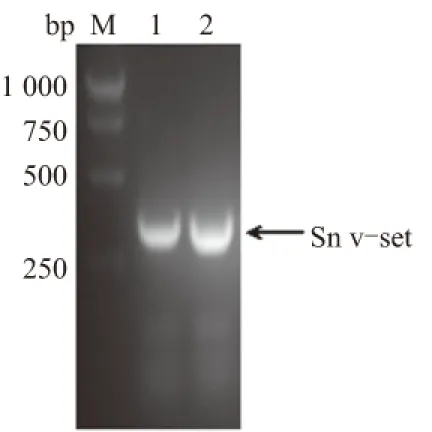
M.DL2000 Marker; 1—2.pMT/Sn v-set Ig-like结构域图2 pMT/Sn v-set Ig-like结构域的菌落PCR鉴定
2.3 稳定重组细胞诱导表达上清的SDS-PAGE鉴定及Western blotting鉴定
电泳结果所示,重组载体稳定转染细胞的表达上清与空载体稳定转染细胞表达上清相比,在15 ku处出现了1条明显的条带,该条带的分子质量大小与理论计算值相符。抗组氨酸标签Western blotting检测结果显示,该细胞表达了带有组氨酸标签的重组蛋白(图3)。以上结果表明,稳定重组细胞表达了Sn v-set Ig-like 结构域目的蛋白。
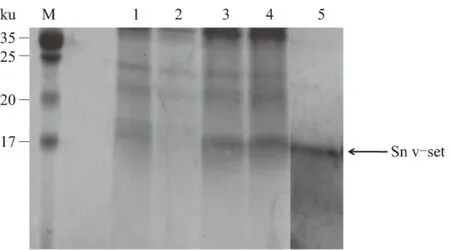
M.标准蛋白质Marker; 1、2.空载载体转染后小量诱导表达对照; 3、4.Sn v-set Ig-like结构域表达载体转染后小量诱导表达; 5.Sn v-set Ig-like结构域表达载体转染后小量诱导表达,抗组氮酸标签Western blotting
2.4 重组蛋白的质谱检测及活性鉴定
质谱检测结果表明,本研究诱导表达的重组蛋白为Sn v-set Ig-like结构域,进一步验证了重组昆虫细胞表达重组蛋白的正确性。表2为部分序列比对结果。

表2 目的蛋白序列与质谱结果序列比对
注:1.目的蛋白序列; 2.质谱结果。
2.5 镍柱纯化目的蛋白质
经镍柱纯化,能够将目的蛋白与杂蛋白分离开,150 mmol/L咪唑洗脱纯化后目的蛋白纯度较高,纯度达到99%以上(图4)。以上结果表明,经镍柱一步纯化得到的高纯度蛋白可用于下一步蛋白质结晶试验。

M.标准蛋白质Marker; 1.150 mmol/L咪唑洗脱蛋白质图4 重组蛋白镍柱纯化
3 讨论
Sn是PRRSV入侵的必需受体,但PRRSV也可感染不含Sn的非洲绿猴肾上皮细胞系MA-104及其衍生的MARC-145细胞系等;另外CD163单独即可以介导PRRSV 的内吞[16-19]。最近有研究表明,Sn基因敲除猪仍然能够被PRRSV感染,证明Sn并非是PRRSV 感染的必需受体[20]。因此,对于Sn在PRRSV入侵过程中的功能,及其是否为PRRSV入侵必需受体存在争议。即使Sn是PRRSV入侵必需受体,目前对于猪源Sn,特别是Sn v-set Ig-like结构域的结构和功能及其与PRRSV GP5蛋白和M蛋白之间相互作用仍缺乏深入了解。为了解决这些问题,应首先获得高纯度、具有生物学活性的Sn v-set Ig-like结构域蛋白。
本研究开展了猪源Sn v-set Ig-like结构域在果蝇S2细胞中的克隆及表达。果蝇S2细胞表达系统(drosophila expression system,DES)作为昆虫表达系统克服了原核细胞表达系统表达Sn的缺点,表达的目的蛋白能进行翻译后加工过程,如二硫键的形成和糖基化修饰等,使其结构与功能接近天然蛋白。同时,表达产物能分泌到培养基中便于分离纯化。而且,与哺乳动物细胞表达系统相比,还具有表达量高的优点。另外,S2细胞的半贴壁特点使其易于悬浮培养,对生长环境无过高要求(可在无血清、无CO2环境下生长),便于规模化生产,是一种理想的外源蛋白表达细胞[21-25]。本研究结果也证明了这些优势:纯化后的蛋白质纯度较高;经免疫学和质谱鉴定,重组目的蛋白表达正确。目前,经纯化后的重组蛋白结晶正在进行中,以期从结构生物学角度,研究假定入侵受体Sn是否是PRRSV入侵必需受体,研究Sn单体的结构与功能,明确参与病毒相互作用的重要结构域和关键作用位点,为深入理解PRRSV入侵的分子机制,从而为PRRSV的临床药物开发和疫苗的研制提供结构理论依据。
[1] 鲍登克.猪繁殖与呼吸综合征病毒细胞受体CD163、Sn的克隆及功能鉴定[D].郑州:河南农业大学,2011.
[2] 张美玲,简子健,陆桂丽,等.猪繁殖与呼吸综合征病毒新疆株的分离与鉴定[J].天津农业科学,2013,20(11):31-34.
[3] 夏九鲜,李锐,周显珍,等.PRRSV感染不同时期IFN-γ表达量分析[J].现代农业科技,2013(5):275-276.
[4] 王小敏,何孔旺,周忠涛,等.猪繁殖与呼吸综合征病毒变异株的分离鉴定及遗传变异分析[J].华北农学报,2014,29(1):232-238.
[5] 赵朴,郑玉姝,赵坤,等.猪呼吸道疾病综合征常见病毒多重PCR方法的建立及应用[J].华北农学报,2014,29(3):64-67.
[6] 韩一超,刘文俊,姚敬明,等.猪繁殖与呼吸综合征病毒Shanxi-6株全基因序列分析[J].华北农学报,2014,29(2):62-65.
[7] 郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996(2):3-7.
[8] 刘明,张改平,肖志军,等.PRRSV河南株ORF7基因的克隆表达及条件优化[J].河南农业科学,2011,40(1):136-140.
[9] 蒋志政,张改平,刘明阳,等.抗猪FcγRⅡb多抗阻断猪繁殖与呼吸综合征病毒抗体依赖增强作用研究[J].河南农业科学,2012,41(4):139-142.
[10] Calvert J G,Slade D E,Shields S L,etal.CD163 expression confers susceptibility to porcine reproductive and respiratory syndrome viruses [J].J Virol,2007,81(14):7371-7379.
[11] Lee Y J,Lee C.Deletion of the cytoplasmic domain of CD163 enhances porcine reproductive and respiratory syndrome virus replication [J].Arch Virol,2010,155(8):1319-1323.
[12] Duan X,Nauwynck H J,Favoreel H W,etal.Identification of a putative receptor for porcine reproductive and respiratory syndrome virus on porcine alveolar macrophages [J].J Virol,1998,72(5):4520-4523.
[13] Delputte P L,Costers S,Nauwynck H J.Analysis of porcine reproductive and respiratory syndrome virus attachment and internalization:Distinctive roles for heparan sulphate and sialoadhesin [J].J Gen Virol,2005,86(5):1441-1445.
[14] Van Breedam W,Van Grop H,Zhang J Q,etal.The M/GP(5) glycoprotein complex of porcine reproductive and respiratory syndrome virus binds the sialoadhesin receptor in a sialic acid-dependent manner [J].PLoS Pathog,2010,6(1):1000730.
[15] Delputte P L,Nauwynck H J.Porcine arterivirus entry in macrophages:Heparansulfate-mediated attachment,sialoadhesin-mediated internalization,and a cell-specific factor mediating virus disassembly and genome release [J].Adv Exp Meel Biol Springer,2006,581:247-252.
[16] Delputte P L,Costers S,Nauwynck H J.Analysis of porcine reproductive and respiratory syndrome Virus attachment and internalization:Distinctive roles for heparan sulphate and sialoadhesin[J].J Gen Virol,2005,86(5):1441-1445.
[17] Van Gorp H,Van Breedam W,Delputte P L,etal.Sialoadhesin and CD163 join forces during entry of the porcine reproductive and respiratory syndrome virus[J].J Gen Virol,2008,89(12):2943-2953.
[18] Delputte P L,Van Breedam W,Delrue I,etal.Porcine arterivirus attachment to the macrophage-specific receptor sialoadhesin is dependent on the sialic acid-binding activity of the N-terminal immunoglobulin domain of sialoadhesin[J].J Virol,2007,81(17):9546-9550.
[19] An T Q,Tian Z J,He Y X,etal.Porcine reproductive and respiratory syndrome virus attachment is mediated by the N-terminal domain of the sialoadhesin receptor [J].Vet Microbiol,2010,143(2/3/4):371-378.
[20] Prather R S,Rowland R R,Ewen C,etal.An intact sialoadhesin (Sn/SIGLEC1/CD169) is not required for attachment/internalization of the porcine reproductive and respiratory syndrome virus[J].J Virol,2013,87(17):9538-9546.
[21] 范旭.唾液酸粘附素胞外区结构域的原核表达及抗体活性研究[D].郑州:河南农业大学,2010.
[22] 李振.猪唾液酸黏附素抗原表位蛋白在大肠杆菌体内的表达及其多克隆抗体的制备[D].保定:河北农业大学,2012.
[23] 张继希,张志远,张宜娜,等.猪唾液酸粘附素氨基端结构域基因的克隆表达及其多克隆抗体制备[J].中国畜牧兽医,2012,39(9):50-53.
[24] 秦运杰,李娜娜,王冬梅,等.猪唾液酸黏附素胞外区在PRRSV感染PAM细胞中的作用[J].中国兽医学报,2015,35(7):1112-1118.
[25] 史利军,吕茂民,黎诚耀,等.西尼罗病毒E蛋白结构域Ⅲ在昆虫S2细胞中的表达与鉴定[J].中国兽医学报,2008,28(11):1288-1291.
Expression and Purification of Sialoadhesin,a Putative Receptor of Porcine Reproductive and Respiratory Syndrome Virus
HOU Jie1,2,LI Rui2*,MA Hongfang1,2,QIAO Songlin2,ZHANG Gaiping1,2*
(1.College of Animal Science and Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China;2.Key Laboratory of Animal Immunology of the Ministry of Agriculture/Henan Provincial Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
Sialoadhesin (Sn) is a putative receptor of porcine reproductive and respiratory syndrome virus (PRRSV).In order to explore its structural information and the specific role in PRRSV infection,this study cloned,expressed porcine Sn v-set Ig-like domain in S2 (drosophila schneider-2) cells,western blotting,mass spectrometry and Ni-sepharose purification were carried out.The results showed that the recombinant protein was successfully expressed and the sequence of the recombinant protein totally matched target Sn v-set Ig-like domain(100%).The purity of the biologically active target protein was 99%.
PRRSV; sialoadhesin; v-set Ig-like domain; S2 cell
2015-09-12
国家自然科学基金重大项目(31490601);河南省基础与前沿技术研究项目(162300410252)
侯 婕(1991-),女,河南舞阳人,在读硕士研究生,研究方向:动物微生物学和免疫学。 E-mail:Dreamy-Jenny@163.com
*通讯作者:李 睿(1986-),男,河南郑州人,助理研究员,博士,主要从事PRRSV蛋白质结构与功能研究工作。 E-mail:lirui860620@sina.com 张改平(1960-),男,河南内黄人,研究员,博士,主要从事动物生物工程技术研究工作。 E-mail:zhanggaiping2003@163.com
S855.3
A
1004-3268(2016)03-0130-05
