春季枣疯病植原体在树体内的分布及对叶片组织发育的影响
2016-02-06杨宝江陈招荣
刘 栋,李 晴,杨宝江,陈招荣
(天津农学院 园艺园林学院,天津 300384)
春季枣疯病植原体在树体内的分布及对叶片组织发育的影响
刘 栋,李 晴,杨宝江,陈招荣*
(天津农学院 园艺园林学院,天津 300384)
为明确枣疯病植原体早春在枣树植株体内的移动和分布,揭示枣疯病植原体的致病机制,利用nested-PCR法检测春季枣树新生枝叶中枣疯病植原体的积累情况,结果显示,发病丛枝春季可以部分萌发,初期即含有植原体。轻度发病植株植原体分布不均匀,主要分布在发病枝和相邻部位;重度发病植株各部位枝条均可带毒,植原体检出时间与距离发病枝条远近相关。用石蜡切片法比较分析叶片组织结构,结果显示,枣疯病植原体侵染导致叶片结构发育受到抑制,叶片厚度减小,角质层和表皮细胞变薄,薄壁细胞显著减少,叶脉组织结构排列紊乱,形成层和薄壁细胞明显变形和减少,厚角细胞和晶体分泌细胞明显减少。
枣疯病; 植原体; 巢式PCR; 分布; 组织结构
枣(ZiziphusjujubaMill.)原产于我国黄河流域,栽培历史悠久,是我国特有干果和经济林树种[1]。由于枣树具有抗寒、抗旱、耐涝、耐盐碱等特点并产生较高的经济价值,近年来在天津地区种植面积不断扩大,成为发展最快的经济林树种,目前天津静海县种植枣树超过1.4万hm2,且呈逐年平稳增长趋势,被誉为中国金丝小枣之乡[2]。在枣生产过程中,由植原体引起的一类系统性病害——枣疯病(jujube witches’ broom)对枣树具有毁灭性,遍布于我国各大枣区,严重阻碍了枣树产业的发展。
枣疯病的主要症状为花器返祖和枝芽不正常萌发生长,1 a多次连续萌生细小枝叶,形成丛枝,叶色黄绿,冬季不落,植株发病初期只在局部枝条上显症,然后扩散到全株,无法正常结果[3]。通过电子显微镜观察发病组织超薄切片可以发现,在寄主韧皮部筛管细胞中有无细胞壁的植原体粒子存在[3]。DAPI染色技术及显微观察发现,植原体主要聚集在韧皮部组织中[3-4]。植原体的侵染影响了植物体的基因表达[5-6],干扰了植物的正常生理代谢,降低植株叶片叶绿素含量,影响光合作用[6-8],同时使各种蛋白质[6]、激素[9]、酶类[10-12]及其他活性物质和次生代谢物质[13]都发生改变。一般来说病害产生首先发生生理上的病变,然后引起组织结构病变,最后导致形态上的病变。已有大量研究针对枣疯病的生理病变和形态病变开展,对阐明枣疯病植原体侵染和发病机制提供了大量的证据,但是关于组织结构病变的研究较少。为此,以春季萌芽的枝条作为研究对象,分析发病程度不同的植株中枝条萌动和植原体分布情况,利用石蜡切片法观察发病和健康叶片结构差异,分析枣疯病症状表现及生理生化变化相关的植物组织结构变化,进一步解释枣疯病植原体的致病机制,为枣疯病的防治提供理论依据。
1 材料和方法
1.1 材料
春季新生叶采集于天津农学院院内及院外绿化带内种植枣树。院内枣树表现为局部丛枝,根据刘孟军等[4]提出的枣疯病分级标准,将其疯枝病情定为Ⅱ级;院外枣树表现为整株全疯,疯枝病情定为Ⅳ级。每棵树分别采样,设3次重复。
1.2 方法
1.2.1 枣疯病植原体PCR检测 4月20日、5月10日和5月30日上午9:00—10:00分别从不同枣树上采集相同部位完全展开叶,其中“疯枝”为枝条萌发后呈丛枝症状的枝条,“疯枝旁健枝”为离疯枝最近的健康枝条,“远端健枝”为离疯枝最远端的健康枝条。样品总DNA提取参照天根公司植物基因组DNA提取试剂盒(DP305-02)说明书。植原体16S rRNA基因扩增采用Lee等[14]报道的通用引物 R16mF2/R16mR1(5′-CTAGCAAGTCAAGTCGAAC-
GGA-3′,5′-CTTAACCCCAATCATCGAC-3′;退火温度60 ℃),反应体系为20 μL,PCR产物于4 ℃保存备用。nested-PCR扩增根据 Gunderson等[15]的方法合成 nested-PCR引物,分别为R16F2n(5′-GAAACGACTGCTAAGACTGG-3′)和R16R2n(5′-TGACGGGCGGTGTGTACAAACCCCG-3′)。将前一步获得的PCR产物稀释30倍后分别作为DNA模板,进行nested-PCR反应,退火温度为57 ℃。取5 μL PCR产物进行1%的琼脂糖凝胶电泳,经EB染色后在紫外检测仪254 nm波长下观察并拍照记录数据。
1.2.2 石蜡切片制作及分析 5月30日9:00—10:00从不同枣树上采集相同部位完全展开叶,分别制作健康叶片和发病叶片的石蜡切片,具体流程如下:FAA (38%甲醛、冰醋酸和70%酒精按1∶1∶18体积比混合)固定24 h以上,经洗涤、酒精脱水、二甲苯透明、浸蜡、包埋、切片、贴片、二甲苯脱蜡、酒精复水、1%番红12 h和1%固绿30 s染色、洗涤和脱水、中性树胶封片干燥后,采用Leica_DM4000B显微观察、Leica DFC450 CCD相机拍照。显微照片用图像分析软件LAS V4.2处理,测量角质层、上表皮、下表皮、栅栏组织和海绵组织厚度及叶厚等指标,比较叶片主叶脉的维管束、薄壁组织、厚角组织、分泌细胞等结构差异。每个处理制作5片以上封片,经镜检拍照后的每个显微图片各指标测量计算不少于12次,再进行统计分析。
2 结果与分析
2.1 春季枣疯病植原体在树体组织中的分布情况
在林间观察发现,4月中旬枣树陆续开始萌动,4月20日健康植株和枝条萌发出新枝和新叶,而发病枝条比健康枝条推迟10~15 d萌发。本研究通过nested-PCR法对所采集样品进行植原体检测,结果表明,不同疯枝级别的植株春季新萌发的疯枝中(5月10日)均检测到植原体存在,而且随着时间的推移,植原体含量在逐步增加(表1)。在疯枝级别为Ⅱ级植株中“疯枝旁健枝”萌发较疯枝级别为Ⅳ级的植株更早,4月20日和5月10日采集“疯枝旁健枝”上的叶片未能检测到植原体,直至5月30日第3次采集时检测到了植原体。而在疯枝级别为Ⅳ级的植株中,4月20日 “疯枝旁健枝”尚未萌芽,5月10日采集的“疯枝旁健枝”上的叶片中检测到了植原体。在疯枝级别为Ⅱ级植株中,“远端健枝”从萌芽开始直至本研究检测结束均未检测到植原体,说明在轻度发病的植株中远离发病部位的组织不带毒。在疯枝级别为Ⅳ级的植株中, “远端健枝”刚萌发枝叶未被植原体感染,但是从5月10日开始均检测到植原体的存在,说明植原体几乎遍布了发病严重的Ⅳ级植株各个组织。
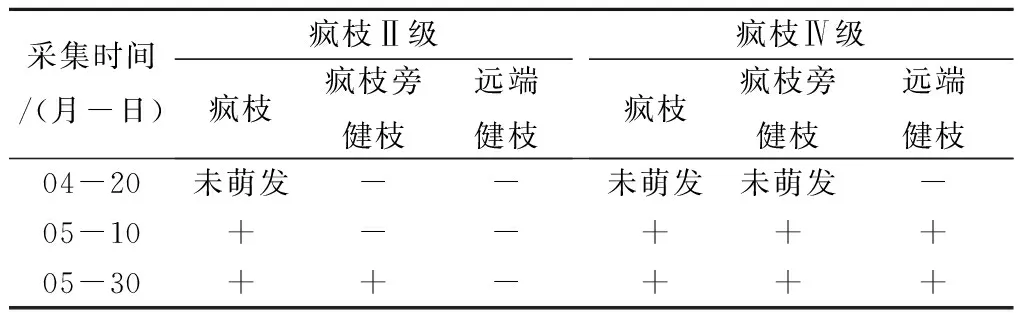
表1 春季枣疯病植原体在树体组织中的检测结果
注:“-”表示nested-PCR检测为阴性;“+” 表示nested-PCR检测为阳性。
2.2 枣疯病植原体侵染对植株叶部组织结构的影响
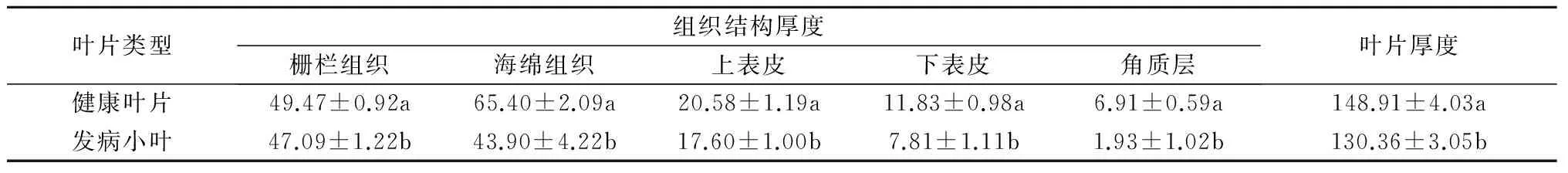
2.2.1 叶片组织结构 健康叶片与发病小叶组织结构比较结果见图1和表2。枣属于耐旱植物,其角质层(A)较厚,健康叶片角质层为(6.91±0.59) μm,而被植原体侵染后角质层(a)厚度显著降低,仅为(1.93±1.02) μm。枣健康叶片的栅栏组织(C)发达,海绵组织(D)少且不典型,具有海绵组织向栅栏组织过渡的特征,一般由5~6层细胞组成,栅栏组织厚度为(49.47±0.92) μm,海绵组织厚度为(65.40±2.09) μm;发病疯枝小叶叶肉组织细胞明显减少为4~5层,且第2层以下细胞排列松散,由长柱形变化为近球形松散海绵组织细胞(d),细胞间隙明显增大,栅栏组织(c)厚度为(47.09±1.22) μm,海绵组织厚度(43.90±4.22) μm,栅栏组织和海绵组织厚度与健康叶片相比差异显著。植原体侵染后小叶的上表皮(b)和下表皮(e)厚度分别为(17.60±1.00) μm和(7.81±1.11) μm,与健康叶片[B、E分别为(20.58±1.19)μm和(11.83±0.98) μm]相比也显著减小。整体上发病小叶的叶片厚度明显小于健康叶片,叶片细胞发育受到抑制。在健康叶片的叶肉细胞及近维管束组织周围存在着许多晶体和分泌细胞(F),但是发病小叶中的这些细胞(f)明显减少。

A、a为角质层; B、b为上表皮; C、c为栅栏组织; D、d为海绵组织; E、e为下表皮; F、f为分泌细胞。标尺为100 μm图1 健康叶片与发病小叶组织结构比较
μm
注:同列数据后标注不同小写字母代表差异显著(P<0.05)。
2.2.2 叶脉结构 枣疯病植原体主要存在于寄主植物维管束组织中,所以本研究比较分析了植原体侵染前后枣叶脉的结构变化情况,结果见图2。枣具三出脉,主脉由维管束和厚角组织组成,木质部在近轴面,韧皮部在远轴面,为外韧维管束。由图2可以看出,健康叶片叶脉各部分排列紧密整齐,木质部导管(A)依次发散型排列,紧接着是2~3层扁平细胞组成的形成层(B),韧皮部细胞(C)排列其后,然后是由4~5层薄壁细胞(D)和5~6层厚角细胞(F)组成的维管束鞘,在薄壁细胞和韧皮部细胞中存在着大量体积大、染色深的晶体和分泌细胞(E)。而发病小叶叶脉中各结构排列较为松散,其中形成层(b)细胞变形,与韧皮部细胞(c)无明显界线,薄壁细胞(d)严重变形、大小不均,厚角细胞(f)明显减少,平均只有3~5层。晶体和分泌细胞(e)也明显减少,这与叶片组织结构比较结果一致。

A、a为导管细胞; B、b为形成层; C、c为韧皮部细胞; D、d为薄壁细胞; E、e为晶体和分泌细胞; F、f为厚角细胞。标尺为100 μm图2 健康叶片叶脉与发病小叶叶脉组织结构比较
3 结论与讨论
植原体为专性寄生物,仅寄生于韧皮部有功能的筛管中,由于受到活动范围或植物抗病性的限制,会呈现出长时间局限分布在植株的某些部位,通过病原检测和症状观察,人们发现枣疯病症状与病原的存在具有高度相关性[16-17]。本研究利用nested-PCR法检测春季萌芽后不同疯枝等级枣树上不同部位新萌芽枝条中植原体的存在情况,结果表明,个别疯枝可以萌发新芽,萌发时间明显晚于健康枝条,而且萌芽伊始即可检测到植原体。健康枝条的新芽中开始未能检测到植原体,但随着时间推移病原分布与枝条离疯枝的距离呈一定相关性,与石小玉等[17]研究结果一致,其认为植原体的分布与症状出现的部位具有较高的相关性,在无症状的枝条中检测不到植原体或离发病部位越远,病原数量越少。在新发病植株中植原体呈不均匀分布,主要集中在疯枝上,而在重度发病植株中这种不均匀性减弱,在植株的各个部位包括远离发病部位的健康枝条中均可检测到植原体,因此,对于轻度发病植株可以采用病枝萌芽前去除疯枝的方法进行防治,有利于减缓病情发展,但对于重度发病植株,去除疯枝治疗效果并不理想。
枣树感染枣疯病后通常枝条节间变短、枝叶丛生、叶片黄化并且变小,研究表明,患枣疯病病树的净光合速率远远低于正常树水平,叶绿素含量明显降低,光合能力明显下降,光合作用受到明显抑制[7-8]。病叶的这些异常生理现象必然会导致组织病变。为了进一步分析枣疯病植原体导致寄主植物症状产生的机制,本研究分析了植原体侵染对寄主叶片结构的影响,结果发现,发病小叶角质层、栅栏组织、海绵组织、上下表皮厚度以及叶片厚度与健康叶片相比都明显减小,特别是叶肉细胞由5~6层减少到4~5层,海绵组织细胞间隙明显变大,细胞形态由长柱形变为近球形。罹患泡桐丛枝病的病枝小叶组织结构也出现类似的变化[18]。说明叶片组织发育受到抑制,导致光合作用效率降低,物质合成减缓,呼吸作用和蒸腾作用增强,最终出现黄化、小叶等症状。植原体主要存在于寄主韧皮部细胞,而且依赖筛管细胞进行系统移动[4],本研究发现植原体侵染会导致叶脉组织发生紊乱,木质部和韧皮部间的形成层细胞以及韧皮部细胞变形排列杂乱,说明植原体侵染影响了导管和筛管等细胞的分化和形成,将造成水分的“供给”与蒸腾“消耗”平衡失调,最终导致罹病枝条枯死。薄壁细胞是植物体贮藏物质的主要结构,植原体侵染导致叶脉和叶肉细胞中的薄壁细胞均发生变形和减少,必然会导致组织内淀粉、蛋白质以及各种酶类物质减少。在叶肉细胞和维管束组织中发现大量晶体和分泌细胞,这些细胞与叶片保水率及硬度密切相关[19],由于植原体侵染导致这些细胞大量减少,从症状上就表现出叶片的机械性能降低,并且改变了细胞的渗透势,减弱叶片吸水和保水能力,从而降低了罹病部位的抗性,导致大部分发病丛枝耐受不了冬季低温而死亡,春季部分萌发丛枝生长迟缓、发育不良。
本研究证明了春季枣树发病丛枝可萌发新芽且带有植原体,植原体的分布及扩散与距离发病部位的远近有关。发病叶片组织结构比较分析结果揭示了枣疯病发病后叶片的细胞结构发生变化,如细胞数量减少、排列紊乱,甚至某些特殊结构缺失等。这些研究结果对枣疯病发病机制的揭示具有积极意义,值得进一步探索和研究。
[1] 陈贻金,王庆贺,陈春雷,等.我国枣树栽培历史及现状[J].河南农业科学,1990(12):17-19.
[2] 范会鲜,张金海,王宝宾,等.天津市静海县枣树生产发展现状及趋势[J].北京农业,2010(36):31-34.
[3] 由淑贞,李登涛,范春秋,等.枣疯病研究进展[J].现代农业科技,2014(7):133-135.
[4] 刘孟军,赵锦,周俊义.枣疯病病情分级体系研究[J].河北农业大学学报,2006,29(1):31-33.
[5] Fan X,Qiao Y,Han Y,etal.High-throughput analysis and characterization ofZiziphusjujubetranscriptome jujube witches’ broom phytoplasma infected[J].Phytopathogenic Mollicutes,2015,5(1s):S9-S10.
[6] Liu Z G,Wang Y,Xiao J,etal.Identification of genes associated with phytoplasma resistance through suppressive subtraction hybridization in Chinese jujube[J].Physiolo-gical and Molecular Plant Pathology,2014,86:43-48.
[7] 刘雅倩,谢南南,赵锦,等.枣疯病植原体侵染对枣树叶绿素含量的影响[J].植物保护,2012,38(3):18-22.
[8] 刘雅倩,彭龙,宁强,等.枣疯病植原体对枣树叶绿素及几种保护性酶的影响[J].华北农学报,2012,27(2):213-217.
[9] 赵锦,刘孟军,代丽,等.枣疯病病树中内源激素的变化研究[J].中国农业科学,2006,39(11):2255-2260.
[10] 张淑红,高宝嘉,温秀军.枣疯病过氧化物酶及苯丙氨酸解氨酶的研究[J].植物保护,2004,30(5):59-62.
[11] 牛庆霖,冯殿齐,王玉山,等.盐碱胁迫对枣疯病枝过氧化物酶与苯丙氨酸解氨酶的研究[J].中国农学通报,2010,26(2):100-104.
[12] 赵进红,王玉山,冯殿齐,等.药物处理对疯枣枝过氧化物酶和苯丙氨酸解氨酶活性的影响[J].山东农业大学学报(自然科学版),2010,41(3):360-364.
[13] 田国忠,张锡津,熊耀国,等.泡桐筛管内胼胝质与抗丛枝病关系的研究[J].植物病理学报,1994,24(4):352.
[14] Lee I,Hammond R,Davis R,etal.Universal amplification and analysis of pathogen 16S rDNA for classification and identification of mycoplasmalike organisms[J].Phytopathology,1993,83(8):834-842.
[15] Gunderson D,Lee I.Ultrasensitive detection of phytoplasmas by nested-PCR assays using two universal pri-merpairs[J].Phytopath Medit,1996,35(3):144-151.
[16] 赵锦,刘孟军,周俊义,等.枣疯植原体的分布特点及周年消长规律[J].林业科学,2006,42(8):144-146,149.
[17] 石小玉,郝少东,王合,等.枣疯病植原体越冬后向枣树不同类型新生组织转移特性研究[J].北京农学院学报,2014,29(3):56-60.
[18] 陈育民.丛枝病对泡桐叶片解剖构造生理生化及材性的影响[J].西北林学院学报,1992,7(4):50-57.
[19] 朱广龙.酸枣生理生化特性及结构特征对梯度干旱的响应[D].临汾:山西师范大学,2012.
Distribution of Jujube Witches’ Broom Phytoplasma in Plant and Leaves Microstructure of Pathogenetic Chinese Jujube in Spring
LIU Dong,LI Qing,YANG Baojiang,CHEN Zhaorong*
(College of Horticulture and Landscape,Tianjin Agricultural University,Tianjin 300384,China)
To identify the movement and distribution of jujube witches’ broom phytoplasma in the jujube plant and to reveal the disease pathogenic mechanism of phytoplasma,the distribution of jujube witches’ broom phytoplasma in germinated branches was analyzed by nested-PCR method.The results showed that part branches with jujube witches’ broom germinated in Spring and contained phytoplasma.In the plants with mild symptom phytoplasma asymmetrically distributed,which was limited in the witches’ broom and adjacent parts.In the plants with serious symptom phytoplasma existed in all tissues,and the content of phytoplasma was negatively correlated with the distance from the witches’ broom.Based on the paraffin sectioning method the microstructure of leaves was analyzed.The results showed that blade structure development was inhibited in the witches’ broom.The thickness of the leaves,cuticles and epidermal cells were significantly reduced.The number of parenchyma cells was decreased.The arrangement of leaf vain tissue was disordered.The cambium and epidermal cells deformed and reduced significantly.Collenchyma cells and secretory cells were also significantly decreased.
jujube witches’ broom; phytoplasma; nested-PCR; distribution; microstructure
2015-08-18
2014年国家级高等学校大学生创新创业训练计划(201410061006);天津市优秀青年教师培养计划项目;天津市高等学校科技发展基金计划项目(2140622)
刘 栋(1992-),男,内蒙古阿拉善左旗人,在读本科生,研究方向:林学。E-mail:Liudong@tjau.edu.cn
*通讯作者:陈招荣(1980-),女,福建三明人,讲师,博士,主要从事植物保护教学与研究工作。 E-mail:chenzr@tjau.edu.cn
S436.65
A
1004-3268(2016)02-0087-05
