甘蓝型油菜BnTIR1基因的克隆和表达特征分析
2016-02-06谢伶俐袁程飞许本波长江大学生命科学学院湖北荆州434025
陈 帆,谢伶俐,袁程飞,许本波(长江大学 生命科学学院,湖北 荆州 434025)
甘蓝型油菜BnTIR1基因的克隆和表达特征分析
陈 帆,谢伶俐,袁程飞,许本波*
(长江大学 生命科学学院,湖北 荆州 434025)
植物的转运抑制应答因子1(transport inhibitor response 1,TIR1)作为生长素的受体,在生长素信号的感知与转导过程中发挥重要作用。采用RACE技术从中双9号中克隆了甘蓝型油菜BnTIR1全长cDNA序列和基因组序列。BnTIR1 的DNA序列为2 502 bp,包含2个内含子;cDNA序列为2 355 bp,ORF为1 824 bp,其编码蛋白含607个氨基酸。预测发现,BnTIR1蛋白存在AMN1保守结构域。qRT-PCR结果表明,BnTIR1 在甘蓝型油菜根、茎、叶、芽、花、角果中均有表达,但表达水平不同,在叶中表达水平最高,花中最低;干旱和ABA均可诱导BnTIR1表达,暗示其可能参与植物逆境胁迫响应过程。
甘蓝型油菜; 克隆; 转运抑制应答因子1; ABA
植物激素影响植物细胞的分化、形态建成等多个方面[1-2]。植物对生长素信号的感知与转导是通过转运抑制应答因子(transport inhibitor response 1/auxin signaling F-box,TIR1/AFB F-box)[3]、生长素/吲哚乙酸转录抑制因子(Aux/IAA transcriptional repressors)[4]和ARF转录因子(ARF transcription factors)[5]等激素受体实现的。TIR1/AFB F-box充当激素受体,感知激素信号,促进Aux/IAA的泛素化降解[6]。人们最早从拟南芥中发现TIR1[7],研究结果表明,TIR1作为生长素的受体参与生长素信号的转导[6]。AtTIR1蛋白含有1个F-box结构域和多个富亮氨酸重复基序LRR,TIR1通过F-box结构域形成泛素化降解途径中的E3连接酶复合体SCFTIR1(skp1-cullin-F-box protein),促进Aux/IAA的泛素化降解,释放ARF(auxin responsive factor)蛋白,进而调控相关基因的表达[8-9]。为研究TIR1在甘蓝型油菜(BrassicanapusL.)生长发育与抗逆过程中的作用,从甘蓝型油菜中双9号中克隆了BnTIR1基因,并分析了其在不同组织部位及逆境下的表达特征,以期为利用TIR1调控植物的抗逆性奠定基础。
1 材料和方法
1.1 试验材料
甘蓝型油菜品种为中双9号,来自中国农业科学院油料作物研究所。
1.2BnTIR1基因的全长cDNA扩增及序列分析
利用CTAB法提取甘蓝型油菜中双9号叶片DNA[10]和RNA[11],利用RNase-free DNase I (TaKaRa)除去RNA中混有的微量DNA,按照SuperScript III First-Strand Synthesis SuperMix(Invitrogen)说明书完成cDNA的合成。对拟南芥(Arabidopsisthaliana)(AK221208)、醉蝶花(Tarenayahassleriana)(XM_010531809)等物种的TIR1基因的核苷酸序列进行多重比对,设计甘蓝型油菜BnTIR1基因的3′和5′ RACE一扩和巢式PCR扩增引物(表1)。以叶cDNA为模板,按照GeneRacer kit (Invitrogen, USA)说明书分别进行BnTIR1的3′及5′ RACE扩增。其中,引物FBnTIR1-31和FBnTIR1-32与试剂盒3′ RACE引物配对用于3′cDNA 末端扩增,引物RBnTIR1-51和RBnTIR1-52与试剂盒5′ RACE引物配对用于5′cDNA末端扩增,按照GeneRacer kit (Invitrogen,USA)说明书分别进行甘蓝型油菜BnTIR1的3′及5′RACE扩增。扩增体系为50 μL:10×PCR Buffer 5 μL、25 mmol/L MgCl23 μL、10 mmol/L dNTP 1 μL、试剂盒引物1 μL、 RACE引物1 μL、cDNA 1 μL、Taq酶 (5 U/μL)0.5 μL、ddH2O 37.5 μL。PCR反应程序为:94 ℃ 2 min;94 ℃ 1 min,52 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。

表1 PCR引物名称及序列
根据5′和3′末端测序结果,设计1对引物FBnTIR1/RBnTIR1(表1)用于扩增BnTIR1全长cDNA及对应的基因组序列。PCR产物经过电泳、凝胶回收后连接到pMD18-T载体,交由北京三博生物有限公司测序。利用软件Vector NTI Advance 9.0对测定序列进行分析,查找开放阅读框(ORF),翻译成蛋白,并进行蛋白质参数计算。利用BLAST (http://www.ncbi.nlm.nih.gov/)分析核酸、蛋白质的同源性。在EXPASY网站 (http://www.expasy.org and http://www.softberry.com/berry.phtml)进行蛋白质结构和性质分析。
1.3BnTIR1基因的表达特征分析
将中双9号盆栽于长江大学人工气候室,于成熟期取根、茎、芽、叶、花和角果材料于-80 ℃保存。
以20 d苗龄的中双9号幼苗为材料,分别进行ABA处理和干旱处理。在ABA处理中,利用10 μmol/L ABA喷施幼苗,清水处理为对照,正常浇水,连续处理5 d后分别取处理植株和对照植株叶片于-80 ℃保存;在干旱处理中,对幼苗停止浇水,处理5 d后,取干旱处理植株叶片。
利用CTAB法提取组织RNA[11]。利用RNase-free DNase Ⅰ (TaKaRa)除去RNA中混有的微量DNA,按照SuperScript Ⅲ First-Strand Synthesis SuperMix(Invitrogen)说明书完成cDNA的合成。根据拟南芥actin基因序列设计甘蓝型油菜actin基因扩增引物FACT/RACT(表1)。按照SuperScript Ⅲ First-Strand Synthesis SuperMix(Invitrogen)说明书完成cDNA的合成。以actin基因为内参基因,采用BnTIR1基因的qRT-PCR引物QFTIR1/QRTIR1(表1)扩增检测BnTIR1基因表达水平。其qRT-PCR体系按照TaKaRa公司SYBR Premix ExTaq试剂盒的操作说明配制,扩增体系为50 μL:10×PCR Buffer 5 μL、25 mmol/L MgCl23 μL、10 mmol/L dNTP 1 μL、试剂盒引物1 μL、 RACE引物1 μL、cDNA 1 μL、Taq酶 (5 U/μL)0.5 μL、ddH2O 37.5 μL。反应程序为:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 30 s,72 ℃ 45 s,40个循环。
2 结果与分析
2.1BnTIR1基因的克隆及序列分析
分别以cDNA和基因组DNA为模板,利用引物FBnTIR1/RBnTIR1成功地扩增出1条约2.3 kb的亮带和1条约2.5 kb的亮带,将得到的序列命名为BnTIR1,经回收、连接、测序发现,其基因组DNA全长为2 502 bp,其遵循标准的内含子剪接方式:GT…AG,包含2个内含子;其cDNA全长为2 355 bp (不包括polyA),5′UTR长度为135 bp,3′UTR长度为396 bp,ORF长度为1 824 bp(图1)。

ATG和TAG用下划线和粗体表示,内含子用灰背景表示图1 BnTIR1的核酸序列和氨基酸序列
经NCBI Blastn分析表明,BnTIR1和来自十字花科的白菜(Brassicarapa)、甘蓝(Brassicaoleracea)的TIR1基因的同源性最高,分别为98.6%、90.6%,和其他一些植物的TIR1基因也有较高的同源性。
翻译BnTIR1的开放读码框,得到1个由607个氨基酸组成的多肽链,其分子质量为68.96 ku,等电点为5.55。Blastp(protein-protein BLAST)结果表明,BnTIR1蛋白序列与许多已知的植物TIR1蛋白具有很高的相似性,与白菜TIR1蛋白的相似性最高,其与白菜、甘蓝、拟南芥和荠蓝(Camelinasativa)TIR1蛋白的一致性/相似性分别为99.2%/99.7%、95.9%/97.4%、76.8%/84.0%和83.9%/87.5%,说明在十字花科TIR1蛋白进化过程中,该蛋白序列非常保守。
多重比对和聚类分析结果(图2)表明,BnTIR1蛋白和来自十字花科植物甘蓝和白菜的TIR1蛋白聚成1个亚类。其中,BnTIR1与白菜TIR1的遗传距离最近,它们与醉蝶花、拟南芥、荠蓝以及黄瓜(Cucumissativus)的TIR1遗传距离也比较近,形成一个大类。
NCBI保守结构域搜索表明,BnTIR1蛋白的V149

各TIR蛋白的GenBank序列号分别为AtTIR1:CAB45074.1,ThTIR1:XP_010530111.1,BrTIR1:XP_009134037.1,BoTIR1:XP_013629743.1,CsTIR1:XP_010445996.1,CsaTIR1:XP_011652571.1,GrTIR1:XP_012450171.1,JcTIR1:XP_012067953.1,PeTIR1:XP_011010387.1,MdTIR1:XP_008338910.1,PmuTIR1:XP_008219380.1,CaTIR1:XP_004490408.1,GmTIR1:XP_003544234.1,VvTIR1:XP_002283927.2,EgTIR1:XP_010939729.1,PdTIR1:XP_008812967.1,ZmTIR1:KMZ63694.1,NnTIR1:XP_010266465.1,NsTIR1:XP_009763830.1,到R252和C372到P526区域分别对应存在AMN1(antagonist of mitotic exit network protein 1)保守结构域。
StTIR1:XP_006338135.1
图2 BnTIR1蛋白系统发育树
SignalP 3.0预测表明,BnTIR1蛋白没有信号肽;TargetP预测表明,BnTIR1蛋白位于叶绿体、线粒体的可能性很小;PSORT预测表明,BnTIR1蛋白可能定位于细胞核中,结合BnTIR1蛋白功能分析,BnTIR1蛋白应该位于细胞核中;而TMpred预测表明,BnTIR1蛋白具有5个强的跨膜结构。
利用SOPMA软件预测BnTIR1二级结构(图3)发现,BnTIR1蛋白的二级结构含有48.43%的α螺旋(α helix)、14.66%的延伸链(extended strand)、7.25%的β转角(β turn)和29.65%的随机卷曲(random coil)。BnTIR1蛋白的中部有3个大型的α螺旋,N-末端具有大量的随机卷曲。在其尾部(C-末端)均有大量随机卷曲和延伸链,且不存在α螺旋;同时在其中部α螺旋与尾部α螺旋之间,存在转角与延伸链交错的结构。

h:螺旋; e:延伸链; t:beta 转角; c:随机转曲。线条从长变短分别表示h、e、t和c图3 BnTIR1-1蛋白的二级结构预测
2.2BnTIR1基因的表达特征分析
2.2.1BnTIR1基因在不同组织中的表达情况 由图4可知,BnTIR1基因在甘蓝型油菜中双9号的根、茎、叶、芽、花、角果中均有表达,且表达量差异极显著(除花和角果外),BnTIR1在叶中表达水平最高,其次为根部,而在花和角果中转录水平最低。由于BnTIR1主要参与激素的应答和运输,因此BnTIR1基因的组织表达模式可能与各组织的生物学功能相关。
2.2.2BnTIR1基因在不同逆境条件下的表达情况 对甘蓝型油菜中双9号幼苗进行干旱和ABA处理发现,干旱和ABA处理均可诱导BnTIR1基因表达,且其表达量极显著高于未处理对照(图5),表明BnTIR1可能参与植物抗逆过程。
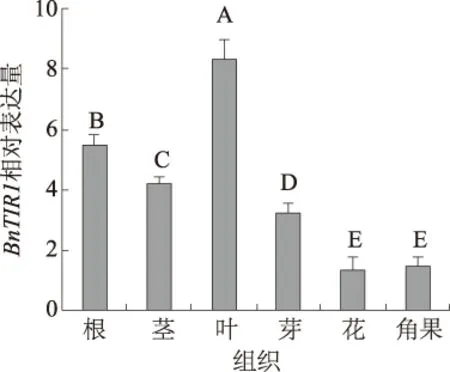
不同大写字母表示差异极显著(P<0.01),下同图4 BnTIR1基因在甘蓝型油菜不同组织中的表达水平
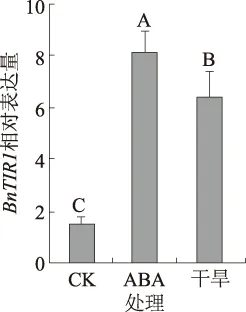
图5 ABA和干旱对BnTIR1基因.的诱导表达作用
3 结论与讨论
生长素在根系的形成等植物生长发育过程中起着重要作用。本研究从甘蓝型油菜中双9号中克隆了生长素受体基因TIR1的全长cDNA序列,该基因编码的蛋白质序列与其他植物的TIR1蛋白序列有较高的同源性。生物信息学分析表明,该基因是1个典型的TIR1基因。本研究发现,TIR1基因在甘蓝型油菜各组织器官中的表达水平不同,该结果与唐壮等[12]的研究结果一致。
研究发现,在植物的生长发育过程中,几种植物激素相互作用,共同调节植物的发育过程[13-16]。IAA的作用受其他植物激素,如ABA[17]、GA3[18]等的调控。曹红利等[18]的研究结果表明,ABA、GA3、茉莉酸甲酯和油菜素内酯可以诱导CsTIR1表达,并且在短时间(1 h)内就能够显著上调该基因的表达量。本研究发现,BnTIR1 能够响应ABA和干旱胁迫,也说明植物激素之间存在广泛的互作。而且BnTIR1受干旱诱导,说明该基因在植物抗逆过程中发挥一定作用,但有待于深入研究。
[1] Benjamins R,Scheres B.Auxin:The looping star in plant development[J].Annual Review of Plant Biology,2008,59:443-465.
[2] Woodward A W,Bartel B.Auxin:Regulation,action,and interaction[J].Ann Bot,2005,95(5):707-735.
[3] Mockaitis K,Estelle M.Auxin receptors and plant develo-pment:A new signaling paradigm[J].Annu Rev Cell Dev Biol,2008,24:55-80.
[4] Overvoorde P J, Okushima Y, Alonso J M,etal. Functional genomic analysis of the AUXIN/INDOLE-3-ACETIC ACID gene family members inArabidopsisthaliana[J].Plant Cell,2005,17(12):3282-3300.
[5] Guilfoyle T J,Hagen G.Auxin response factors[J].Current Opinion in Plant Biology,2007,10(5):453-460.
[6] Kepinski S,Leyser O.TheArabidopsisF-box protein TIR1 is an auxin receptor[J].Nature,2005,435(741):446-451.
[7] Ruegger M,Dewey E,Hobbie L,etal.Reduced naphthylphthalamic acid binding in thetir3 mutant ofArabidopsisis associated with a reduction in polar auxin transport and diverse morphological defects[J].The Plant Cell,1997,9(5):745-757.
[8] Gray W M,del Pozo J C,Walker L,etal.Identification of an SCF ubiquitin-ligase complex required for auxin response inArabidopsisthaliana[J].Genes Dev,1999,13(13):1678-1691.
[9] Maraschin F S, Memelink J, Offringa R. Auxin-induced, SCF(TIR1)-mediated poly-ubiquitination marks AUX/IAA proteins for degradation[J]. Plant Journal, 2009, 59(1):100-109.
[10] Saghai-Maroof M A,Soliman K M,Jorgensen R A,etal.Ribosomal DNA spacer-length polymorphisms in barley:Mendelian inheritance, chromosomal location, and population dynamics[J].Proceedings of the National Academy of Sciences of the United States of America,1984,81(24):8014-8018.
[11] Jaakola L,Pirttila A M,Halonen M,etal.Isolation of high quality RNA from bilberry (VacciniummyrtillusL.) fruit[J].Molecular Biotechnology,2001,19(2):201-203.
[12] 唐壮,杜伟,李小玉, 等.桑树TIR1基因的克隆及在组织器官和扦插生根过程的表达分析[J].蚕业科学,2014,40(5):790-796
[13] Muniz G M N,Stritzler M,Capiati D A.Heterologous expression ofArabidopsisABF4 gene in potato enhances tuberization through ABA-GA crosstalk regulation[J]. Planta,2014,239(3):615-631.
[14] Rock C D,Sun X.Crosstalk between ABA and auxin signaling pathways in roots ofArabidopsisthalianaL. Heynh[J].Planta,2005,222(1):98-106.
[15] Chan Z.Expression profiling of ABA pathway transcripts indicates crosstalk between abiotic and biotic stress responses inArabidopsis[J].Genomics,2012,100(2):110-115.
[16] Arc E,Sechet J,Corbineau F,etal.ABA crosstalk with ethylene and nitric oxide in seed dormancy and germination[J].Front Plant Sci,2013,4:1-19
[17] He J,Duan Y,Hua D,etal.DEXH box RNA helicase-mediated mitochondrial reactive oxygen species production inArabidopsismediates crosstalk between abscisic acid and auxin signaling[J].Plant Cell,2012,24(5):1815-1833.
[18] 曹红利,岳川,周艳华,等.茶树生长素受体基因CsTIR1的克隆与表达分析[J].茶叶科学,2015,35(1):45-54.
Cloning and Expression Characteristics ofBnTIR1 fromBrassicanapusL.
CHEN Fan,XIE Lingli,YUAN Chengfei,XU Benbo*
(College of Life Science,Yangtze University,Jingzhou 434025,China)
Transport inhibitor response 1 (TIR1),as an auxin receptor,plays an key role in response to auxin signals.AnTIR1 gene,denoted asBnTIR1,was cloned by the rapid amplification of cDNA ends (RACE) from Zhongshuang No.9.The genomic sequence length ofBnTIR1 was 2 502 bp,which contained two introns.The cDNA sequence length ofBnTIR1 was of 2 355 bp,which had a 1 824 bp ORF encoding a polypeptide of 607 amino acids.The prediction results indicated that the BnTIR1 protein contained conserved AMN1 domain.qRT-PCR results showed theBnTIR1 gene were expressed in roots,stems,shoots,eaves,flowers and siliques,but the transcription level were different among the six tissues,which was the highest in leaves,lowest in flowers;BnTIR1 were induced by drought and ABA,which indicated thatBnTIR1 could involve in responding to stress.
BrassicanapusL.; cloning; transport inhibitor response 1; ABA
2015-11-05
教育部留学回国人员科研启动基金项目(教外司[2014]1685号)
陈 帆(1991-),男,湖北荆州人,在读硕士研究生,研究方向:植物生物技术。E-mail:565275863@qq.com
*通讯作者:许本波(1977-),男,湖北安陆人,副教授,博士,主要从事植物生物技术研究。 E-mail:benboxu@yangtzeu.edu.cn
S565.4;Q78
A
1004-3268(2016)04-0049-05
