CIK细胞疗法联合肝动脉化学治疗栓塞术治疗原发性肝癌的临床探究
2016-02-06李娜李敏冯珉
李 娜 李 敏 冯 珉
·临床研究·
CIK细胞疗法联合肝动脉化学治疗栓塞术治疗原发性肝癌的临床探究
李 娜 李 敏 冯 珉
原发性肝癌(PLC)是临床常见的消化系统恶性肿瘤,早期发病较为隐匿,确诊时多为晚期。近年来其发病率呈上升趋势,中国PLC患者在全球中所占比例超过50%,且病死率较高,严重影响患者的生命健康[1]。目前肝动脉化学治疗栓塞(TACE)术广泛应用于PLC治疗中,可在一定程度上延长患者的生存时间,但术后复发率较高[2]。CIK细胞疗法通过细胞因子对肿瘤造成杀伤,也是临床治疗PLC的常用方法,但目前对于这两种方法联合使用的临床资料较少。本研究采用CIK细胞疗法联合TACE术治疗PLC,发现两种方法联合应用可有效提高患者的免疫力,临床治疗效果较好。
1 资料与方法
1.1 研究资料
选取2012年3月至2015年3月淄博市中心医院收治的PLC患者共90例,按照随机数字表法分为对照组和研究组(每组各45例)。研究组男32例,女13例,年龄39~75岁,平均年龄(52.36±3.24)岁;临床分期:Ⅰ期17例,Ⅱ期18例,Ⅲ期10例;肿瘤大体类型:巨块型15例,弥漫型19例,结节型11例。对照组男33例,女12例,年龄38~74岁,平均(52.41±3.31)岁;临床分期:Ⅰ期16例,Ⅱ期17例,Ⅲ期12例;肿瘤大体类型:巨块型14例,弥漫型18例,结节型13例。两组患者性别、年龄、临床分期、肿瘤大体类型等一般资料的差异无统计学意义(P>0.05)。
1.2 纳入标准与排除标准
纳入标准:(1)本研究所有患者均知情同意;(2)经病理组织学检查确诊为PLC;(3)所有患者均未接受放射治疗、免疫治疗等其他治疗;(4)预计生存时间超过半年。排除标准:(1)具有严重凝血机制障碍;(2)转移性肝脏肿瘤、大量腹水以及消化道出血等严重并发症;(3)病毒性感染或酒精性肝病;(4)合并肺炎或传染性疾病,严重心、肝、肾等器质性疾病;(5)全身衰竭,不能进行股动脉插管的患者;(6)化学治疗禁忌证患者。
1.3 治疗方法
对照组:采用TACE术治疗。如在手术过程中出现肝动脉-肝静脉瘘,可在注入碘油之前使用明胶海绵进行封堵。化学治疗药物及剂量使用情况如下:吡柔比星20~40 mg、丝裂霉素4~8 mg、羟基喜树碱20~24 mg、顺铂60~80 mg。栓塞后对肝总动脉进行造影处理,栓塞满意后可将RH管拔出。对穿刺点进行15 min压迫止血处理并使用弹力绷带包扎,行穿刺部位肢体应制动24 h。第1次与第2次治疗间隔时间为1个月,根据患者具体病情决定治疗方案及剂量,最多接受5次治疗。3个月后对治疗效果进行评估。
研究组:在对照组基础上联合CIK细胞疗法治疗。(1)采集单个核细胞:使用采血机对患者外周血单个核细胞(PBMC)进行采集,数量以1×109~4×109为宜,总容积为40~70 mL。在符合要求的实验室中,经Ficoll淋巴分离液梯度离心,用毛细管吸取环状乳白色单个核细胞,用PBS缓冲液悬浮后再次进行离心,洗涤3次得到纯净PBMC,数量为1×107~3×107。吸取新鲜血浆以供培养树突状细胞(DC)-CIK细胞。(2)制备CIK细胞:使用无血清培养基将PBMC细胞密度调整为4×106~6×106,将其置于CO2(浓度为5%,温度为37℃)培养箱中,培养2 h后将非贴壁细胞收集,并将其密度调整为2×106~3×106/mL,加入干扰素γ 1000 U/mL,24 h后加入重组人白细胞介素-2(rhIL-2)1000 U/mL、CD3McAb 50 ng/mL和白细胞介素-1(IL-1)100 U/mL继续培养,密切观察每日的细胞情况。(3)培养CIK细胞:将制备好的CIK细胞置于培养液中进行培养,直至培养成熟。(4)回输:收集培养成熟的CIK细胞,进行细菌、内毒素以及真菌等检测,合格后加入生理盐水进行离心和洗涤(重复3次),将所得细胞悬浮于生理盐水中,适当加入人血白蛋白,混合均匀后于1 h内静脉滴注患者体内。回输过程中对患者生命体征进行严密监视,可根据患者病情给予抗过敏、药物降温等处理。隔天回输1次,如出现复发等情况,可根据患者病情适当延长治疗时间,4次为1个疗程,共治疗2个疗程。
1.4 观察指标
(1)肝功能指标:分别于治疗前、治疗后观察肝功能变化情况,包括天冬氨酸氨基转移酶(AST)、总胆红素(TBil)和丙氨酸氨基转移酶(ALT)水平。(2)临床疗效:治疗结束后参照实体瘤疗效判定标准进行判断:靶病灶消失,没有出现新病灶,常规检查显示肿瘤标志物正常为完全缓解(CR);靶病灶最大直径之和减少程度超过30%为部分缓解(PR);靶病灶最大径之和增加幅度未超过20%,或减小程度未超过30%为疾病稳定(SD);靶病灶最大直径之和增加幅度超过20%或者有新病灶出现为疾病进展(PD)。以上各种症状至少需维持4周以上,总有效率为CR、PR、SD之和。(3)观察外周血T细胞亚群:分别于治疗前、治疗1个月后、治疗结束时在同一时刻采用流式细胞仪进行检测,包括CD3+、CD4+、CD8+、CD4+/CD8+。(4)不良反应发生率:治疗期间观察两组患者是否出现骨髓抑制、肝功能受损、发热、过敏、皮疹、变态反应等不良反应。
1.5 统计学处理
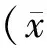
2 结果
2.1 肝功能比较
治疗前两组患者的AST、TBil、ALT水平比较差异无统计学意义(P>0.05),两组治疗后的指标显著高于治疗前(P<0.05),治疗后两组数据比较的差异无统计学意义(P>0.05),详见表1。

表1 两组患者肝功能的比较
注:与治疗前相比较,aP<0.05
2.2 临床治疗效果比较
研究组的总有效率显著高于对照组,且差异具有统计学意义(P<0.05),详见表2。
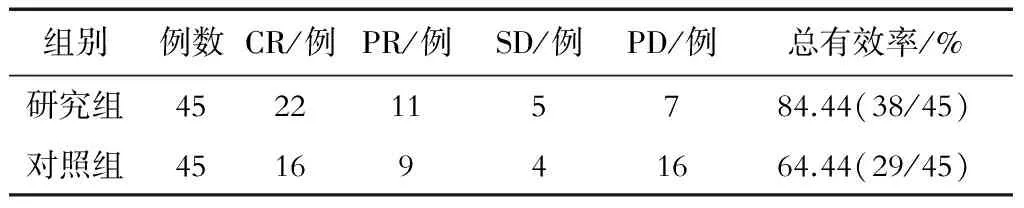
表2 两组患者临床治疗效果的比较
2.3 外周血T细胞亚群变化的比较
两组患者CD3+、CD4+、CD8+、CD4+/CD8+在治疗前的差异无统计学意义(P>0.05);两组患者治疗1个月后以及治疗结束时的上述指标与治疗前相比较,差异具有统计学意义(P<0.05),研究组的CD3+、CD4+、CD4+/CD8+均较治疗前显著升高(P<0.05),而CD8+则显著降低(P<0.05);对照组CD3+、CD4+、CD4+/CD8+均较治疗前显著降低(P<0.05),而CD8+则显著升高(P<0.05);治疗结束时,研究组CD3+、CD4+、CD4+/CD8+显著高于对照组(P<0.05),CD8+显著低于对照组(P<0.05),详见表3。
2.4 不良反应发生率
研究组的不良反应发生率显著低于对照组,且差异具有统计学意义(P<0.05),详见表4。

表3 两组患者外周血T细胞亚群变化的比较
注:与治疗前相比较,aP<0.05;与治疗1个月相比较,bP<0.05;与对照组相比较,cP<0.05
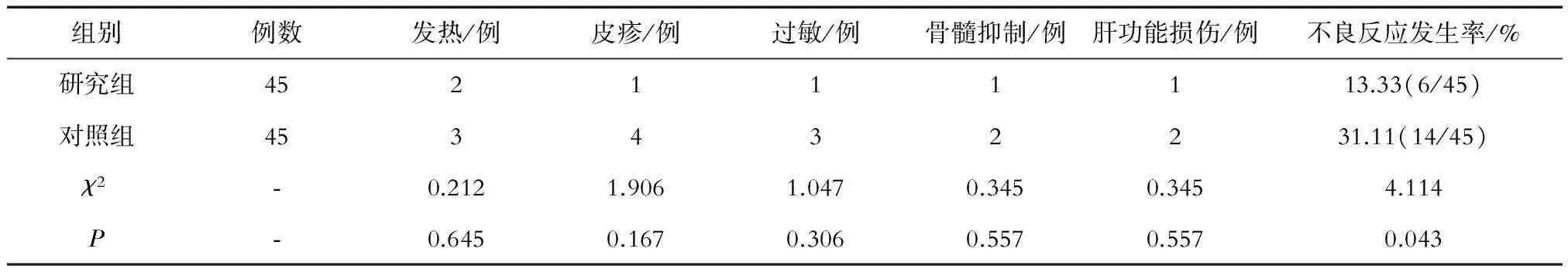
表4 两组患者不良反应发生率比较
3 讨论
目前TACE术在临床上被广泛应用于治疗PLC,该方法主要利用新生血管,在充分了解动脉血供特点的情况下,在肿瘤供应血管内注入化学治疗药物以及栓塞剂等,通过阻断新生血管的供血达到促使肿瘤细胞坏死的目的[3]。采用TACE术治疗后可有效改善患者的生活质量,延长生存期。陈挺松等[4]研究显示,采用TACE术对60例PLC患者进行治疗,发现总有效率为62.54%。本研究结果显示,对照组治疗的总有效率为64.44%,与上述研究结果基本一致。但此方法仍存在一定的不足,如化学治疗药物等不能完全促使肿瘤组织坏死,且肿瘤分支血供建立的速度极快,治疗后肿瘤细胞的增殖和侵袭能力会更强,将对患者的免疫功能造成严重损害[5]。化学治疗后患者易产生骨髓抑制、肝功能损伤等不良反应,将进一步损伤患者的免疫功能[6]。张艳梅等[7]研究结果指出,采用TACE术治疗后,患者CD3+、CD4+、CD4+/CD8+均较治疗前显著降低,而CD8+显著升高。本研究结果显示,对照组治疗1个月后以及治疗结束时CD3+、CD4+、CD4+/CD8+均较治疗前显著降低,CD8+显著升高,AST、TBil、ALT的水平显著升高,不良反应发生率为31.11%,提示TACE术可改善免疫功能,但安全性仍存在局限。
CIK细胞疗法可在不损害免疫系统的前提下,对肿瘤细胞具有直接杀伤作用,可有效清除残留病灶,对PLC的复发有一定预防作用,可在很大程度上改善患者的生活质量[8]。CIK细胞可通过黏附因子途径与肿瘤细胞相结合,分泌大量可穿透靶细胞膜的颗粒(如释放颗粒酶等),从而达到裂解肿瘤细胞的目的[9]。CIK细胞在体外进行培养,可分泌出直接抑制肿瘤的多种细胞因子[如肿瘤坏死因子-α(TNF-α)等],这些细胞因子对机体免疫系统的反应性具有调节作用,可间接对肿瘤细胞进行杀伤[10]。此外,CIK细胞对肿瘤细胞凋亡基因具有较强的活化作用,可促使肿瘤细胞凋亡[11]。通过回输将CIK细胞注入机体内,通过肿瘤抗原刺激,其可向毒性T细胞进行转变,且具有杀伤活性,增殖并活化T细胞,同时充分发挥抗肿瘤作用[12]。佟立权等[13]的研究采用TACE术与CIK细胞疗法联合治疗90例PLC患者,发现经治疗后患者CD3+、CD4+、CD4+/CD8+均较治疗前显著升高,CD8+显著降低。这与本研究的结果相一致。本研究还指出,研究组的总有效率显著高于对照组,且不良反应发生率显著低于对照组,提示两种方法的联合使用相较于单一使用TACE术的效果更好,且不会加重肝功能损伤,可有效提高临床治疗的效果。
综上所述,CIK细胞疗法联合TACE术治疗PLC相较于单纯使用TACE术的效果更好,可有效提高患者的机体免疫力,值得临床使用和推广。
1 郭伟伟, 刘莉, 吴德华. DC-CIK细胞免疫治疗联合TACE术治疗原发性肝癌[J]. 南方医科大学学报, 2014, 34: 674-678.
2 张扬, 谭岩, 刘冰. DC-CIK细胞治疗联合微创介入治疗原发性肝癌的临床研究[J]. 中国实用医药, 2012, 7: 103-104.
3 Sheefa H, Lata J, Basharat M, et al. Utility of FNAC in conjunction with cell block for diagnosing space-occupying lesion (SOL) of liver with emphasis on differentiating hepatocellular carcinoma from metastatic SOL: analysis of 61 cases[J]. Oman Med J, 2016, 31: 135-141.
4 陈挺松, 吴胜兵, 吴孝雄, 等. 肝动脉化疗栓塞联合门静脉灌注华蟾素注射液治疗原发性肝癌16例临床观察[J]. 中华中医药杂志, 2010, 25: 792-794.
5 宋娟, 钱程. CIK细胞免疫治疗在原发性肝癌中的应用及对免疫活性细胞的影响[J]. 第三军医大学学报, 2015, 37: 2386-2390.
6 左新华, 高萍. DC-CIK免疫疗法联合TACE、RFA治疗原发性肝癌的疗效评估[J]. 海南医学院学报, 2016, 22: 385-388, 391.
7 张艳梅, 崔红利, 颜綦先, 等. CIK细胞疗法联合TACE治疗原发性肝癌患者临床疗效观察[J]. 实用肝脏病杂志, 2015, 18: 647-650.
8 AhnS, Cho A, Kim EK, et al. Favorable long-term oncologic outcomes of hepatocellular carcinoma following laparoscopic liver resection[J]. J Laparoendosc Adv Surg Tech A, 2016, 26: 447-452.
9 邢宏, 韩方正, 汪莉萍, 等. TACE联合自体CIK治疗原发性肝癌患者的细胞免疫功能变化[J]. 国际消化病杂志, 2011, 31: 121-124.
10 王郑. DC-CIK细胞联合手术治疗原发性肝癌的临床研究[J]. 中国医药导报, 2012, 9: 62-64.
11 徐立涛, 周振华, 林钧华, 等. 肝动脉化疗栓塞联合血管内皮抑制素介入治疗原发性肝癌的疗效和安全性[J]. 肿瘤, 2010, 30: 625-627.
12 马洪波, 黄涛, 韩风, 等. DC-CIK细胞联合手术治疗原发性肝癌的临床研究[J]. 重庆医科大学学报, 2012, 37: 980-983.
13 佟立权, 赵海峰, 尤立光, 等. TACE术联合自体CIK细胞治疗原发性肝癌的临床研究[J]. 中国普通外科杂志, 2013, 22: 876-879.
(本文编辑:周骏)
255000 山东省淄博市中心医院内一科
10.3969/j.issn.1673-534X.2016.06.012
2016-07-10)
