姜黄素对5/6肾切除鼠鞘氨醇激酶1和转化生长因子-β1表达的影响
2016-02-06袁红霞邱振宇
袁红霞 邱振宇 周 盾
(锦州医科大学附属第一医院,辽宁 锦州 121001)
姜黄素对5/6肾切除鼠鞘氨醇激酶1和转化生长因子-β1表达的影响
袁红霞 邱振宇 周 盾
(锦州医科大学附属第一医院,辽宁 锦州 121001)
目的探讨姜黄素对5/6肾切除大鼠肾脏损害的保护作用及相关机制。方法 将36只SD大鼠随机分为对照组,5/6肾切除组和姜黄素治疗组,每组12只。10 w后检测各组大鼠24 h尿蛋白定量、血肌酐(SCr)及尿素氮(BUN)的水平;光镜观察各组大鼠肾组织病理改变,免疫组化法检测肾组织鞘氨醇激酶(SPHK)1和转化生长因子(TGF)-β1的表达。ELISA检测各组大鼠血清中TGF-β1的分泌水平。结果 姜黄素治疗组大鼠24 h尿蛋白定量、SCr和BUN水平明显低于5/6肾切除组(P<0.05)。免疫组化检测可见5/6肾切除组大鼠SPHK1和TGF-β1表达明显增加(P<0.05),姜黄素治疗组上述指标的表达均受到明显抑制(P<0.05)。姜黄素治疗组大鼠血清TGF-β1的分泌水平明显低于5/6肾切除组,但仍高于对照组(P<0.05)。结论 姜黄素能减轻5/6肾切除大鼠肾脏病理改变,其机制可能是通过抑制TGF-β1的表达和分泌,进而影响SPHK1的表达而发挥作用。
姜黄素;5/6肾切除;鞘氨醇激酶1;转化生长因子-β1
肾小球硬化、肾小管间质纤维化是各种肾脏疾病发展至终末期的不可逆病变,其间涉及炎性细胞浸润、细胞因子活化、细胞增殖及细胞外基质聚集等错综复杂的病理生理过程〔1〕。姜黄素是从姜科植物根茎姜黄中提取的一种植物多酚,有抗氧化、抗炎、促进免疫调节等药理作用。近年研究显示,姜黄素具有抗肾纤维化的作用〔2~4〕。本实验通过建立5/6肾切除大鼠动物模型,观察大鼠肾组织鞘氨醇激酶(SPHK)1和转化生长因子(TGF)-β1的表达及姜黄素对其表达的影响。
1 材料和方法
1.1 动物及试剂 健康成年雄性SD大鼠36只(辽宁医学院实验动物中心提供),体质量250~300 g。姜黄素(Sigma公司),兔抗大鼠SPHK1多克隆抗体(Abgent公司),兔抗大鼠TGF-β1多克隆抗体(Santa Cruz公司),SP免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)。大鼠血清TGF-β1 ELISA试剂盒(沈阳博瑞德科技有限公司)。
1.2 方法
1.2.1 动物分组及模型建立 大鼠适应性饲养1 w后,随机分为3组:对照组,5/6肾切除组和姜黄素治疗组,每组12只。5/6肾切除组大鼠在麻醉和无菌条件下切除左肾上、下极约2/3肾组织,术后1 w,麻醉下切除右肾,两次手术共切除肾脏约5/6。姜黄素治疗组处理方法同5/6肾切除组,并于第2次肾切除后1 w开始行姜黄素150 mg·kg-1·d-1灌胃10 w。对照组和5/6肾切除组给予等体积饮用水灌胃。
1.2.2 标本采集与处理 10 w后,代谢笼收集24 h尿液并记录尿量;静脉采血5 ml检测血肌酐(SCr)、尿素氮(BUN)的水平及TGF-β1的分泌水平,后处死各组大鼠,留取肾脏组织标本,用10%甲醛固定,常规石蜡包埋,切片。①24 h尿蛋白定量:双缩脲法检测各组大鼠24 h尿蛋白定量。②肾功能指标:全自动生化分析仪检测各组大鼠血清血SCr和BUN水平。③组织学检查:取各组大鼠肾组织标本石蜡切片行HE和PAS染色,观察肾组织病理形态学改变。④免疫组织化学检测SPHK1和TGF-β1:采用SP法。石蜡切片4 μm。阴性对照用PBS代替一抗,检测SPHK1和TGF-β1的表达。结果进行半定量分析,每张标本随机选取5个视野,计算视野内染色区域的平均吸光度,以均值计算每个标本的吸光度,最后以每组的均值进行比较。⑤酶联免疫吸附法(ELISA)检测血清中TGF-β1的水平:按照试剂盒提供的操作步骤进行实验。
1.3 统计学方法 采用SPSS18.0软件进行单因素方差分析及t检验。
2 结 果
2.1 干预后各组大鼠24 h尿蛋白定量、SCr和BUN水平 干预10 w后,与对照组相比,5/6肾切除组24 h尿蛋白定量、SCr和BUN水平均明显增加(P<0.05)。与对照组相比,姜黄素治疗组24 h尿蛋白定量、SCr和BUN水平仍增高,但较5/6肾切除组显著降低(P<0.05)。见表1。
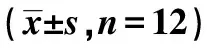

组别24h尿蛋白定量(mg/24h)BUN(mmol/L)SCr(μmol/L)对照组12 63±6 425 44±1 2254 00±5 295/6肾切除组177 30±13 011)10,20±1 171)98 50±13 991)姜黄素治疗组85 33±9 071)2)7 74±1 151)2)69 75±8 661)2)
与对照组比较:1)P<0.05;与5/6肾切除组比较:2)P<0.05,下表同
2.2 各组大鼠肾组织病理改变 HE和PAS染色结果显示,对照组大鼠肾小球毛细血管襻开放较好,肾小管上皮细胞排列整齐,间质无明显改变。5/6肾切除组可见肾小球系膜细胞增生,肾小囊扩张,囊壁增厚,球囊粘连,毛细血管襻面积缩小;肾小管闭塞,肾小管上皮细胞肿胀、颗粒变性、坏死、脱落,肾小管扩张明显,可见蛋白管型,个别小管萎缩,可见间质纤维化和炎性细胞浸润。姜黄素治疗组病变较5/6肾切除组明显减轻。见图1。
2.3 各组大鼠肾组织中SPHK1和TGF-β1的表达 对照组大鼠肾小球和肾小管可见少量SPHK1和TGF-β1染色颗粒,5/6肾切除组SPHK1和TGF-β1表达明显增加,姜黄素治疗组SPHK1和TGF-β1蛋白表达与之相比明显减少,但高于对照组(P<0.05)。见表2,图2、图3。
2.4 各组大鼠血清TGF-β1水平 5/6肾切除组TGF-β1水平〔(249.5±45.33)pg/ml〕和姜黄素治疗组〔(115.7±38.52)pg/ml〕明显高于对照组〔(50.18±20.54)pg/ml,P<0.05〕;与 5/6肾切除组比较,姜黄素治疗组TGF-β1水平降低(P<0.05)。

图1 各组大鼠肾组织HE和PAS染色(×400)

表2 各组大鼠肾组织SPHK1和TGF-β1的表达
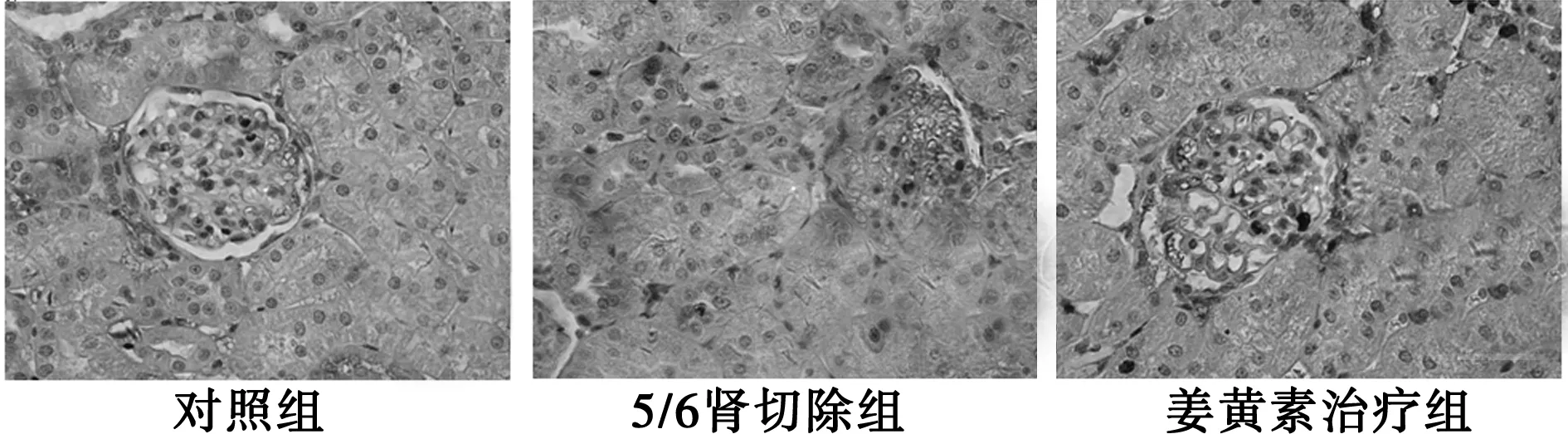
图2 各组大鼠肾组织SPHK1的表达(×200)

图3 各组大鼠肾组织TGF-β1的表达(×200)
3 讨 论
本实验采用SD大鼠5/6肾切除诱导肾小球硬化模型,10 w后观察到血肌酐、尿素氮和24 h尿蛋白定量升高,光镜观察肾小球系膜细胞增生,系膜基质增多,毛细血管襻面积缩小;肾小管闭塞,个别小管萎缩,可见间质纤维化。说明本实验所采用的模型已出现肾小球硬化的病理改变。
1磷酸鞘氨醇(S1P)作为SPHK1的下游代谢产物,能调节细胞增殖、分化、迁移、接触和黏附、存活以及血管的形成,调控多种细胞的生物学活性〔5,6〕。最近,越来越多的研究证实,SPHK1在糖尿病肾病、多囊肾等肾脏病变肾组织表达增加并促进肾脏硬化〔7~9〕。本研究发现,对照组大鼠肾组织中可见少量SPHK1表达,5/6肾切除组SPHK1表达明显增加,说明SPHK1参与了肾局灶硬化和肾小管扩张,但具体机制不清。
姜黄素是姜黄的主要活性成分,具有广泛的药理作用。国外学者研究发现,在5/6肾切除诱导的慢性肾衰竭模型大鼠中,姜黄素能显著降低SCr、BUN及尿蛋白的水平,减轻肾局灶硬化和肾小管扩张〔3,10〕,这与本实验的研究结果相一致。Ghosh等〔4〕在糖尿病肾病模型中研究发现,姜黄素能明显下调SPHK1的表达和活性,使TGF-β1的过度表达受到抑制。另有研究证实,TGF-β1能促进SPHK1的活性和表达,促使细胞外基质的沉积〔11〕。TGF-β1是导致动物肾脏纤维化的关键性细胞因子,它能促进系膜细胞肥大,细胞外基质增多、降解减少,最终导致肾小球硬化。本研究发现,在5/6肾切除组大鼠肾组织中TGF-β1表达增多,血清分泌水平升高,提示TGF-β1和SPHK1可能共同参与了肾组织的病变。给予姜黄素治疗后,大鼠肾组织中SPHK1和TGF-β1的表达减少,血清中TGF-β1的分泌水平显著下降,说明姜黄素通过TGF-β1/SPHK1通路起到了对5/6肾切除大鼠肾脏的保护作用。
综上,本研究表明姜黄素能改善5/6肾切除大鼠受损的肾脏结果和功能,降低蛋白尿,延缓慢性肾功能衰竭的发生和发展。其肾脏保护作用的机制可能是抑制TGF-β1的表达和分泌,进而影响SPHK1的表达而发挥作用。
1 El Nahas AM,Muchaneta-Kubara EC,Essaway M,etal.Renal fibrosis:insights into pathogenesis and treatment〔J〕.Int J Biochem Cell Biol,1997;29(1):55-62.
2 Gaedeke J,Noble NA,Border WA.Curcumin blocks multiple sites of the TGF-β signaling cascade in renal cells〔J〕.Kidney Int,2004;66(1):112-20.
3 Tapia E,Zatarain-Barrón ZL,Hernández-Pando R,etal.Curcumin reverses glomerular hemodynamic alterations and oxidant stress in 5/6 nephrectomized rats〔J〕.Phytomedicine,2013;20(3):359-66.
4 Ghosh SS,Massey HD,Krieg R,etal.Curcumin ameliorates renal failure in 5/6 nephrectomized rats:role of inflammation〔J〕.Am J Physiol Renal Physiol,2009;296(5):F1146-57.
5 Sheu JJC,Lee CC,Hua CH,etal.LRIG1 modulates aggressiveness of head and neck cancers by regulating EGFR-MAPK-SPHK1 signaling and extracellular matrix remodeling〔J〕.Oncogene,2013;33(11):1375-84.
6 Beckham TH,Cheng JC,Lu P,etal.Acid ceramidase induces sphingosine kinase 1/S1P receptor 2-mediated activation of oncogenic Akt signaling〔J〕.Oncogenesis,2013;2(6):e49.
7 Ren S,Babelova A,Moreth K,etal.Transforming growth factor-β2 upregulates sphingosine kinase-1 activity,which in turn attenuates the fibrotic response to TGF-β2 by impeding CTGF expression〔J〕.Kidney Int,2009;76(8):857-67.
8 Natoli TA,Husson H,Rogers KA,etal.Loss of GM3 synthase gene,but not sphingosine kinase 1,is protective against murine nephronophthisis-related polycystic kidney disease〔J〕.Hum Mol Genet,2012;21(15):3397-407.
9 Geoffroy K,Troncy L,Wiernsperger N,etal.Glomerular proliferation during early stages of diabetic nephropathy is associated with local increase of sphingosine-1-phosphate levels〔J〕.FEBS Lett,2005;579(5):1249-54.
10 Ghosh SS,Krieg R,Massey HD,etal.Curcumin and enalapril ameliorate renal failure by antagonizing inflammation in 5/6 nephrectomized rats:role of phospholipase and cyclooxygenase〔J〕.Am J Physiol Renal Physiol,2012;302(4):F439-54.
11 Yamanaka M,Shegogue D,Pei H,etal.Sphingosine kinase 1 (SPHK1) is induced by transforming growth factor-beta and mediates TIMP-1 up-regulation〔J〕.J Biol Chem,2004;279(52):53994-4001.
〔2015-06-17修回〕
(编辑 苑云杰/曹梦园)
辽宁省教育厅科研项目(No.L2012312)
周 盾(1967-),女,教授,硕士,硕士生导师,主要从事肾小球硬化的发病及机制研究。
袁红霞(1979-),女,讲师,博士,硕士生导师,主要从事感染与免疫性疾病的发病机制及治疗研究。
R59
A
1005-9202(2016)24-6093-03;
10.3969/j.issn.1005-9202.2016.24.022
