F修饰对SiO2@TiO2亲疏水性及光催化性能的影响
2016-02-05王洪慧何结红乔洁琼谢作甜
王洪慧, 何结红, 乔洁琼, 谢作甜, 朱 建
(1.上海师范大学 生命与环境科学学院,资源化学教育部重点实验室,上海 200234;2.上海师范大学 生命与环境科学学院,上海市稀土功能材料重点实验室,上海 200234)
F修饰对SiO2@TiO2亲疏水性及光催化性能的影响
王洪慧1,2, 何结红1,2, 乔洁琼1,2, 谢作甜1,2, 朱 建1,2
(1.上海师范大学 生命与环境科学学院,资源化学教育部重点实验室,上海 200234;2.上海师范大学 生命与环境科学学院,上海市稀土功能材料重点实验室,上海 200234)
采用两步法制备了氟修饰疏水性F-SiO2@TiO2材料.以三乙氧基氟硅烷(TEFS)为硅源,采用后嫁接的方法在短孔道MCM-41小球表面引入F原子,再利用醇热法在F-MCM-41小球表面生长TiO2纳米晶颗粒.利用透射电子显微镜(TEM)、X射线粉末散射(XRD)、X射线光电子能谱(XPS)、N2气吸脱附等手段表征了材料的物相组成和表面结构.研究表明:所制备的氟修饰F-SiO2@TiO2纳米复合材料为核壳结构,具有较大的比表面积、较好的介孔结构及较佳的热稳定性.同时,TiO2纳米颗粒在F-MCM-41小球表面分散均匀、结晶度高、颗粒尺寸小且均一、与F-SiO2结合牢固.重量吸附实验和光催化实验进一步证实F修饰可抑制水的吸附有利于提高F-SiO2@TiO2材料的疏水性和对气相有机污染物的光催化性能.
介孔SiO2; TiO2; F修饰; 亲疏水性; 光催化
0 引 言
利用光催化技术降解有机废水已成为解决环境污染问题的一种有效手段.TiO2因其无毒无害、稳定性好、光催化效率较高而备受人们关注[1-11].但单一使用光催化技术存在时效性问题,即难以在短时间内迅速降低污染物浓度.采用吸附剂辅助光催化剂,则能实现对污染物的快速去除和持续降解.吸附-光催化协同去除空气和水中的有机污染物成为最具实用价值的污染物处理方法之一[12-15].吸附-光催化材料多选用分子筛材料和介孔二氧化硅材料与光催化剂(如TiO2)复合来提高对污染物的降解效率,主要是因为这些吸附剂具有有序的多孔结构、大的表面积、高的热稳定性和优异的表面性能,可以使TiO2高度分散,同时也可以提高TiO2纳米颗粒的结晶度[16].然而,吸附剂对有机污染物的吸附和富集能力受其表面亲疏水性的影响较大.研究发现,由于介孔二氧化硅材料表面大量的羟基可以作为H2O的吸附位点,相比于有机物,H2O更易吸附在上面,从而降低了TiO2的光催化活性[17].
为了提高介孔二氧化硅吸附材料的疏水性能,同时保证其孔道结构不被破坏,在孔表面引入疏水性基团,利用TEFS将MCM-41表面的羟基替换为稳定≡Si-F[17](图1),改变孔壁表面微组成,提高介孔二氧化硅的吸附性能.选用三乙氧基氟硅烷(TEFS)为硅源,以后嫁接的方式在MCM-41的表面引入F原子,再通过原位生长法引入纳米晶TiO2,合成了F修饰的MCM-41@ TiO2纳米复合材料.
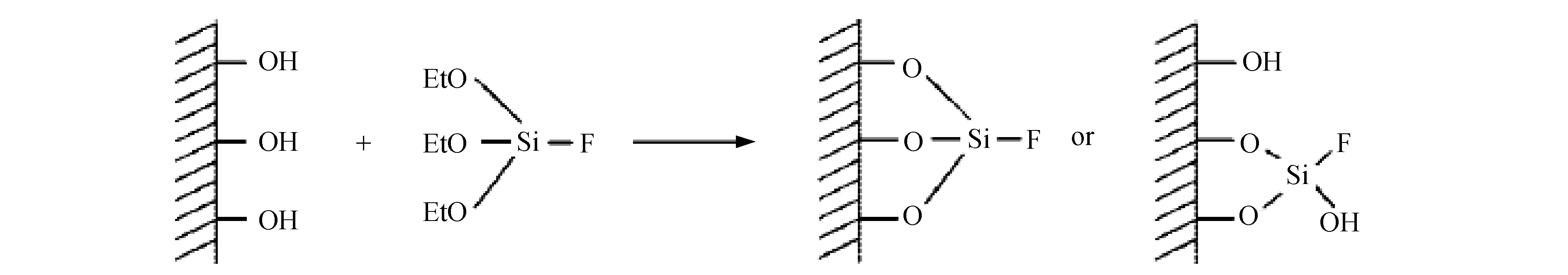
图1 介孔SiO2孔表面F修饰机理示意图
1 实验部分
1.1 催化剂的制备
1.1.1 短孔道介孔SiO2纳米小球的制备
将0.89 g十六烷基三甲基溴化铵(CTAB)、0.25 g NaOH以及428 mL水混合,在80 ℃ 搅拌1.5 h后加入20 mmol正硅酸乙酯(TEOS),继续搅拌2 h后在80 ℃静置20 h,水洗、抽滤、烘干,550 ℃焙烧6 h后得到介孔SiO2(MCM-41)小球.
1.1.2 F修饰短孔道介孔F-SiO2纳米小球的制备
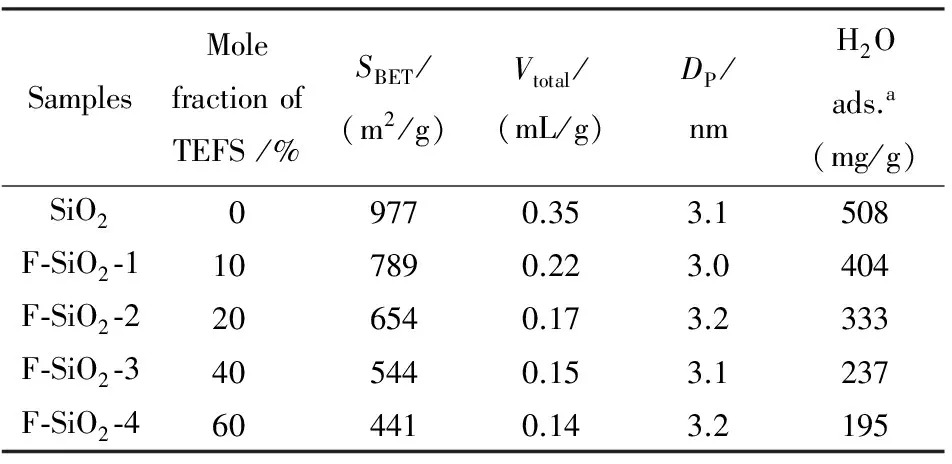
表1 F-SiO2样品的结构参数
H2O adsa.样品在P/Po=0.88时对水的饱和吸附量
将一定量的三乙氧基氟硅烷(TEFS)与100 mL异丙醇混合,室温下搅拌0.5 h后加入0.5 g MCM-41,搅拌5 h后110 ℃真空干燥12 h,550 ℃空气中焙烧5 h,升温速度为2 ℃ /min,得到F修饰的介孔SiO2纳米小球,即F-SiO2-m.m代表加入不同量三乙氧基氟硅烷后得到的样品,如表1所示.
1.1.3 F-SiO2@TiO2吸附-光催化纳米复合材料的制备
准确称取0.20 g的F-SiO2样品加入到30 mL叔丁醇中,在40 ℃条件下搅拌2 h使样品分散均匀,再加入10 mL乙二醇搅拌30 min.最后加入0.14 mL四氯化钛,搅拌4 h后将前驱体溶液转移至水热釜中,在160 ℃釜热48 h.得到的白色固体经无水乙醇洗涤后在80 ℃烘干6 h.再将样品转移至马弗炉中,在700 ℃空气气氛中焙烧4 h,升温速率为2 ℃/min,材料标记为F-SiO2@TiO2-m.
1.2 催化剂的表征
采用Rigacu公司D2000型X射线衍射仪进行样品的物相分析(Cu Kα辐射为射线源,λ=0.154 nm,石墨单色器,管压40 kV,管流20~30 mA,扫描速率1.2(°) /min).采用 Quantachrome 公司的NOVA 4000e自动物理吸附仪测定样品在-196 ℃下对N2吸附/脱附等温线,由BET方程计算样品比表面积,由BJH等效圆柱模型计算孔分布.采用日本 HITACHI 公司的S4800 型冷场发射扫描电子显微镜(工作电压为3.0 kV)和JEM 2010 型透射电子显微镜观察样品的微观形貌.透射电镜测试前样品经研磨,并在乙醇中超声处理.采用英国Hiden公司的IGA100B全自动重量吸附仪来研究材料的吸附性能.
1.3 催化剂的评价
采用自制的气-固相光催化反应器进行样品的吸附和光催化性能测试.称取吸附-光催化剂50.0 mg,用微型进样针将5 μL甲苯注入2 L圆柱形反应器中(甲苯起始反应质量浓度为2 180±20 mg/m3).保持反应器温度为40 ℃,在无光条件下进行暗光吸附2 h,每0.5 h 采集1次气体样品,用气相色谱(Shimadzu GC-2014C)进行在线含量分析.吸附平衡后,打开氙灯光源(300 W,15 mA)进行光催化降解实验,光照4 h,每1 h采样1次,进行含量分析.根据甲苯浓度的变化,比较所制备不同F-SiO2@TiO2纳米复合材料的吸附-光催化活性.每次活性测试重复3次,重复实验结果在允许的误差范围以内(±5 %).
2 结果与讨论
2.1 F-SiO2样品的结构分析
不同F修饰量的F-SiO2样品的小角XRD分析如图2所示.所有样品均在2θ=2.5°左右出现一个尖锐的小角衍射峰,表明所制备的F-SiO2样品具有有序介孔结构.当F含量较低时,在高角度还出现了2个弱衍射峰,分别对应于(110)和(200)面,表明样品具有二维六方介孔结构[18-19].随着F修饰量的增加,样品的小角衍射峰强度逐渐降低,但在2θ=2.5°依然保持着清晰的小角衍射峰.XRD结果表明,F的修饰可能造成孔道堵塞,引起样品有序度的下降,但不会造成结构性破坏,F修饰后的样品依然保持着较好的介孔有序度.
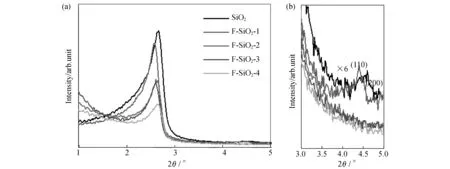
图2 (a)不同F修饰量F-SiO2样品小角XRD图;(b)局部放大图
不同F修饰量的F-SiO2样品的孔结构参数如表1所示.随着F修饰量的增加,样品的比表面积、孔容都逐渐降低.当TEFS加入量达到60%(摩尔分数)时F-SiO2-4样品的比表面积最小为441 m2/g.同时研究发现,TEFS的引入并未引起样品孔径的减小,所有样品的孔径均在3.1 nm左右.这与一般文献报道的,由于引入含长链烷基的有机硅烷对介孔二氧化硅造成孔道堵塞而引起的孔径减小有一定的区别[20],可能与≡Si-F键的键长较短有关.由此可见,以TEFS为硅烷可以成功地将F修饰到SiO2孔道中而不会造成孔径的减小.
2.2 F-SiO2样品对水的吸附能力分析
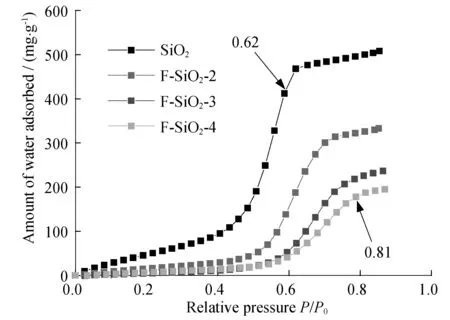
图3 F-SiO2样品对H2O的吸附曲线图
图3为 F-SiO2样品对H2O的吸附曲线图.根据 IUPAC对具有介孔结构材料的界定[21],所有样品对H2O的吸附曲线均呈现第 IV 型吸附模式.随着F修饰量的增加,样品对H2O的吸附能力逐渐降低.这一方面是由于样品比表面积的减小导致饱和吸附量减小,表现为高分压(P/P0>0.8)吸附饱和时样品对水的吸附量随F的引入而成比例减小.另一个方面,随F引入量的增加,饱和吸附的分压点逐渐向高压方向移动.纯介孔SiO2在P/P0=0.62时即达到吸附饱和,而F-SiO2-4在P/P0=0.81时才达到吸附饱和.这一结果表明F修饰降低了样品表面的亲水性,导致吸附饱和分压后移,这意味着F含量高的样品的抗湿性更强,即在高湿度条件下更能有效吸附有机污染物.
2.3 F-SiO2@TiO2样品的形貌结构分析
图4为负载TiO2后F-SiO2@TiO2纳米复合材料样品的XRD图谱.从图4(a)样品的小角 XRD 图中可以看出,样品负载等量TiO2后,随着F修饰量的增加,样品的介孔有序度逐渐降低,但依然保持着较好的有序介孔结构.在F-SiO2-4样品上后续负载TiO2后,样品的介孔有序度大大降低,主要原因是TiO2负载在F-SiO2-4的表面,使其孔道部分堵塞.图4(b)为样品的广角XRD图,可以看出,在负载了TiO2后 的F-SiO2@TiO2样品中,随着F修饰量的增加,位于2θ=25.4°的TiO2锐钛矿的特征峰强度逐渐增强.表明TiO2成功负载在F-SiO2样品上,且TiO2保持着锐钛矿晶型.广角XRD半峰宽的减小也进一步表明,F的引入可能有利于TiO2的结晶,使其粒径尺寸逐渐增大.

图4 负载TiO2后F-SiO2@TiO2样品的(a)小角XRD图谱和(b)广角XRD图谱

图5 F-SiO2@TiO2样品的TEM图谱.(a) F-SiO2@TiO2-1;(b) F-SiO2@TiO2-4
图5是负载TiO2后F-SiO2@TiO2样品的TEM图.从图5中可以看出,负载TiO2后,F-SiO2@TiO2样品依然保持着其有序短孔道纳米小球的形貌,与图4 XRD的分析结果相一致.TiO2纳米颗粒均匀地负载在F-SiO2表面,颗粒大小在10 nm左右.随着 F 修饰量的提高,TiO2纳米颗粒的粒径尺寸逐渐增大,与图4 XRD得出结论相同,但增加有限.F-SiO2@TiO2-4样品上TiO2的平均粒径为20 nm.值得说明的是,图5中的样品均是在700 ℃焙烧后获得的.样品在经过高温处理后仍然可以清晰地看到SiO2的孔道结构,说明F-SiO2@TiO2样品具有良好的热稳定性.同时由于F 离子的保护作用,抑制了TiO2纳米颗粒在高温下由锐钛矿相向金红石相的转变,这也有利于TiO2光催化活性的提高.普通纳米TiO2在500 ℃时即发生锐钛矿相向金红石相的转变.
2.4 F-SiO2@TiO2样品对水的吸附性能分析
为了验证TiO2负载对F-SiO2@TiO2样品亲疏水性能的影响,做了样品对H2O的吸附性能测试,如图6.从图6中可以看出,F-SiO2@TiO2负载了等量的TiO2后,样品对H2O的吸附曲线仍然为标准的IV型吸附模式.相比较负载前和负载后的样品,负载TiO2后样品对水的饱和吸附量普遍降低.F-SiO2@TiO2-4样品在P/P0=0.81出的吸附量为83 mg·g-1.而未负载前F-SiO2-4样品的吸附量为183 mg·g-1.对水分子吸附量的降低有利于有机物的吸附.负载TiO2后样品的饱和吸附的分压点均不同程度地向低压方向移动,可能是表面修饰的F离子与TiO2有一定作用,降低了F修饰对样品疏水性的增强作用.
2.5 F-SiO2@TiO2样品光催化降解性能分析
图7为F-SiO2@TiO2样品气相吸附降解甲苯的活性比较.由图7所示,前2 h为暗吸附过程,2~6 h为光降解过程.从样品对甲苯的吸附性能来看,随着F修饰量的提高,样品对甲苯的吸附能力逐渐升高,说明制备的F-SiO2@TiO2具有一定的选择性吸附能力.不同F修饰量的F-SiO2@TiO2样品负载TiO2后,显示出较高的光催化性能.F-SiO2@TiO2-4样品在30 min内将2 180±20 mg/m3的甲苯吸附掉约50%,后续光催化降解过程可进一步将其彻底降解.由此可见,F-SiO2@TiO2材料具备快速富集有机污染物,并且在光照作用下利用TiO2进行持续降解污染物的性能,具有潜在的应用前景.
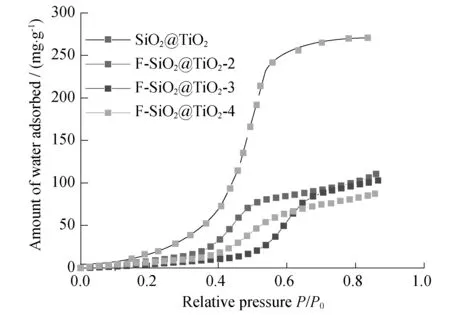
图6 F-SiO2@TiO2样品对H2O的吸附曲线
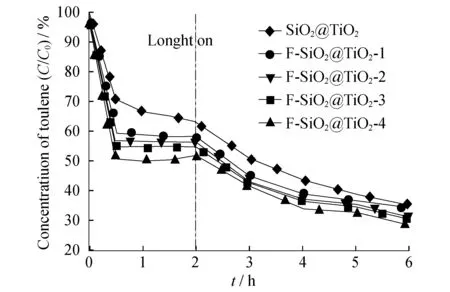
图7 F-SiO2@TiO2样品气相吸附光催化降解甲苯活性图
3 结 论
以 TEFS(三乙氧基氟硅烷)为硅源,以后嫁接的方式在介孔SiO2表面引入F原子,再通过原位生长法合成了F修饰的F-SiO2@TiO2纳米复合材料.在引入F修饰后,介孔SiO2对水的吸附性能降低,F-SiO2疏水性能提高.进一步引入TiO2后,可以实现对气相有机污染物的快速吸附和持续彻底降解.F修饰量最高的F-SiO2@TiO2-4样品显示出最有效的甲苯去除能力.
[1] Fujishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode [J].Nature,1972,238(5358):37-38.
[2] Bian Z F,Zhu J,Cao F L,et al.In situ encapsulation of Au nanoparticles in mesoporous core-shell TiO2microspheres with enhanced activity and durability [J].Chemical Communication,2009,25(25):3789-3791.
[3] Li H X,Bian Z F,Zhu J,et al.Mesoporous Au/TiO2nanocomposites with enhanced photocatalytic activity [J].Journal of the American Chemical,2007,129(15):4538-4539.
[4] Li H X,Bian Z F,Zhu J,et al.Mesoporous titania spheres with tunable chamber stucture and enhanced photocatalytic activity [J].Journal of the American Chemical,2007,129(27):8406-8407.
[5] Bian Z F,Zhu J,Wang J G,et al.Multitemplates for the hierarchical synthesis of diverse inorganic materials [J].Journal of the American Chemical,2012,134(4):2325-2331.
[6] Zhu J,Yang J,Bian Z F,et al.Nanocrystalline anatase TiO2photocatalysts prepared via a facile low temperature nonhydrolytic sol-gel reaction of TiCl4and benzyl alcohol [J].Applied Catalysis B-Environmental,2007,76(1):82-91.
[7] Bian Z F,Zhu J,Wen J,et al.Single-crystal-like titania mesocages [J].Angewandte Chemie-International Edition,2011,50(5):1105-1108.
[8] Zhu J,Wang S H,Wang J G,et al.Highly active and durable Bi2O3/TiO2visible photocatalyst in flower-like spheres with surface-enriched Bi2O3quantum dots [J].Applied Catalysis B-Environmental,2011,102(1-2):120-125.
[9] Cao F L,Wang J G,Lv F J,et al.Photocatalytic oxidation of toluene to benzaldehyde over anatase TiO2hollow spheres with exposed {001} facets [J].Catalysis Communications,2011,12(11):946-950.
[10] Bian Z F,Zhu J,Wang S H,et al.Self-Assembly of Active Bi2O3/TiO2Visible Photocatalyst with Ordered Mesoporous Structure and Highly Crystallized Anatase [J].Journal of Physical Chemistry C,2008,112(16):6258-6262.
[11] Bian Z F,Zhu J,Cao F L,et al.Solvothermal synthesis of well-defined TiO2mesoporous nanotubes with enhanced photocatalytic activity [J].Chemical Communications,2010,46(44):8451-8453.
[12] Kuwahara Y,Aoyama J,Miyakubo K,et al.TiO2photocatalyst for degradation of organic compounds in water and air supported on highly hydrophobic FAU zeolite:Structural,sorptive,and photocatalytic studies [J].Journal of Catalysis,2012,285(1):223-234.
[13] Kamegawa T,Kido R,Yamahana D,et al.Design of TiO2-zeolite composites with enhanced photocatalytic performances under irradiation of UV and visible light [J].Microporous and Mesoporous Materials,2013,165(1):142-147.
[14] Takeuchi M,Kimura T,Hidaka M,et al.Photocatalytic oxidation of acetaldehyde with oxygen on TiO2/ZSM-5 photocatalysts:Effect of hydrophobicity of zeolites [J].Journal of Catalysis,2007,246(2):235-240.
[15] Kuwahara Y,Yamashita H.Efficient photocatalytic degradation of organics diluted in water and air using TiO2designed with zeolites and mesoporous silica materials [J].Journal of Materials Chemistry,2011,21(8):2407-2416.
[16] Joo J B,Dahl Q M,Lee I,et al.Control of the nanoscale crystallinity in mesoporous TiO2shells for enhanced photocatalytic activity [J].Energy & Enviromental Science,2012,5(4):6321-6327.
[17] Kuwahara Y,Maki K,Matsumura Y,et al.Hydrophobic modification of a mesoporous silica surface using a fluorine-containing silylation agent and its application as an advantageous host material for the TiO2photocatalyst [J].Journal of Physical Chemistry C,2009,113(4):1552-1559.
[18] Arai T,Watanabe M,Yanagisawa A.Practical asymmetric Henry reaction catalyzed by a chiral diamine-Cu(OAc)2complex [J].Organic Letters,2007,9(18):3595-3597.
[19] Arai T,Takashita R,Endo Y,et al.Asymmetric syn-selective Henry reaction catalyzed by the sulfonyldiamine-CuCl-pyridine system [J].Journal of Organic Chemistry,2008,73(13):4903-4906.
[20] Zhou B,Hu Y,Cui F,et al.Effect of surface modification of low cast mesopurous SiO2carries on the properties of immobilized lipase[J].Journal of Colloid and Interface Science,2014,417(3):210-216.
[21] Sing K S W,Everett D H,Haul R A W,et al.The effect of heat treatment on the surface properties of gibbsite.II.Isotherms of carbon tetrachloride vapor at 25 C [J].Pure Applied Chemistry,1985,57(4):603-619.
(责任编辑:郁 慧,冯珍珍)
The effect of fluorine modification on hydrophilic-hydrophobic properties and photocatalytic performance of SiO2@TiO2hybrids
WANG Honghui1,2, HE Jiehong1,2, QIAO Jieqiong1,2, XIE Zuotian1,2, ZHU Jian1,2
(1.Key Laboratory of Resource Chemistry,Ministry of Education, College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China; 2.Shanghai Key Laboratory of Rare Earth Functional Materials, College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
Hydrophobic fluorine modified SiO2@TiO2hybrids were prepared by a post-grafting method followed by a solvothermal method.F-SiO2precursor was firstly prepared via a simple post-grafting process using triethoxyfluorosilane as a fluorine-containing silylation agent.Then,nano-sized TiO2particles were formed on the surface of F-SiO2to form F-SiO2@TiO2by a solvothermal process.Different characterizations were performed to show the detailed structure of F-SiO2@TiO2hybrids such as TEM,XRD,XPS and N2adsorption-desorption etc.The results show that F-SiO2@TiO2hybrids with core-shell structure own large surface area,well-ordered mesoporous structure as well as high thermostability.On the other hand,the well dispersed TiO2particles with small and similar size display high crystallinity and strong interaction with F-SiO2.Both the adsorption and the photocatalytic experiments toward degradation of organic compounds show that increasing the content of TEFS reagent could suppress the adsorption of H2O on the surface of F-SiO2@TiO2hybrid.As a result,the F-SiO2@TiO2samples display higher hydrophobic properties and higher photocatalytic activities than SiO2@TiO2sample.
mesoporous SiO2; TiO2; F modification; hydrophobic property; photocatalysis
2016-09-22
国家自然科学基金(21377088,51572174);霍英东基金会(142022)
朱 建,中国上海市徐汇区桂林路100号,上海师范大学生命与环境科学学院,邮编:200234,E-mail:jianzhu@shnu.edu.cn
O 643.32+2
A
1000-5137(2016)06-0736-06
