BMSCs联合3D打印PLLA支架促进兔颅骨PDO的研究
2016-02-05赵丹阳姜闻博张海峰杜子婧
赵丹阳 姜闻博 张海峰 杜 朝 杜子婧 韩 冬
BMSCs联合3D打印PLLA支架促进兔颅骨PDO的研究
赵丹阳 姜闻博 张海峰 杜 朝 杜子婧 韩 冬
目的探讨骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)促进骨膜牵张成骨(Periosteal distraction osteogenesis,PDO)的可行性。方法全骨髓贴壁培养法获取新西兰白兔BMSCs,体外扩增培养并进行成骨、成脂、成软骨诱导分化。用3D打印(Three-dimensional printing,3D printing)的左旋聚乳酸(Poly l-lactic acid,PLLA)支架牵张兔颅骨骨膜,在牵张期结束时,实验组于骨膜与颅骨间隙内注射兔BMSCs,对照组则注射等量生理盐水(Normal saline,NS)。分别在固定期后的4周和8周,对兔颅骨的牵张部位进行取材,行Micro-CT扫描和组织学染色,评价新骨形成情况。结果全骨髓培养法获取的兔BMSCs具有多向分化能力。Micro-CT显示实验组和对照组的牵张区域在4周和8周均有新骨生成,实验组在两个时间点的新生骨量(Bone volume,BV)、骨量/组织量(Bone volume/Tissue volume,BV/TV)、骨密度(Bone mineral density,BMD)、骨小梁数量(Trabecular number,Tb.N)和厚度(Trabecular thickness,Tb.Th)均明显高于对照组,骨小梁间隔(Trabecular separation,Tb.Sp)小于对照组。HE染色显示,实验组与对照组均有新骨生成,实验组新生骨小梁增厚增多,比对照组成熟,且与颅骨皮质的界线不明显。结论在兔颅骨PDO区域内注射自体BMSCs可以补充成骨细胞的不足,有利于骨膜牵张成骨。
骨髓间充质干细胞三维打印左旋聚乳酸骨膜牵张成骨
针对骨折后引起的功能缺陷和外观畸形,尤其是陈旧性骨折造成的大块骨缺损的修复,一直是重建外科领域的重大挑战。临床上常采用移植替代物、引导骨再生(Guided bone regeneration,GBR)和牵张成骨(Distraction ostogenesis,DO)等技术,对骨缺损进行治疗,但均存在不同程度的缺陷。骨膜牵张成骨(Periosteal distraction osteogenesis,PDO)技术是继DO后的又一次突破,它将组织扩张术和GBR相结合,在骨表面和骨膜之间形成人工空间,不需要截骨术或骨皮质切开,仅通过牵张骨膜就可以诱导新骨形成。本实验采用全骨髓贴壁培养法,分离兔骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs),联合三维打印(Three-dimensional printing,3D printing)技术定制的左旋聚乳酸(Polyl-lactic acid,PLLA)支架,牵张兔颅骨骨膜,为修复大块骨缺损提供实验依据。
1 材料与方法
1.1 试剂与仪器
PLLA材料(济南岱罡生物工程有限公司),钛钉(OsteoMed公司,美国)。DMEM/高糖培养基、青霉素、链霉素(HyClone公司,美国),0.25%胰蛋白酶、胎牛血清(Gibco公司,美国),CCK-8试剂盒(Dojindo公司,日本)。
CO2培养箱(Thermo公司,美国),酶标仪(Tecan公司,瑞士),倒置相差显微镜(Zeiss公司,德国),扫描电镜(FEI公司,美国),离子溅射镀膜仪(Quorum公司,英国),力学测试机(Instron公司,美国),Micro-CT扫描仪(Scanco公司,瑞士)。
1.2 实验动物
6~8周龄新西兰大耳白兔16只,雄性,体质量2.5~3 Kg(上海交通大学医学院实验动物科学部)。1.3培养原代BSMCs
1.3.1 BSMCs分离与培养
利用全骨髓贴壁法培养兔BMSCs。抽取骨髓液4~5 mL,使用20 mL完全培养基(含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素)进行培养,第3天开始半换液,经过3次半换液后,每2~3天全换液一次,使用倒置相差显微镜观察细胞形态及生长情况。待BMSCs达到80%~90%融合后,0.25%胰酶消化传代。采用第3代细胞进行后续实验。
1.3.2 绘制BSMCs增殖曲线
胰酶消化第二代BMSCs,计数后1×105cells/mL的密度接种于96孔板,分别于接种后1 d、3 d、5 d、7 d和9 d检测细胞活性。每孔加入10 μL CCK8试剂,于37℃、5%CO2的细胞培养箱中孵育2 h,酶标仪检测450 nm处的光密度值,每组5个复孔,统计后绘制细胞增殖曲线。
1.3.3 BSMCs的多向分化
1.3.3.1 成骨分化
BMSCs以1×105cells/mL的密度接种于6孔板,在完全高糖培养基中加入0.1 μmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 μmol/L维生素C,每3天换液一次,于第7天行碱性磷酸酶染色,第21天行茜素红染色,观察BMSCs向成骨细胞分化情况。
1.3.3.2 成脂分化
BMSCs以1×105cells/mL的密度接种于6孔板,以10-6mol/L地塞米松、10 μm/L胰岛素、0.5 mmol/L IBMX和0.2 mmol/L吲哚美辛,进行成脂诱导分化,第12天行油红染色,倒置相差显微镜下观察。
1.3.3.3 成软骨分化
用微球培养方式诱导BMSCs分化为软骨细胞,将细胞密度调整为1×107cells/mL进行接种,待细胞贴附后加入成软骨诱导液,成软骨诱导液含10ng/mL TGF-β1、1×ITS、4.7 μg/mL亚油酸、0.5 mg/mL BSA、100 nM地塞米松、37.5 μg/mL维生素C。诱导21 d后,将形成的软骨小球固定,脱水,包埋,切片,阿尔新蓝染色,检测细胞外基质中的蛋白聚糖。
1.43 D打印PLLA支架
本实验采用熔融沉积造型术基础上的3D打印技术。首先以计算机辅助设计软件设计支架,PLLA尺寸设置为长12 mm、宽10 mm、高1 mm,在边缘恰当位置设置三个直径2 mm的孔洞,然后将设计完成的参数输入3D打印机,设置孔径为300 μm,调整相关打印参数,即可按生物挤压的方法进行材料的批量打印,最后对多余的材料进行修整即可。
1.5 PLLA支架的特点
1.5.1 扫描电镜
将BMSCs以1×105cells/mL的接种于3D打印的PLLA支架,7 d后将材料-细胞复合物用临界点干燥法干燥,2.5%戊二醛固定,乙醇梯度脱水,加入乙酸异戊酯替换30 min后,使用双面胶将支架固定在电镜观察台上,离子溅射镀膜仪表面喷金后抽真空,观察拍摄。
1.5.2 力学测试
将打印好的PLLA支架行力学测试,重复5组,记录应力-应变曲线并分析。
1.5.3 毒性试验
PLLA材料照射紫外线杀菌后,浸没于完全培养基中(10 mL/cm2),配制标准1×浸提液,同样的方法准备0.5×、2×和4×的浸提液,并于培养箱中孵育48 h后4℃冷藏。将BMSCs消化后接种于96孔板(1×105cells/mL,100 μL/well),细胞贴壁后,将培养基更换为不同浓度的浸提液,培养1 d、3 d、5 d、7 d后CCK-8法检测细胞活性。以完全培养基中的细胞作为阴性对照,RGR=(实验组光密度值/对照组光密度值)×100%。毒性分为5级:分级0,RGR≥100%;分级1,RGR≥80%;分级2,RGR≥50%;分级3,RGR≥30%;分级4,RGR≥0。毒性分级为0和1的材料可用于体内实验。
1.6 牵张装置的组成和设计
骨膜牵张装置由三部分组成,PLLA支架(长×宽×高=12 mm×10 mm×1 mm,包括三个直径2 mm的孔)、两枚自钻钛钉(长度5 mm,直径1.5 mm)和一枚自攻钛钉(长度12 mm,直径2 mm)。PLLA支架构成了整个牵张装置的主体,两枚自钻螺钉用于固定PLLA网,通过PLLA网一端的两个孔将支架固定在兔的颅骨上,另一根自攻螺钉用于牵张支架,使支架的另一端不断抬升,形成斜坡,从而达到牵张骨膜的效果。总的来说,就是在骨膜和颅骨间形成一个楔形的间隙,既可以有效防止周围组织的入侵,也为成骨提供空间(图1)。
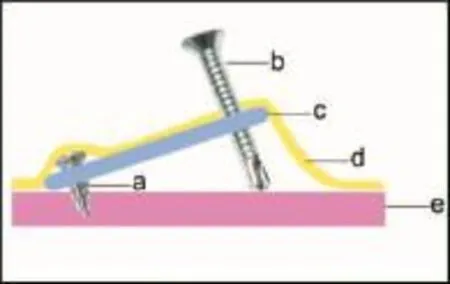
图1 牵张装置的组成和设计Fig.1Constitution and design of the distraction device
1.7 手术方法
在兔前额处由后向前设计一“L”型切口,切开皮肤,与骨膜分离后,再以倒“L”型切开并剥离骨膜,使骨质充分暴露,注意保护好毗邻的颞浅血管分支及骨膜的完整性。该切口设计刚好可以使牵张螺钉的位置经过皮肤切口。将PLLA牵张支架置于骨膜下空间并用自钻螺钉固定在颅骨皮质骨上。最后,使骨膜完全覆盖材料后,逐层缝合骨膜及皮肤。
经过7 d的延迟期,于术后1周拆除部分皮肤切口缝线,在支架的牵张螺钉部位以2 mm切口切开骨膜,将消毒后的自攻螺钉拧入PLLA支架。螺钉每旋转180°前进0.5 mm。牵张螺钉每天旋转360°,每天旋转两次,5 d后牵张螺钉共进入5 mm。实验组于牵张最后一天注射BMSCs,将1×106BMSCs以200 μL NS重悬并注射于牵张间隙内,对照组注射等量的NS。
实验动物均术后3 d连续肌注抗生素。在固定期内,观察螺钉有无脱落或松动,切口是否感染。
1.8 Micro-CT扫描
于牵张术后4周和8周时,将实验组和对照组牵张区域的颅骨和牵张装置一并取材,4%多聚甲醛固定48 h后,使用高分辨Micro-CT,在电压90 KV、电流200 μA下以连续增量20 μm进行扫描。将扫描后的图像用中值滤波法去除噪声,并用固定阈值提取矿化骨成分。之后,采用Scanco uCT100分析软件对颅骨以上100个扫描层面获得的三维扫描图像进行统计分析。
1.9 HE染色
在组织学染色之前,将扫描后的颅骨(去除牵张装置)置于乙二胺四乙酸(EDTA)中脱钙,2~3个月后待脱钙完全,流水冲洗过夜,乙醇梯度脱水,石蜡包埋,7 μm厚度切片,HE染色,对牵张区域内的新生骨组织进行形态分析。
1.10 统计方法
所有的统计结果均以(x±s)表示,使用t检验进行数据差异分析,P<0.05为差异具有统计学意义。
2 结果
2.1 原代BMSCs的形态观察和增殖曲线
3次半换液后,从第12天全换液开始,倒置相差显微镜下可见细胞呈集落生长,同一集落处细胞紧密,形状如成纤维细胞的梭形,增殖迅速,造血细胞随着换液和传代逐渐消失。20 d时集落融合成片,细胞变得扁平,呈多层生长状态,按1∶2进行传代,传代后的细胞在培养皿中均匀贴壁,细胞形态不改变,呈成纤维细胞样的梭形,一般5~6 d即可达到80%~90%融合(图2)。

图2 BMSCs的形态Fig.2Morphology of BMSCs
2.2 BMSCs的增殖曲线
CCK8检测细胞活性与细胞数量呈正比,第三代细胞增殖曲线表明BMSCs符合Logistic S形生长曲线,传代后1~3 d细胞生长缓慢,4~7 d进入快速增长期,7 d后进入生长平台期(图3)。

图3 BMSCs的增殖曲线Fig.3Proliferation curve of BMSCs
2.3 BMSCs的成骨、成脂以及成软骨分化
成骨诱导7 d后,碱性磷酸酶染色显示成骨诱导组颜色深于对照组。诱导21 d后,成骨诱导组的茜素红染色可见钙结节沉积明显多于对照组。表明兔BMSCs经成骨诱导后可以向成骨方向分化。
对成脂诱导12 d后的BMSCs行油红染色,细胞内出现红色的脂滴,大小不一,成串排列并围绕在细胞核周围,而对照组未观察到胞浆内脂滴形成。说明兔BMSCs可在特定条件下快速分化为脂肪细胞。
BMSCs在经过软骨微球诱导分化形成软骨小球,对照组细胞在完全培养基中则没有微球形成。软骨小球阿尔新蓝染色阳性,细胞外基质酸性多糖呈蓝色,细胞核用品红染成红色,说明BMSCs在体外具有向软骨分化的潜能(图4)。
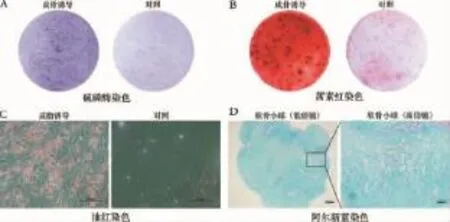
图4 BMSCs的成骨、成脂、成软骨分化Fig.4The osteogenic,adipogenic and chondrogenic differentiation of BMSCs
2.4 扫描电镜
扫描电镜可见3D打印的PLLA支架呈现纵横交错的多孔通道,细胞复合培养7 d后可见BMSCs伸出伪足,附着于材料表面,细胞之间有丝状纤维生成(图5)。

图5 PLLA支架扫描电镜观察Fig.5SEM observation of PLLA scaffold
2.5 力学测试
PLLA支架力学测试显示,材料具有一定的弹性,弹性模量为(2052.8±56.21)MPa,最大弯曲载荷为(72.2±4.97)N,最大弯曲位移是(1.4±0.06)mm(图6)。本实验中,支架未见断裂现象,说明其力学性能可以满足牵张要求。

图6 PLLA支架应力应变曲线Fig.6Stress-strain curve of PLLA scaffold
2.6 毒性试验
不同浓度的PLLA支架浸提液,在不同时间作用于BMSCs的毒性分级均在0~1之间,而且高浓度的浸提液与低浓度浸提液相比,对细胞生长的影响并无明显差异,可见PLLA支架具有良好的生物相容性,适合用于体内实验。
2.7 Micro-CT扫描
实验组和对照组在两个取材时间点,均肉眼可见在颅骨和PLLA支架之间的牵张区域内,有新生组织形成,经Micro-CT扫描证实均有新生骨质长出。对新生的骨质进行定量分析发现,NS和BMSCs组8周时的骨量(Bone volume,BV)、骨量/组织量(Bone volume/Tissue volume,BV/TV)以及骨密度(Bone mineral density,BMD)相对4周时增长明显。BMSCs组在这两个时间点的BV、BV/TV以及BMD都比NS组高。实验组新生骨小梁的数量(Trabecular number,Tb.N)和厚度(Trabecular thickness,Tb. Th)高于对照组,骨小梁之间的间隔(Trabecular separation,Tb.Sp)低于对照组(图7)。

图7 各组Micro-CT扫描Fig.7Micro-CT scanning of each group
2.8 HE染色
HE染色同样证实了新骨生成。4周时即出现骨小梁结构,垂直于颅骨表面,与颅骨皮质分界清晰,实验组成骨较对照组成熟,软组织较少。8周时骨小梁增粗增多,逐渐成熟,BMSCs组新生骨组织较NS组密集,与原有骨面垂直关系基本消失(图8)。
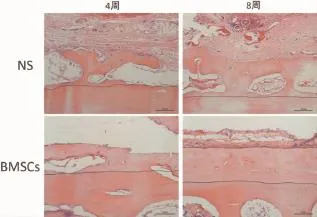
图8 各组组织学观察(HE染色)Fig.8Histological observation of each group(HE staining)
3 讨论
骨膜中富含可以分化为成骨细胞的骨祖细胞。PDO是一项新兴的技术,利用骨膜的成骨能力,在骨表面和骨膜间形成人工空间,通过牵张骨膜再生骨组织。2002年,Schmidt等[1]首先通过组织学证实仅控制对骨膜的牵张,而不切开骨皮质就可诱导新骨形成。PDO、DO均属于膜性成骨,Kanno等[2]对人的骨膜细胞施以牵张力后,发现牵张力可刺激骨膜细胞表达成骨和成血管生长因子。在骨膜牵张的过程中,缓慢而稳定的牵张力可以激活骨膜中的间充质干细胞和未分化的成骨细胞,诱导分化为具有较高活性的成骨细胞,甚至钙化为成熟的骨组织。与DO相比,PDO的优势在于不需要骨皮质切开或截骨术,对机体损伤小;与移植替代物相比,PDO新生的骨组织用于骨缺损的治疗类似于自体骨移植,避免了免疫相关的并发症,解决了供体不足的问题。
Sencimen等[3]在对PDO和DO进行组织形态学比较时发现,PDO形成的骨量不及DO,而且DO形成的骨更加致密,PDO新生骨则富含脂肪组织,这是由于PDO成骨细胞仅来源于骨膜,而DO在成骨过程中成骨细胞和营养来源除了骨膜,还有骨折断端暴露的骨组织。有研究采用骨皮质钻孔来改善这一问题[4-5]。骨皮质表面钻孔暴露骨松质有利于骨髓和骨内膜中的干细胞释放,同时引起出血增多,允许成血管细胞进入膜下空间,还有利于骨组织的血管化。Saulacic等[6]的研究表明,如果骨髓腔没有暴露,那么新生骨主要取决于骨膜,反之将取决于皮质骨,说明骨髓和骨内膜对PDO新骨形成均存在影响。为了减少对机体的损害,本实验通过注射自体BMSCs来促进PDO,BMSCs注射与骨皮质钻孔可以达到相同的效果,两者均能克服传统PDO中成骨细胞来源不足的问题。
BMSCs是具有多向分化潜能的干细胞,来源广泛、扩增表型稳定,是目前组织工程最为理想的种子细胞[7]。BMSCs分离方法有密度梯度离心法和贴壁筛选法,本实验采用全骨髓贴壁法分离兔BMSCs,贴壁能力强,增殖旺盛,体外传代后可稳定维持其生长特性,经诱导培养的BMSCs可以分别向成骨、成脂和成软骨分化,说明分离纯化得到的BMSCs具有干细胞特性。本实验在PDO的骨皮质和骨膜之间注射自体BMSCs,Mirco-CT和组织学染色均表明新生骨的骨量、厚度和矿化程度上均明显高于对照组,说明注射BMSCs有利于在骨膜牵张区诱导成骨。有研究表明,BMSCs不仅参与成骨,还可以分泌足量的VEGF促进新生血管的形成[8]。今后的研究中,我们还将进一步探索其对新生骨组织血管化的影响,以及最佳注射时间和注射频率。
为了获得良好的成骨效果,必须对骨膜进行稳定且持续的牵张。传统的U型牵张装置虽然可以对骨膜进行可控牵张,及时调整牵张的速率和频率,但对组织(特别是骨膜)损伤大,偶尔也报道有出现螺钉松动、钛网脱离等问题[1,3,6,9-12]。本实验在牵张装置的设计上进行了改进,采用3D打印的PLLA支架和钛钉进行牵张,不仅简化了手术过程,对组织的损伤也相应减小。PLLA是安全可靠的可降解生物材料,具有较高的生物强度,其降解速度也低于体内骨组织发生的速度。生物可降解牵张装置的使用既避免了二次取出带来的诸多并发症,也符合仿生构建组织工程骨的理念。3D打印技术已经在口腔颌面外科、骨科以及组织工程等领域用于骨缺损的修复,利用三维打印设计个性化的植入物,可通过调整支架孔隙的大小和形状来满足不同生物力学强度和细胞黏附等要求[13-14]。Kostopoulous等[15]探讨骨膜在下颌形成中的作用时发现,骨膜牵张装置应该打孔以保持骨膜与骨皮质间的沟通。我们利用三维打印技术定制一个既满足牵张要求,又具有孔隙结构的PLLA支架,在具备牵张力学强度的同时,保证骨膜与骨皮质之间的交互作用。今后我们还将尝试利用3D打印技术打印出不同孔隙的牵张支架,观察牵张支架的孔隙大小对PDO的影响。
骨膜牵张成骨最初应用于牵张萎缩的牙槽骨,以增加高度和宽度。以往的牵张装置大多放置于下颌骨的内外侧面,但是牙槽骨间隙狭窄,手术操作困难,且牵张装置在术后会因咀嚼而脱落。Steven等[16]利用胫骨骨膜获得新生骨组织,与下颌骨相同的是,该方法受骨膜的面积和空间所限,再生骨量不足,难以修复大块的骨缺损。Kessler等[17]在猪的颅骨骨膜下植入钛网和螺钉,通过螺钉的动态旋转牵张骨膜。由于颅骨骨膜相对较厚,且面积大、易于分离,利用颅骨骨膜进行牵张在某种程度上解决了骨组织来源不足的问题,也减少了供区损伤。牵张部位的选择决定着牵张的效果,平坦的骨质以及强韧的骨膜会大大提高实验的成功率。所以,为了获得最佳的成骨效果,本实验选择对颅骨骨膜进行牵张。此外,牵张位置还应尽可能离切口缝合位置要远,以免在牵张过程中张力过大,伤口裂开,导致实验失败。
目前针对骨缺损的治疗还存在着很多争议,PDO技术已被应用于治疗萎缩的牙槽骨、腭裂等先天性疾病中,但是大多研究还主要集中在动物实验上,很少有临床应用报道,主要是因为存在牵张装置不稳定、软组织损伤和感染等并发症。理论上,骨膜牵张成骨得到的新生骨可以应用于由甲状旁腺机能亢进、钙代谢紊乱、佝偻病、创伤、感染和先天畸形或其他病理条件所造成的各个部位的骨缺损。骨膜牵张成骨技术理应与组织工程技术及三维打印技术相结合,使用可降解材料通过打印出与骨缺损一致的牵张装置,获取功能性的组织工程骨,同时实现功能和美学上的修复。
[1]Schmidt BL,Kung L,Jones C,et al.Induced osteogenesis by periosteal distraction[J].J Oral Maxillofac Surg,2002,60(10): 1170-1175.
[2]Kanno T,Takahashi T,Ariyoshi W,et al.Tensile mechanical strain up-regulates Runx2 and osteogenic factor expression in human periosteal cells:implications for distraction osteogenesis [J].J Oral Maxillofac Surg,2005,63(4):499-504.
[3]Sencimen M,Aydintug YS,Ortakoglu K,et al.Histomorphometrical analysis of new bone obtained by distraction osteogenesis and osteogenesis by periosteal distraction in rabbits[J].Int J Oral Maxillofac Surg,2007,36(3):235-242.
[4]Oda T,Kinoshita K,Ueda M.Effects of cortical bone perforation on periosteal distraction:an experimental study in the rabbit mandible[J].J Oral Maxillofac Surg,2009,67(7):1478-1485.
[5]Yamauchi K,Nogami S,Tanaka K,et al.The effect of decortication for periosteal expansion osteogenesis using shape memory alloy mesh device[J].Clin Implant Dent Relat Res,2015,17(Suppl 2): e376-e384.
[6]Saulacic N,Hug C,Bosshardt DD,et al.Relative contributions of osteogenic tissues to new bone formation in periosteal distraction osteogenesis:histological and histomorphometrical evaluation in a rat calvaria[J].Clin Implant Dent Relat Res,2013,15(5):692-706.
[7]Lennon DP,Caplan AI.Isolation of human marrow-derived mesenchymal stem cells[J].Exp Hematol,2006,34(11):1604-1605.
[8]Wu Y,Chen L,Scott PG,et al.Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis[J].StemCells,2007,25(10):2648-2659.
[9]Casap N,Venezia NB,Wilensky A,et al.VEGF facilitates periosteal distraction-induced osteogenesis in rabbits:a micro-computerized tomography study[J].Tissue Eng Part A,2008,14(2):247-253.
[10]Altug HA,Aydintug YS,Sencimen M,et al.Histomorphometric analysis of different latency periods effect on new bone obtained by periosteal distraction:an experimental study in the rabbit model[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2011,111(5):539-546.
[11]Bayar GR,Gunaydin Y,Ortakoglu K,et al.Histomorphometric analysis of new bone obtained by osteogenic periosteal distraction in ovariectomized rabbits[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2012,113(4):472-479.
[12]Suer BT,Ortakoglu K,Gunaydin Y,et al.Effects of the hyperbaric oxygen on de novo bone formation during periosteal distraction [J].J Craniofac Surg,2014,25(5):1740-1745.
[13]Choi JW,Kim N.Clinical application of three-dimensional printing technology in craniofacial plastic surgery[J].Arch Plast Surg, 2015,42(3):267-277.
[14]Do AV,Khorsand B,Geary SM,et al.3D printing of scaffolds for tissue regeneration applications[J].Adv Healthc Mater,2015,4 (12):1742-1762.
[15]Kostopoulos L,Karring T.Role of periosteum in the formation of jaw bone An experiment in the rat[J].J Clin Periodontol,1995,22 (3):247-254.
[16]Stevens MM,Marini RP,Schaefer D,et al.In vivo engineering of organs the bone bioreactor[J].PNAS,2005,102(32):11450-11455. [17]Kessler P,Bumiller L,Schlegel A,et al.Dynamic periosteal elevation[J].Br J Oral Maxillofac Surg,2007,45(4):284-287.
Research of Bone Marrow Mesenchymal Stem Cells Combined with Three-dimensional Printed Poly L-lactic Acid for Promoting Periosteal Distraction Osteogenesis of Rabbit Skull
ZHAO Danyang1,JIANG Wenbo2,ZHANG Haifeng1,DU Chao1,DU Zijing1,HAN Dong1.1 Department of Plastic and Reconstructive Surgery;2 Clinical Translational Research and Development Center of 3D Printing Technology,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:HAN Dong(E-mail:handong12000@163.com).
ObjectiveTo investigate whether bone marrow mesenchymal stem cells(BMSCs)can promote periosteal distraction osteogenesis(PDO).MethodsBMSCs isolated from New Zealand white rabbits were cultured by the whole bone marrow adherent method and induced to differentiate into osteocytes,adipocytes and chondrocytes in vitro.Poly l-lactic acid (PLLA)scaffold produced by three-dimensional printing(3D printing)technology was used to distract the calvarial periosteum of rabbit.At the end of distraction period,BMSCs were injected into the gap between periosteum and skull in experimental group while the control group received equal normal saline(NS).The distraction parts of rabbits'skull were collected after 4 and 8 weeks of consolidation periods.The newly formed bone of both groups was evaluated by Micro-CT scanning and histological staining.ResultsBMSCs obtained by the whole bone marrow culture method had the ability of multi-directional differentiation.Micro-CT scanning showed that there were new tissues formed in the distraction area at each time point both in experimental group and control group.The bone volume(BV),bone volume/tissue volume(BV/TV), bone mineral density(BMD),trabecular number(Tb.N)and trabecular thickness(Tb.Th)in experimental group were higher than that in control group,however,the trabecular separation(Tb.Sp)in the experimental group was lower than that of the control group.HE staining also indicated new bone formation both in experimental group and control group.Compared withthe control group,the newly formed trabecular bone in the experimental group was thicker and maturer,and the boundary between the new bone and the skull cortex was not obvious.ConclusionInjection of autologous BMSCs into the PDO region of rabbit skull can supplement the deficiency of osteocytes,which is beneficial to PDO.
Bone marrow mesenchymal stem cells;Three-dimensional printing;Poly l-lactic acid; Periosteal distraction osteogenesis
Q813.1+2
A
1673-0364(2016)06-0340-07
2016年9月23日;
2016年11月14日)
10.3969/j.issn.1673-0364.2016.06.003
国家自然科学基金项目(81272132,81571944)。
200011上海市上海交通大学医学院附属第九人民医院整复外科(赵丹阳,张海峰,杜朝,杜子婧,韩冬);3D打印技术临床转化研发中心(姜闻博)。
韩冬(E-mail:handong12000@163.com)。
